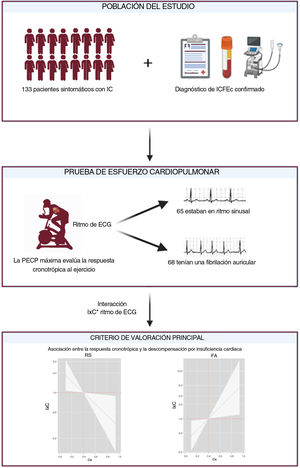
Poco se sabe sobre la utilidad de la respuesta de la frecuencia cardiaca (FC) al ejercicio para la estratificación del riesgo en la insuficiencia cardiaca con fracción de eyección conservada (ICFEc). El objetivo de este estudio fue evaluar la asociación entre la respuesta de la FC al ejercicio y el riesgo de episodios de descompensación por insuficiencia cardiaca (DIC) en pacientes sintomáticos estables con ICFEc.
MétodosSe trata de un estudio unicéntrico que incluyó a un total de 133 pacientes con ICFEc (NYHA II-III) tras la realización de una prueba de esfuerzo cardiopulmonar máxima. La respuesta de la FC al ejercicio se evaluó mediante la fórmula del índice cronotrópico (IxC). Para el análisis se utilizó un método de regresión binomial negativa.
ResultadosLa edad media fue de 73,2±10,5 años, el 56,4% eran mujeres y el 51,1% estaban en fibrilación auricular. La mediana de IxC fue de 0,4 (0,3-0,55). Tras una mediana de seguimiento de 2,4 (1,6-5,3) años, se registraron un total de 146 DIC en 58 pacientes y 41 (30,8%) muertes. El IxC no se asoció con eventos adversos (muerte, p=0,319, y DIC, p=0,573) cuando se analizó de forma conjunta toda la muestra. Sin embargo, se encontró un efecto diferencial en función del ritmo electrocardiográfico para DIC (p para interacción=0,002). El IxC se asoció inversa y linealmente con el riesgo de DIC en aquellos pacientes con ritmo sinusal y de forma lineal y positiva con aquellos en fibrilación auricular.
ConclusionesEn pacientes con ICFEc, el IxC se asoció diferencialmente con el riesgo de DIC en función del ritmo electrocardiográfico. Un Ixc más bajo surgió como un factor de riesgo para predecir un mayor riesgo de DIC en pacientes en ritmo sinusal. Por el contrario, un IxC más alto identificó un mayor riesgo en aquellos pacientes en fibrilación auricular.
Palabras clave
La incompetencia cronotrópica (ICron), definida como una disminución de la respuesta de frecuencia cardíaca (FC) al ejercicio, se asocia a una peor capacidad funcional y peor calidad de vida en los pacientes con insuficiencia cardiaca (IC) con fracción de eyección conservada (ICFEc)1,2. De igual modo, un FC en reposo creciente se ha relacionado con una menor capacidad funcional y constituye un factor desencadenante de las descompensaciones bien conocido3.
Varios estudios han revelado que la presencia de ICron en la IC con fracción de eyección reducida (ICFEr) se asocia a un aumento de la mortalidad por cualquier causa y de las hospitalizaciones por cualquier causa4–7. Sin embargo, la evidencia que respalda el papel de la respuesta cronotrópica es más escasa en la ICFEc. En consecuencia, el objetivo de este estudio fue evaluar la asociación entre la respuesta cronotrópica en pacientes con ICFEc sintomáticos estables y la descompensación por insuficiencia cardiaca (DIC) y si esta asociación se ve modificada o no por la presencia de fibrilación auricular (FA).
MÉTODOSDiseño del estudioEn este estudio se incluyó prospectivamente a 133 pacientes ambulatorios consecutivos con ICFEc y una clase funcional II-III de la NYHA estable (figura 1). El estudio se realizó en un único centro de nivel terciario de España. Todos los pacientes dieron su consentimiento informado y el protocolo fue aprobado por el comité de ética de investigación siguiendo los principios de la Declaración de Helsinki y la reglamentación nacional.
Los pacientes candidatos para el estudio se seleccionaron de entre los visitados en la unidad ambulatoria especializada de IC. Todos los pacientes cumplían los siguientes criterios de inclusión: a) antecedentes previos de IC sintomática (clase funcional ≥ II de la New York Heart Association); b) fracción de eyección ventricular izquierda normal (fracción de eyección> 0,50 con el método de Simpson y diámetro telediastólico <60mm); c) cardiopatía estructural (hipertrofia ventricular izquierda/agrandamiento auricular izquierdo) y/o disfunción diastólica estimada mediante ecocardiografía bidimensional; y d) estabilidad clínica, sin ingresos hospitalarios en los 3 meses previos. Se excluyó a los pacientes que no podían realizar una prueba de esfuerzo válida en la situación inicial, a los que tenían miocardiopatías genéticas o restrictivas o una sospecha elevada de miocardiopatía hipertrófica o amiloide y a los que tenían cualquier trastorno médico previo, como angina inestable, infarto de miocardio o cirugía cardíaca en los 3 meses previos; enfermedad crónica metabólica, traumatológica/ortopédica o pulmonar (incluida la hipertensión arterial pulmonar, la enfermedad pulmonar tromboembólica crónica o la enfermedad pulmonar obstructiva crónica moderada o grave); IC aguda descompensada; o cualquier otra comorbilidad con una esperanza de vida inferior a 1 año.
ProcedimientosSe practicó a los pacientes una prueba de esfuerzo cardiopulmonar (PECP) máxima limitada por los síntomas, una ecocardiografía, así como la determinación de la clase de la NYHA percibida por el médico, una exploración clínica y análisis de laboratorio.
Prueba de esfuerzo cardiopulmonarSe realizó una monitorización de los pacientes con un electrocardiograma de 12 derivaciones y determinaciones de la presión arterial en la situación inicial y cada 2minutos durante el ejercicio. Se clasificó a los pacientes según estuvieran en ritmo sinusal (RS) o presentaran una FA en el momento de la PECP.
Se evaluó la capacidad funcional máxima utilizando la prueba de esfuerzo cardiopulmonar incremental y limitada por los síntomas, en un ergómetro de bicicleta, empezando con una carga de trabajo de 10W y aumentándola gradualmente en un protocolo de progresión con incrementos de 10W cada 1minuto. Definimos la capacidad funcional máxima en el momento en el que el paciente dejaba de pedalear a causa de síntomas y el cociente de intercambio respiratorio (CIR) era ≥ 1,05. Los datos de intercambio de gases y las variables cardiopulmonares corresponden a promedios de valores obtenidos cada 10segundos. El consumo máximo de oxígeno (VO2 máx) fue el valor máximo del promedio de consumo de oxígeno (VO2) en 30 segundos. Una vez obtenido el VO2 máx, calculamos su porcentaje respecto al VO2 máx predicho (%VO2 máx-p), que se definió como el porcentaje del VO2 máx predicho, ajustado respecto al sexo, la edad, el protocolo de ejercicio, el peso y la altura, según la ecuación de predicción estándar de Wasserman/Hansen.
La eficiencia ventilatoria se determinó midiendo la pendiente de la relación lineal entre la ventilación-minuto (VE) y la producción de dióxido de carbono (VCO2) en toda la duración del ejercicio (pendiente VE/VCO2) y se consideró normal si la pendiente VE/VCO2 era <30.
La respuesta de FC durante la PECP máxima se evaluó mediante la fórmula del índice cronotrópico (IxC)=FC máxima-FC en reposo/[(220-edad)-FC en reposo)].
EcocardiografíaSe realizaron exploraciones de ecocardiografía Doppler en condiciones de reposo utilizando ecocardiografía bidimensional. Todos los parámetros, incluidos los parámetros de Doppler tisular, se determinaron según los criterios de la European Society of Echocardiography8.
BiomarcadoresSe obtuvo una muestra de sangre en condiciones estandarizadas para determinar el perfil de biomarcadores. Se efectuaron determinaciones del propéptido natriurético aminoterminal tipo B (NT-proBNP), el antígeno carbohidrato 125 (CA125), la filtración glomerular estimada, los electrolitos y la hemoglobina el mismo día que la PECP.
ObjetivosSe tomó como objetivo de interés el número total de eventos de DIC. Además, se evaluó también la mortalidad por cualquier causa. Los eventos de DIC incluyeron las hospitalizaciones, las visitas en servicios de urgencias y las visitas ambulatorias no programadas. La definición de la DIC requería un agravamiento de los signos y síntomas de la enfermedad y la administración de diuréticos parenterales. La información sobre los eventos de DIC y sobre la supervivencia se obtuvo de las historias clínicas de los pacientes en la unidad de IC, las salas hospitalarias, el servicio de urgencias y los registros de las historias clínicas electrónicas. Los objetivos los evaluaron investigadores a los que se ocultaron las características de los pacientes en la situación inicial, incluidos los parámetros de PECP. Todos los pacientes incluidos fueron objeto de un seguimiento hasta noviembre del 2021. La duración mínima del seguimiento de los pacientes fue de 8,5 meses.
Análisis estadísticoLas variables continuas y las cualitativas se presentan en forma de media±desviación estándar, mediana [rango intercuartílico (RIC)] o porcentajes. Se utilizó una regresión binomial negativa bivariante para evaluar la asociación independiente entre el IxC como variable continua y los criterios pronósticos (eventos de DIC y mortalidad por cualquier causa). Para los criterios de valoración clínicos, la regresión binomial negativa bivariante evaluó la interacción entre el IxC y el ritmo electrocardiográfico (RS frente a FA). Los valores obtenidos se presentan en forma de razón de tasas de incidencia (RTI). Todas las variables mencionadas en la tabla 1 se evaluaron con fines pronósticos. La selección de las covariables para los modelos multivariantes finales se basó en la plausibilidad biológica y no solo en el valor de p. El supuesto de linealidad para las variables continuas se evaluó y transformó simultáneamente, si procedía, con el empleo de polinomios fraccionales. Además de nuestras variables de exposición (IxC y la interacción FA*IxC), las covariables incluidas en los modelos finales para los eventos de DIC fueron las siguientes: clase funcional de la NYHA en la situación inicial, exfumador, filtración glomerular estimada, propéptido natriurético cerebral aminoterminal, fracción de eyección ventricular izquierda, volumen telesistólico ventricular izquierdo, volumen telediastólico ventricular izquierdo, índice de masa ventricular izquierda, volumen auricular izquierdo, tratamiento con bloqueadores beta y tratamiento con furosemida. Se consideró estadísticamente significativo un valor de p bilateral <0,05. Todos los análisis se realizaron con el programa Stata 15.1.
Características iniciales de la población estratificada según el estado del ritmo
| Total(n=133) | RS(n=65) | FA(n=68) | p | |
|---|---|---|---|---|
| Variables demográficas y clínicas | ||||
| Edad, años | 73,2±10,5 | 73,7±8,6 | 72,7±12 | 0,577 |
| Mujeres | 75 (56,4) | 37 (56,9) | 38 (55,9) | 0,904 |
| IMC, kg/m2 | 31,1 [28-34,3] | 31,2 [28-34,2] | 31 [27,7-34,8] | 0,932 |
| NYHA III/IV | 45 (33,8) | 17 (26,2) | 28 (41,2) | 0,067 |
| Hipertensión | 120 (90,2) | 59 (90,7) | 61 (89,7) | 0,836 |
| Exfumadores | 41 (30,8) | 20 (30,8) | 21 (30,9) | 0,989 |
| Dislipemia | 102 (76,7) | 53 (81,5) | 49 (72,1) | 0,162 |
| CPI | 41 (30,8) | 28 (43,1) | 13 (19,1) | 0,003 |
| EPOC | 13 (9,8) | 9 (13,9) | 4 (5,9) | 0,122 |
| Diabetes | 59 (44,4) | 29 (44,6) | 30 (44,1) | 0,954 |
| Antecedentes de ictus | 9 (6,8) | 1 (1,5) | 8 (11,8) | 0,019 |
| Fumadores | 6 (4,5) | 4 (6,1) | 2 (3,0) | 0,372 |
| Parámetros ecocardiográficos | ||||
| FEVI | 66 [60-74] | 65,8 [59,7-74] | 67 [60-73] | 0,105 |
| ESAT, mm | 22 [19,4-25] | 22 [20-25,4] | 21,6 [19-24] | 0,091 |
| PAPs, mmHg | 39,5 [30-49,5] | 36 [25-43] | 44 [34-53] | 0,001 |
| Cociente E/e’ | 13 [10,2-16,3] | 12,3 [9,7-14,2] | 13,2 [10,5-18,4] | 0,036 |
| VTDVI, ml | 83 [65,8-108] | 83 [72-111] | 82,5 [63,5-102] | 0,317 |
| VTSVI, ml | 29 [19,2-35,4] | 29 [21,7-35,4] | 29 [19-35] | 0,677 |
| Volumen auricular izquierdo, ml | 80 [70-90,2] | 76 [61-80] | 80 [80-100] | <0,001 |
| Grosor del TIV, mm | 12,5 [11,2-13,5] | 12,9 [12-13,5] | 12,5 [11-13,5] | 0,209 |
| Índice de masa del VI, g/m2 | 114,5 [96,8-143,9] | 113,7 [98-139,8] | 116 [96,7-146,9] | 0,223 |
| Parámetro de PECR | ||||
| FC en reposo, lpm | 67 [59-74] | 66 [60-73] | 68 [59-75] | 0,345 |
| FC al ejercicio máximo, lpm | 99 [85-112] | 96 [85-110] | 101 [86-112] | 0,565 |
| VO2 máx., ml/kg/min | 11 [9-13] | 10,3 [8.8-12] | 11,6 [9-13] | 0,109 |
| VO2 máx-p | 64,1 [53-74,4] | 67,8 [54,8-79,7] | 61,7 [50-70,8] | 0,084 |
| Pendiente VE/VCO2 | 34,7 [31-38,9] | 34,7 [29,3-38,8] | 34,7 [31,7-39,3] | 0,477 |
| PAS en el ejercicio máximo, mmHg | 149 [140-160] | 152 [140-162] | 142 [138-150] | 0,001 |
| Índice cronotrópico | 0,4 [0,3-0,55] | 0,4 [0,26-0,55] | 0,4 [0,29-0,54] | 0,749 |
| Parámetros analíticos | ||||
| Hemoglobina, mg/dl | 13,0 [11,7-14,1] | 13,2 [12,1-14,1] | 12,8 [11,6-13,8] | 0,362 |
| NT-proBNP, pg/ml | 556 [288-1399] | 325 [212-638] | 1095 [513- 2233] | <0,001 |
| CA125, U/ml | 12 [8-19] | 10 [1-16] | 14 [10-23] | 0,001 |
| Sodio, mEq/l | 141 [139-142] | 141 [139-143] | 141 [139-142] | 0,465 |
| FGe, ml/min/1,73 m2 | 58,4 [43,6-74,2] | 60,6 [43,8-74,2] | 57,9 [43,5-74,7] | 0,007 |
| Tratamiento médico | ||||
| ARA | 66 (49,6) | 37 (56,9) | 29 (42,7) | 0,099 |
| IECA | 26 (19,5) | 12 (18,5) | 14 (20,6) | 0,757 |
| ARM | 29 (21,8) | 7 (10,8) | 22 (32,4) | 0,002 |
| Bloqueadores beta | 118 (88,7) | 58 (89,2) | 60 (88,2) | 0,856 |
| Digoxina | 6 (4,5) | 3 (4,5) | 3 (4,5) | 1,000 |
| Furosemida | 73 (54,9) | 27 (41,5) | 46 (67,7) | 0,002 |
| Otros diuréticos | 52 (39,1) | 30 (46,2) | 22 (32,4) | 0,103 |
Los datos se expresan en forma de número (%), las variables continuas en forma de media±1 desviación estándar o de mediana (rango intercuartílico [RIC]) y las discretas en forma de frecuencia y porcentaje.
IECA, inhibidor de la enzima de conversión de la angiotensina; FA, fibrilación auricular; ARA, antagonista de receptores de angiotensina; IMC, índice de masa corporal; CA125, antígeno carbohidrato 125; EPOC, enfermedad pulmonar obstructiva crónica; E/e’, cociente entre la velocidad de flujo de entrada mitral temprano y la velocidad diastólica temprana anular mitral; FGe, filtración glomerular estimada; CPI, cardiopatía isquémica; grosor del TIV, grosor del tabique interventricular; VI, ventrículo izquierdo; VTDVI, volumen telediastólico ventricular izquierdo; FEVI, fracción de eyección ventricular izquierda; VTSVI, volumen telesistólico ventricular izquierdo; ARM, antagonista de receptores de mineralcorticoides; NT-proBNP, amino-terminal propéptido natriurético tipo B; NYHA, New York Heart Association; PAPS, presión arterial pulmonar sistólica; PAS, presión arterial sistólica; RS, ritmo sinusal; ESAT, extrusión sistólica del anillo tricúspide; pendiente VE/VCO2, eficiencia ventilatoria.
La media de edad de la muestra fue de 73,2±10,5 años, con un 56,4% de mujeres, el 33,8% de pacientes en la clase III de la NYHA, la mayoría de los pacientes con antecedentes de hipertensión y 68 (51,1%) tenían una FA. La mayoría de los pacientes habían estado ingresados anteriormente en el hospital por una IC aguda (92%) y estaban en tratamiento con bloqueadores beta (88,7%). Por lo que respecta a los parámetros de la PECP, la mediana [p25-p75] de IxC, VO2 máx, %VO2 máx-p y VE/VCO2 fue de 0,4 [0,3-0,55], 11 [9-13] ml/kg/min, 64,1 [53-74,4]% y 34,7 [31-38,9], respectivamente.
Características iniciales estratificadas según el ritmo electrocardiográficoEn la tabla 1 se resumen las características iniciales estratificadas según el ritmo electrocardiográfico. En términos generales, los pacientes con FA presentaban una mayor prevalencia de ictus y datos indicativos de una enfermedad más avanzada (mayor presión arterial pulmonar sistólica, mayor volumen auricular izquierdo, menor presión arterial sistólica en el ejercicio máximo, mayores concentraciones de NT-proBNP y menor filtración glomerular estimada), tal como se muestra en la tabla 1. De igual modo, los pacientes con FA estaban en tratamiento con más frecuencia con antagonistas de receptores de mineralcorticoides y con furosemida. Sin embargo, no hubo diferencias en la clase funcional de la NYHA en la situación inicial, el VO2 máx, la FC en reposo o el IxC entre los distintos tipos de ritmo (RS frente a FA).
Índice cronotrópico y eventos clínicos adversosTras una mediana [RIC] de seguimiento de 2,4 [1,6-5,3] años, hubo un total de 41 (30,8%) muertes por cualquier causa y 146 eventos de DIC (62 hospitalizaciones y 84 episodios ambulatorios) en 58 pacientes. Las tasas (por 10 años-persona) de muerte y de eventos de DIC no mostraron diferencias entre los pacientes situados por encima y por debajo de la mediana de IxC (< 0,4 frente a ≥ 0,4): 1,03 frente a 0,75 (p=0,535) y 4,44 frente a 3,58 (p=0,544), respectivamente. En el análisis multivariable, el IxC no se asoció a los eventos de DIC (p=0,573) ni a la mortalidad por cualquier causa (p=0,319), como se muestra en la figura 2. En el mismo escenario multivariante, en el examen dicotomizado según la mediana (< 0,4 frente a ≥ 0,4), el IxC continuó sin mostrar una asociación independiente con los eventos de DIC (RTI, 0,55; IC95%, 0,23-1,32; p=0,182) o con la mortalidad (RTI, 0,87; IC95%, 0,50-1,56; p=0,657).
Efecto pronóstico diferencial del índice cronotrópico en función del ritmo electrocardiográficoLos pacientes con un IxC inferior a la mediana (< 0,4) mostraron diferencias no significativas en las tasas de mortalidad en los pacientes en RS (0,98 frente a 0,45, p=0,128) o con FA (1,13 frente a 1,28, p=0,569). Sin embargo, el IxC <0,4 identificó unas tasas superiores de eventos de DIC en los pacientes con RS (4,93 frente a 1,34, p=0,003). En cambio, en los pacientes con FA, el IxC <0,4 mostró una tendencia estadística a tener unas tasas inferiores de eventos de DIC (2,66 frente a 7,35, p=0,068).
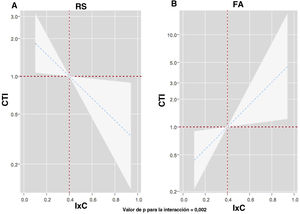
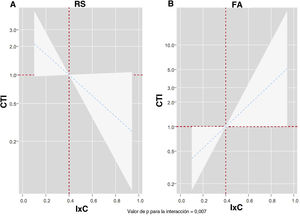
Después de un ajuste multivariante, confirmamos un efecto pronóstico diferencial del IxC entre los distintos ritmos electrocardiográficos en cuanto a la predicción de los eventos de DIC (p para la interacción=0,002). Tal como se muestra en la figura 3, el IxC mostró una asociación inversa y lineal con el riesgo de eventos de DIC en los pacientes en ritmo sinusal (figura 3A). Sin embargo, el IxC presentó una relación positiva y lineal con el riesgo de eventos de DIC en los pacientes en FA (figura 3B). Se obtuvieron resultados similares al analizar el efecto pronóstico diferencial del IxC tan solo para las hospitalizaciones por IC (p para la interacción=0,007). Un valor inferior del IxC se asociaba a un mayor riesgo en los pacientes en RS (figura 4A)figura 4, pero observamos lo contrario en los pacientes en FA (figura 4B).
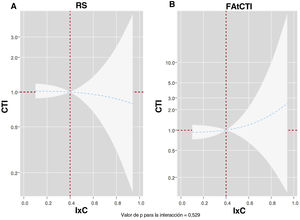
Para la mortalidad por cualquier causa, la interacción ajustada entre el IxC y el ritmo electrocardiográfico no fue significativa (p para la interacción=0,529). El IxC a lo largo del espectro continuo de valores no se asoció al riesgo de muerte en los pacientes en RS ni en los que presentaban una FA (figura 5).
DISCUSIÓNEn pacientes ambulatorios con una ICFEc sintomática y estable, observamos que la respuesta cronotrópica al ejercicio, evaluada mediante el IxC mostraba una asociación diferente con el riesgo de eventos de DIC según cuál fuera el ritmo electrocardiográfico del paciente. En un modelo de regresión multivariante en el que se incluyó el IxC como variable continua, una respuesta de FC amortiguada se asoció a un mayor riesgo de eventos totales de DIC en el seguimiento a largo plazo en los pacientes con RS. En cambio, una respuesta de FC superior aumentaba el riesgo de eventos de DIC en los pacientes con FA. Sin embargo, el IxC no mostró una asociación con la mortalidad por cualquier causa.
Respuesta cronotrópica en la insuficiencia cardiacaUna respuesta de FC al ejercicio apropiada es crucial para el aumento del gasto cardiaco con el ejercicio máximo en los individuos normales9 y en los pacientes con IC10. La ICron es una observación frecuente en los pacientes con IC1,6,11,12. En la ICFEr, la ICron da lugar a una intolerancia al ejercicio, deteriora la calidad de vida y se asocia a la aparición de eventos adversos4–6. De igual modo, el aumento de la FC en la ICFEr se asocia también a los eventos adversos13 y constituye una diana terapéutica bien conocida14.
Por lo que respecta a la ICFEc, continúa sin estar clara cuál es la respuesta óptima de la FC en reposo y en ejercicio. Estudios recientes han revelado que la amortiguación de la respuesta cronotrópica es una observación frecuente que se asocia a una capacidad funcional limitada1,12. A pesar de que los mecanismos fisiopatológicos que subyacen en la ICron en la ICFEc no están claros, se han propuesto varios posibles mecanismos en los pacientes en RS: disfunción del músculo periférico, desequilibrio del sistema nervioso autónomo, remodelado del nódulo sinusal que causa una reducción de la reserva del nódulo sinusal y un deterioro de la respuesta de los receptores beta cardiacos7,11,15. De igual modo, en especial en los pacientes con FA, el aumento de la frecuencia ventricular es un factor desencadenante frecuente de las descompensaciones de la IC y constituye una diana terapéutica14.
Respuesta cronotrópica según el ritmo y pronósticoEs bien sabido que la aparición de la FA en los pacientes con IC se asocia a un peor pronóstico16 y a una mala capacidad funcional10,17. Sin embargo, en la ICFEr, estudios previos han mostrado que la respuesta de la FC al ejercicio en la ICFEr muestra patrones diferentes en los pacientes en RS o con FA10,17. Por ejemplo, en una cohorte de 942 pacientes con ICFEr, Agostoni et al.17 indicaron que los pacientes con FA mostraron unos valores inferiores de VO2 máx y de pulso de O2 pero con valores de FC superiores en el ejercicio máximo, en comparación con los participantes que estaban en RS. Esta observación sugirió que el volumen de eyección puede ser menor en el ejercicio máximo y que una respuesta de FC mayor actuaba como mecanismo compensatorio para aumentar el volumen de eyección en los pacientes con FA17. Así pues, un aumento de la respuesta de FC podría traducirse en una potenciación de la estimulación simpática desencadenada para mantener el gasto cardiaco10.
En la ICFEc, algunos estudios han mostrado que los pacientes con FA presentaron unos valores inferiores de VO2 máx y de pulso de O2 pero sin diferencias en la FC máxima en comparación con los pacientes en RS18,19. Elshazly et al.19 evaluaron las diferencias en la PECP según el ritmo en 1744 pacientes jóvenes con ICFEc (239 pacientes—13,7%—con FA) de una media de edad de 51,2±15,4 años. Estos autores observaron que los pacientes con FA tenían valores inferiores de VO2 máx, pulso de O2 y presión arterial sistólica en el ejercicio máximo, un mayor riesgo de mortalidad total a largo plazo y no presentaban diferencias en la FC máxima en comparación con los pacientes en RS19. De igual modo, el presente estudio no observó diferencias en el IxC entre los pacientes en RS y los pacientes con FA. Sin embargo, los resultados presentados sugieren que el tipo de ritmo influye de manera importante en la asociación entre la respuesta cronotrópica al ejercicio y los eventos de DIC. En función de cuál sea el ritmo, una respuesta cronotrópica exagerada podría permitir identificar a los pacientes con ICFEc y un riesgo más elevado de DIC. De hecho, una respuesta ventricular rápida es un factor desencadenante frecuente de la descompensación de la IC en los pacientes con FA20.
En cambio, una respuesta amortiguada podría permitir seleccionar a los pacientes en RS con un riesgo superior en los que la ICron podría desempeñar un papel causal crucial para determinar la incapacidad de aumentar el gasto cardiaco durante el ejercicio. Los resultados del presente estudio son un ejemplo más de la fisiopatología compleja y heterogénea de la ICFEc. Esto resalta el papel diferente de la respuesta de la FC durante el ejercicio según el tipo de ritmo electrocardiográfico.
Consecuencias clínicas y líneas futuras de investigaciónPartiendo de la premisa de que nuestros resultados requieren una validación en futuros ensayos, proponemos que la retirada o la reducción del tratamiento de reducción de la FC, o incluso el aumento de la FC, en los pacientes con ICFEc que tienen una ICron documentada puede ser una estrategia terapéutica para reducir el riesgo de eventos de DIC y mejorar la capacidad funcional, en especial en los pacientes en RS. En este mismo sentido, un pequeño ensayo clínico aleatorizado reciente, en el que se incluyó a 52 pacientes con una ICFEc estable (un 80,8% de ellos en RS), el tratamiento previo con bloqueadores beta (en dosis estables durante al menos 3 meses antes de la inclusión) y con una ICron documentada (ICron <0,62) mostró que el VO2 máx a corto plazo y el porcentaje del valor predicho de VO2 máx aumentaron en +2,1±1,29ml/kg/min (p <0,001) y + 11,74±2,32% (p <0,001) tras la retirada de los bloqueadores beta. Tiene interés señalar que el análisis de mediación indicó que el principal factor contribuyente en la mejora de la capacidad funcional máxima fue la magnitud del cambio de la respuesta de FC2. En cambio, un control estricto de la FC con el empleo de tratamientos de reducción de la FC en los pacientes con FA y una respuesta exagerada de la FC al ejercicio puede ser una estrategia útil para prevenir nuevos episodios de DIC20–23.
Dado el elevado número de incertidumbres respecto al diagnóstico y el tratamiento de la ICFEc, los futuros estudios en este campo debieran tener como objetivo proporcionar: a) un mejor conocimiento de la fisiopatología de la respuesta cronotrópica tanto en los pacientes en RS como en los pacientes con FA; b) una determinación más precisa del fenotipo de la ICFEc respecto a la respuesta de la FC, con una evaluación del rango óptimo de valores de FC en los pacientes con ICFEc y de si ello es modificado por la FA o el RS; y c) una definición de la utilidad clínica de los bloqueadore beta u otros tratamientos de reducción de la FC según el fenotipo de la ICFEc24–26, el tipo de ritmo electrocardiográfico y la respuesta de la FC.
Por último, este estudio resalta el papel de las pruebas de esfuerzo en la evaluación de los pacientes con ICFEc. La PECP es una herramienta clínica útil para identificar diferentes fenotipos de respuesta de la FC al ejercicio en la ICFEc.
Limitaciones del estudioReconocemos que las principales limitaciones de este estudio son el pequeño tamaño de la muestra y el hecho de que se trate de un estudio observacional de un solo centro. En segundo lugar, se trata de una población seleccionada con unas tasas altas de prescripción de bloqueadores beta. En tercer lugar, los resultados actuales son válidos únicamente para los pacientes sintomáticos con una ICFEc estable. No pueden extrapolarse a otras situaciones clínicas, subgrupos de prevalencia ni formas más leves del síndrome. En cuarto lugar, no registramos los cambios longitudinales en el tipo de ritmo electrocardiográfico ni en el tratamiento médico durante el seguimiento. Por último, el bajo poder estadístico podría explicar algunos de los resultados neutros obtenidos.
CONCLUSIONESEn los pacientes con una ICFEc clínicamente estable, el IxC mostró una asociación diferente con el riesgo de eventos de DIC en función cuál fuera el ritmo electrocardiográfico. Además, la ICron surgió como factor de riesgo predictor de los eventos de DIC en los pacientes en RS. En cambio, una respuesta exagerada de la FC al ejercicio identificó a un subgrupo de pacientes con un mayor riesgo de eventos de DIC en los que tenían una ICFEc y FA. Serán necesarios nuevos estudios para confirmar estos resultados, determinar los mecanismos fisiopatológicos subyacentes en ellos y definir el tratamiento adecuado.
FINANCIACIÓNEste trabajo fue financiado por subvenciones del Ministerio de Economía y Competitividad de España a través del Instituto de Salud Carlos III: FIS (PI17/01426), Unidad de Investigación Clínica y Ensayos Clínicos del Instituto de Investigación Sanitaria INCLIVA, Spanish Clinical Research Network (SCReN; PT13/0002/0031 y PT17/0017/0003), cofinanciada por el Fondo Europeo de Desarrollo Regional, el Instituto de Salud Carlos III y fondos cardiovasculares de CIBER (16/11/00420 y 16/11/00403).
CONTRIBUCIÓN DE LOS AUTORESP. Palau y E. Domínguez contribuyeron por igual. Diseño del estudio y creación de la base de datos: P. Palau, E. Domínguez y J. Núñez. Selección de los pacientes e inclusión de las variables en la base de datos: P. Palau, E. Domínguez, J. Núñez, J. Seller, C. Sastre, L. López, P. Llàcer, G. Miñana y R.l de la Espriella. Evaluación de los resultados: P. Palau, J. Núñez, A. Bayés-Genís, J. Sanchis y V. Bodí. Revisión crítica del manuscrito: P. Palau, E. Domínguez, J. Núñez, J. Seller, C. Sastre, L. López, P. Llàcer, G. Miñana, R. de la Espriella A. Bayés-Genís, J. Sanchis y V.T Bodí.
CONFLICTO DE INTERESESJ. Sanchis es editor jefe de Rev Esp Cardiol. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. Los demás autores declaran no tener conflictos de intereses relativos a investigación, autoría o publicación de este artículo.
- •
La incompetencia cronotrópica se asocia a la capacidad funcional y la calidad de vida en la insuficiencia cardiaca con ICFEc.
- •
La evidencia previa ha puesto de manifiesto que la incompetencia cronotrópica en la insuficiencia cardiaca con fracción de eyección reducida se asocia a un aumento de la mortalidad por cualquier causa y de las hospitalizaciones por cualquier causa.
- •
Sin embargo, es poco lo que se sabe acerca de la utilidad de la respuesta de la frecuencia cardiaca al ejercicio para la estratificación del riesgo en la insuficiencia cardiaca con ICFEc.
- •
La respuesta de la frecuencia cardiaca al ejercicio mostró una asociación diferente con el riesgo de eventos de IC en función del cuál fuera el ritmo electrocardiográfico.
- •
La incompetencia cronotrópica aumentó el riesgo de eventos de insuficiencia cardiaca en los pacientes en ritmo sinusal.
- •
Una mayor respuesta de la frecuencia cardíaca aumentó el riesgo de eventos de insuficiencia cardiaca en los pacientes con fibrilación auricular.