La angiogénesis participa en la restauración de la microcirculación después de un infarto agudo de miocardio (IAM). El objetivo de este estudio es explorar el papel que juega la isoforma anti-angiogénica del factor de crecimiento endotelial vascular (VEGF)-A165b y explorar su potencial como terapia coadyuvante a la reperfusión coronaria.
MétodosSe realizaron dos modelos murinos de IAM: a) ligadura permanente de la arteria coronaria (IAM no reperfundido) y b) oclusión transitoria durante 45 minutos de la arteria coronaria seguida de reperfusión (IAM reperfundido); en ambos modelos, se realizó a los animales una ecocardiografía previa a la eutanasia el día 21 pos-IAM. Se determinaron los niveles séricos y miocárdicos de VEGF- A165b. En ambos modelos experimentales se evaluó la implicación funcional y estructural del bloqueo de esta isoforma. En una cohorte de 104 pacientes con IAM con elevación del segmento ST se cuantificaron los niveles circulantes de VEGF-A165b y se estudió su asociación con la fracción de eyección del ventrículo izquierdo determinada mediante resonancia magnética cardiaca a los 6 meses del IAM, así como con la aparición de eventos adversos (muerte, insuficiencia cardiaca o reinfarto) durante el seguimiento.
ResultadosEn ambos modelos, los niveles séricos y tisulares de VEGF-A165b habían aumentado a los 21 días de la inducción del IAM. Además, existía una correlación negativa entre los valores circulantes de VEGF-A165b y la función sistólica evaluada mediante ecocardiografía. El bloqueo in vivo de VEGF-A165b se relacionó con una mayor densidad microvascular, menor tamaño de infarto y mejor fracción de eyección en el modelo de IAM reperfundido, pero no en el modelo de IAM no reperfundido. En la cohorte de pacientes, aquellos con unos niveles séricos elevados de VEGF-A165b presentaron una fracción de eyección deprimida y una mayor tasa de eventos adversos.
ConclusionesEn estudios experimentales y clínicos, valores séricos elevados de VEGF-A165b se asocian con una peor función sistólica. Su bloqueo incrementa la neoangiogénesis, reduce el tamaño del infarto y aumenta la fracción de eyección en el modelo de IAM reperfundido, pero no en el de sin reperfundido. En consecuencia, la neutralización de VEGF-A165b representa una potencial opción terapéutica como coadyuvante a la reperfusión coronaria.
Palabras clave
A pesar de la reperfusión completa del epicardio tras un infarto agudo de miocardio (IAM), el deterioro de la perfusión miocárdica puede persistir en más del 50% de los pacientes. Este fenómeno se conoce como obstrucción microvascular y tiene efectos perjudiciales en la estructura y el pronóstico1,2. Para minimizar la afección microvascular, es importante evaluar nuevos tratamientos complementarios a la reperfusión temprana.
La angiogénesis participa en el proceso de reparación tras un IAM restableciendo la circulación microvascular y proporcionando oxígeno y nutrientes al tejido cardiaco3. En el contexto de un IAM, la concentración del factor de crecimiento endotelial vascular proangiogénico (VEGF)-A aumenta rápidamente en el plasma y el miocardio infartado después de inducir el IAM4. El VEGF-A puede diferenciarse por splicing y generar la isoforma antiangiogénica5 VEGF-A165b. En una cohorte de 50 pacientes con IAM con elevación del segmento ST (IAMCEST), se observó que la concentración sérica del VEGF-A165b aumentaba tras el IAM y se relacionaba con alteración de la estructura cardiaca determinada por la resonancia magnética cardiovascular (RMC), realizada la primera semana después del IAM6. No obstante, hasta la fecha siguen sin conocerse los efectos de la actividad del VEGF-A165b en modelos experimentales de IAM y los posibles efectos de bloquearlo.
Para obtener más información sobre el papel del VEGF-A165b tras un IAM y explorar su potencial como tratamiento complementario a la reperfusión coronaria temprana, los objetivos concretos del presente estudio son los siguientes. En 2 modelos murinos experimentales de IAM (IAM reperfundido y IAM no reperfundido): a) determinar la función del VEGF-A165b en el suero y el miocardio infartado; b) investigar in vivo los posibles efectos de la neutralización del VEGF-A165b en la densidad de los capilares, el tamaño del infarto y la función sistólica; y en una cohorte prospectiva de 104 pacientes con IAMCEST: c) evaluar la concentración del VEGF-A165b circulante, su relación con la estructura cardiaca resultante, evaluada a los 6 meses mediante RMC, y la aparición de eventos adversos cardiacos mayores (MACE) durante el seguimiento.
MÉTODOSEstudios con animalesLos protocolos con los animales se realizaron siguiendo las guías de la Directiva 2010/63/EU del Parlamento Europeo y el comité de ética de la junta supervisora los aprobó (número de protocolo: 2016/VCS/PEA/00075).
Los ratones C57BL/6J procedían de los Charles River Laboratories (Châtillon-sur-Chalaronne, Francia). Los ratones (edad, 16±2 semanas) se criaron y mantuvieron en condiciones específicas libres de patógenos, a una temperatura constante de 22 ± 2°C, una humedad del 60-65% con un ciclo luz/oscuridad de 12 h y con acceso libre a la comida normal y al agua esterilizada en autoclave.
Modelo murino de IAMSe indujo IAM en ratones (n=60) por ligadura de la arteria coronaria descendente anterior izquierda, pero 8 de estos fallecieron antes. Los ratones se separaron en 2 modelos de IAM: a) IAM no reperfundido (ligadura coronaria permanente, sin reperfusión), y b) IAM reperfundido (oclusión transitoria de 45min de la arteria coronaria seguida de reperfusión). En el modelo de IAM no reperfundido, se apretó el nudo, con la consiguiente oclusión de la arteria coronaria. En el modelo de IAM reperfundido, se colocó un tubo de 23 G entre la arteria coronaria y la sutura de seda del 6-0, y después se eliminó para poder realizar la reperfusión completa tras el periodo de isquemia. El tubo se colocó a través del sexto espacio intercostal hacia la parte externa del animal. En ambos modelos, una vez confirmado el inicio de la isquemia, tanto a simple vista como mediante un electrocardiograma, se cerró el tórax del ratón. En el modelo de IAM reperfundido, se extrajo el tubo al cabo de 45min de la oclusión para realizar la reperfusión coronaria, que quedó confirmada en el electrocardiograma por la resolución de la elevación del segmento ST.
Además, se incluyó en el estudio un grupo con intervención simulada (n=13). A estos animales se les aplicó el mismo protocolo quirúrgico, excepto por la oclusión de la arteria coronaria.
Grupos experimentalesSe aleatorizó a los ratones a los siguientes grupos de tratamiento: a) grupo con intervención simulada; b) IAM no reperfundido con anticuerpo de isotipo anti-IgG; c) IAM no reperfundido con anticuerpo bloqueador del VEGF-A165b; d) IAM reperfundido con anticuerpo de isotipo anti-IgG, y e) IAM reperfundido con anticuerpo bloqueador del VEGF-A165b. Cada grupo experimental constaba de 13 animales, por lo que el grupo de estudio definitivo estaba formado por 65 ratones ().
Estudio en pacientes con IAMCESTEl estudio se ajustó a la Declaración de Helsinki en lo que respecta al uso de voluntarios humanos. El protocolo del estudio fue aprobado por el comité de ética local y se obtuvo el consentimiento informado de todos los participantes.
Los criterios de inclusión fueron: pacientes con un primer IAMCEST tratados con intervención coronaria primaria en las primeras 12 h tras el inicio del dolor torácico, de los que se obtuvo RMC a los 6 meses del IAMCEST. Se incluyó prospectivamente a 127 pacientes consecutivos con estas características dados de alta entre julio de 2013 y diciembre de 2017.
Los criterios de exclusión fueron: muerte (n=2), reinfarto (n=4), inestabilidad clínica (n=4) durante los primeros 6 meses después del alta y cualquier contraindicación para la RMC (n=13). Así pues, el grupo definitivo del estudio constaba de 104 pacientes con IAMCEST. El diagrama de flujo de los pacientes del estudio se presenta en la .
Se incluyó un grupo de control emparejado por edad y sexo con el grupo del estudio (), formado por 25 pacientes en quienes se descartó cualquier enfermedad cardiaca mediante anamnesis, exploración física y estudio ecocardiográfico exhaustivos realizados por un cardiólogo clínico.
Análisis estadísticoSe evaluó la normalidad de la distribución con la prueba de Kolmogorov-Smirnov. Los datos continuos con distribución normal se expresan como media±desviación estándar de la media y se compararon utilizando la prueba de la t de Student para datos no emparejados o el ANOVA unilateral. Los datos no paramétricos se expresan como mediana [intervalo intercuartílico] y se compararon utilizando la prueba de la U de Mann-Whitney. Los porcentajes de grupo se compararon utilizando la prueba de la χ2 o la prueba exacta de Fisher, según fuera oportuno. Se evaluaron las correlaciones lineales utilizando el coeficiente de correlación de Pearson. Puesto que no se validaron valores de corte previos para la concentración sérica del VEGF-A165b, se dividió a los pacientes en función del valor medio de la cohorte de estudio (405 pg/ml). La relación entre la concentración del VEGF-A165b (alta,> 405 pg/ml) y el tiempo transcurrido hasta el primer MACE se determinó mediante la curva de Kaplan-Meier y la prueba de rangos logarítmicos. Se calculó la concentración sérica del VEGF-A165b con su intervalo de confianza del 95% (IC95%) en pacientes con IAMCEST para cada grupo. Se consideró que había significación estadística con valores bilaterales de p <0,05. Todas las pruebas estadísticas se realizaron con SPSS 19.0 (SPSS, Inc., Estados Unidos).
Se especifican más detalles en el apartado .
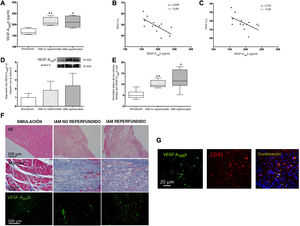
RESULTADOSLa concentración del VEGF-A165b circulante aumentó tras el IAM y se relacionó con alteración de la función sistólicaLa concentración del VEGF-A165b circulante aumentó considerablemente a los 21 días de la inducción del IAM en ambos grupos experimentales de IAM no reperfundido (212±10 pg/ml; p <0,01) e IAM reperfundido (213±12 pg/ml; p <0,05) comparados con la intervención simulada (167±7 pg/ml) (figura 1A). A continuación, se investigó la relación entre los parámetros derivados de la ecocardiografía y los valores del VEGF-A165b circulante previos al sacrificio. Se obtuvo una correlación inversa entre la concentración sérica del VEGF-A165b y la fracción de eyección del ventrículo izquierdo (FEVI) (figura 1B) y la fracción de acortamiento del ventrículo izquierdo (FAVE) (figura 1C).
Las concentraciones sérica y miocárdica del factor de crecimiento endotelial vascular (VEGF)-A165b se hallan aumentadas en los modelos experimentales de infarto agudo de miocardio (IAM). A: la concentración sérica del VEGF-A165b antes del sacrificio estaba elevada en ratones que se sufrían IAM comparados con la intervención simulada. La concentración del VEGF-A165b circulante se relacionó indirectamente con la fracción de eyección del ventrículo izquierdo (FEVI) (B) y la fracción de acortamiento del ventrículo izquierdo (FAVI) (C), evaluadas mediante ecocardiografía transtorácica. D: análisis de inmunotransferencia de la expresión de proteínas del VEGF-A165b en muestras miocárdicas infartadas y aisladas de ambos modelos de IAM, comparado con la intervención simulada. E: análisis de densitometría del análisis de inmunofluorescencia del VEGF-A165b. Se incubaron las secciones de miocardio con un anticuerpo antimurino del VEGF-A165b y se visualizó un etiquetado específico y equilibrado con Alexa Fluor 488 (VEGF-A165b, verde). Se captaron y digitalizaron las imágenes y a continuación se analizaron con el software de análisis de Image-Pro Plus. La puntuación se realizó a ciegas en dispositivos codificados. F: imágenes representativas de la hematoxilina-eosina (HE, fila superior), tricrómico de Masson (fila central) e inmunofluorescencia específica para el VEGF-A165b (fila inferior, verde). G: imágenes representativas que muestran la colocalización del CD31/VEGF-A165b en el tejido miocárdico infartado. La inmunorreactividad se visualizó con anticuerpos secundarios de Alexa Fluor 594 (CD31, rojo) y Alexa Fluor 488 (VEGF-A165b, verde). Los núcleos se tiñeron con DAPI (azul). La correlación entre el VEGF-A165b y las variables derivadas de la ecocardiografía (B y C) se evaluó con el coeficiente de correlación de Pearson. Los datos continuos de distribución normal (n=13 animales por grupo) expresan media±desviación estándar y se analizaron mediante análisis ANOVA unilateral seguido de la prueba de Bonferroni. *p <0,05. **p <0,01 frente a la intervención simulada en A y E. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Se detectó una tendencia hacia una mayor expresión del VEGF-A165b en muestras de miocardio obtenidas a partir del área infartada de ambos grupos de IAM, comparadas con la intervención simulada (figura 1D). Los estudios de inmunofluorescencia revelaron que, aunque se observó una expresión constitutiva débil del VEGF-A165b en los controles, la presencia del VEGF-A165b era mayor en las áreas de infarto de ambos grupos de IAM (p <0,05) (figura 1D,E). Además, la inmunofluorescencia de doble marcado confirmó la expresión del VEGF-A165b en las células endoteliales (CD31+) (figura 1G).
En resumen, se aumentó la presencia del VEGF-A165b circulante y miocárdico en los 2 modelos experimentales de IAM (reperfundido y no reperfundido) y mediante ecocardiografía se asoció con una función sistólica más deprimida.
El bloqueo de la actividad del VEGF-A165b mejoró la angiogénesis, la función sistólica y el tamaño del infarto en ratones con IAM reperfundido, pero no con IAM no reperfundidoPara explorar las consecuencias del bloqueo in vivo del VEGF-A165b, se incluyó un grupo experimental para cada modelo de IAM en el cual se trataba a los animales con una inyección intraperitoneal de un anticuerpo bloqueador específico anti-VEGF-A165b o con un isotipo emparejado anti-IgG.
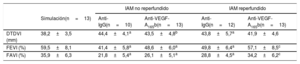
Efectos en la función sistólica y el tamaño del infartoComparados con la intervención simulada, los animales de los grupos de IAM reperfundido y IAM no reperfundido tratados con anticuerpo de isotipo anti-IgG mostraron peor función sistólica, tal como reflejan el aumento del diámetro telediastólico del ventrículo izquierdo (VI) (no reperfundido, 44,4±4,1mm y reperfundido, 43,8±5,7mm frente a la intervención simulada, 38,2±3,5 mm; p <0,01) y una FEVI reducida (no reperfundido, el 41,4±5,8% y reperfundido, el 49,8±6,4% frente a la intervención simulada, el 59,5±8,1%; p <0,01) y la FAVE (no reperfundido, el 21,8±5,4% y reperfundido, el 28,8±4,5% frente a la intervención simulada, el 35,9±6,3%; p <0,01). No obstante, no se detectaron diferencias en la función sistólica entre los grupos de IAM reperfundido y no reperfundido tratados con anticuerpo del isotipo anti-IgG (tabla 1).
Parámetros ecocardiográficos previos al sacrificio de los animales en los 5 grupos experimentales
| IAM no reperfundido | IAM reperfundido | ||||
|---|---|---|---|---|---|
| Simulación(n=13) | Anti-IgG(n=10) | Anti-VEGF-A165b(n=13) | Anti-IgG(n=12) | Anti-VEGF-A165b(n=13) | |
| DTDVI (mm) | 38,2±3,5 | 44,4±4,1a | 43,5±4,8b | 43,8±5,7a | 41,9±4,6 |
| FEVI (%) | 59,5±8,1 | 41,4±5,8a | 48,6±6,0a | 49,8±6,4a | 57,1±8,5c |
| FAVI (%) | 35,9±6,3 | 21,8±5,4a | 26,1±5,1a | 28,8±4,5a | 34,2±6,2c |
DTDVI: diámetro telediastólico del ventrículo izquierdo; FAVI: fracción de acortamiento del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; VEGF: factor de crecimiento endotelial vascular.
Los valores expresan media±desviación estándar y se analizaron mediante la prueba de la t de Student.
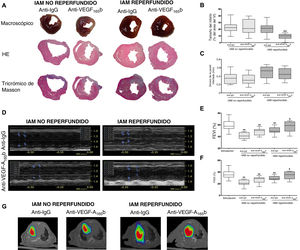
Curiosamente, en el modelo de IAM reperfundido, el tratamiento con un anticuerpo específico anti-VEGF-A165b produjo una mejora de la FEVI (el 57,1±8,5% frente al 49,8±6,4%; p <0,05) (figura 2D,E) y la FAVI (el 34,2±6,2% frente al 28,8±4,5%; p <0,05) respecto a los animales tratados con anticuerpo anti-IgG (figura 2D,F). En cambio, a pesar del bloqueo del VEGF-A165b, no se observó mejora en la función sistólica en ninguno de los grupos experimentales de IAM no reperfundido (tabla 1).
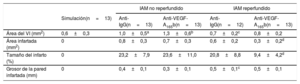
A continuación, se realizó el análisis macroscópico de los corazones aislados de los 4 grupos experimentales (figura 2A). En los ratones tratados con anticuerpo de isotipo anti-IgG, el tamaño del infarto fue similar entre los distintos grupos de IAM reperfundido y no reperfundido, mientras que se detectó mayor grosor de la pared infartada y menor volumen del VI en los animales con IAM reperfundido comparados con los de IAM no reperfundido (tabla 2).
El bloqueo del factor de crecimiento endotelial vascular (VEGF)-A165b produjo una disminución del tamaño del infarto y una mejora de la función sistólica en modelos de infarto agudo de miocardio (IAM) reperfundido, pero no en modelos no reperfundidos. A: imágenes representativas macroscópicas (fila superior) y microscópicas teñidas con hematoxilina-eosina (HE, fila central), y con tricrómico de Masson (fila inferior). En el modelo de IAM reperfundido, el tratamiento con un anticuerpo anti-VEGF-A165b específico dio como resultado una reducción en el tamaño del infarto (B), mientras que no se observaron cambios en el grosor de la pared infartada (C). Antes del sacrificio, la función sistólica se evaluaba mediante ecocardiografía con enmascaramiento. D: imágenes representativas de la ecocardiografía en modo M. En el modelo de IAM reperfundido, el tratamiento con un anticuerpo anti-VEGF-A165b específico produjo una mejora de (E) la fracción de eyección del ventrículo izquierdo (FEVI) y (F) la fracción de acortamiento del ventrículo izquierdo (FAVI), mientras que el tratamiento no tuvo efecto en el modelo de IAM no reperfundido. G: imágenes representativas de la tomografía por emisión de positrones/tomografía computarizada de los 4 grupos de IAM. Los datos continuos de distribución normal (n=13 ratones por grupo) se expresan como media±desviación estándar. Los datos se analizaron mediante la prueba de la t de Student para datos no emparejados. Un observador que desconocía el grupo experimental se encargó de la puntuación. VI: ventrículo izquierdo. **p <0,01 frente al grupo con intervención simulada. +p <0,05 y ++p <0,01 frente a animales con un IAM reperfundido tratados con anticuerpo anti-IgG. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Análisis de la estructura cardiaca de los 5 grupos experimentales
| IAM no reperfundido | IAM reperfundido | ||||
|---|---|---|---|---|---|
| Simulación(n=13) | Anti-IgG(n=13) | Anti-VEGF-A165b(n=13) | Anti-IgG(n=12) | Anti-VEGF-A165b(n=13) | |
| Área del VI (mm2) | 0,6±0,3 | 1,0±0,5a | 1,3±0,6b | 0,7±0,2c | 0,8±0,2 |
| Área infartada (mm2) | 0 | 0,8±0,3 | 0,7±0,3 | 0,6±0,2 | 0,3±0,2d |
| Tamaño del infarto (%) | 0 | 23,2±7,9 | 23,6±11,0 | 20,8±8,8 | 9,4±4,2d |
| Grosor de la pared infartada (mm) | 0 | 0,4±0,1 | 0,3±0,1 | 0,5±0,1c | 0,5±0,1 |
IAM: infarto agudo de miocardio; VEGF: factor de crecimiento endotelial vascular; VI: ventrículo izquierdo.
Los valores expresan media±desviación estándar y se analizaron mediante la prueba de la t de Student.
Hay que destacar que el tratamiento con un anticuerpo específico anti-VEGF-A165b en el modelo de IAM reperfundido redujo el tamaño del infarto respecto al tratamiento con anticuerpo anti-IgG (el 9,4±4,2% frente al 20,8±8,8%; p <0,01) (figura 2B), pero no se detectaron cambios en el grosor de la pared infartada (0,5±0,1 frente a 0,5±0,1 mm) (figura 2C). En cambio, en el modelo de IAM no reperfundido, el bloqueo de la isoforma antiangiogénica VEGF-A165b no tuvo efecto en el tamaño del infarto o el grosor de la pared infartada (tabla 2).
Por último, en las imágenes de tomografía por emisión de positrones/tomografía computarizada, el bloqueo del VEGF-A165b en ratones con IAM reperfundido redujo el tamaño del infarto (figura 2G). Por consiguiente, para mejorar la función sistólica resultante y minimizar el tamaño del infarto, son necesarios el bloqueo del VEGF-A165b y la reperfusión coronaria.
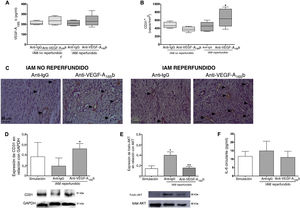
Implicaciones del bloqueo in vivo del VEGF-A165b en la neoangiogénesisLas concentraciones del VEGF-A165b circulante fuero similares en los 4 modelos experimentales de IAM independientemente del tratamiento recibido (figura 3A). En los modelos de IAM reperfundido, la densidad de los capilares evaluados mediante inmunohistoquímica fue considerablemente mayor en los animales tratados con anticuerpo anti-VEGF-A165b (666±211 células/mm2; p <0,05) frente a anti-IgG (451±115 células/mm2). Sin embargo, el bloqueo del VEGF-A165b no tuvo efecto en la densidad de los capilares en los grupos a los que se aplicó el modelo de IAM no reperfundido (anti-VEGF-A165b frente a anti-IgG, 377±60 frente a 478±75 células/mm2) (figura 3B, C). En realidad, el análisis mediante inmunotransferencia (Western blot) reveló un aumento de la expresión de la proteína CD31 en el miocardio infartado aislado de animales con IAM reperfundido tratados con anticuerpo anti-VEGF-A165b comparado con anti-IgG (figura 3D).
El bloqueo del factor de crecimiento endotelial vascular (VEGF)-A165b aumentó la densidad de los capilares en los animales con infarto agudo de miocardio (IAM) reperfundido, pero no en los que sufrieron un IAM no reperfundido. A: la concentración sérica del VEGF-A165b previa al sacrificio fue similar en los 4 grupos experimentales. B: cuantificación de vasos CD31+. Se obtuvieron 5 imágenes independientes del área infartada aisladas de los 4 grupos distintos de IAM y a continuación las analizó un observador que desconocía el grupo experimental. C: imágenes representativas del tejido infartado aisladas de los 4 grupos experimentales teñidos con el marcador vascular específico CD31. D: análisis de inmunotransferencia de la expresión de la proteína CD31 en el tejido miocárdico aislado del grupo con intervención simulada y de ambos grupos de IAM reperfundido tratados con anticuerpo bloqueador anti-IgG o anti-VEGF-A165b. E: análisis de inmunotransferencia de la relación entre la (fosfo) AKT y la AKT total en el tejido infartado del grupo con intervención simulada y de ambos grupos de IAM reperfundido tratados con anticuerpo bloqueador anti-IgG o anti-VEGF-A165b. F: concentración de interleucina 6 (IL-6) circulante de ambos grupos de IAM reperfundido tratados con anticuerpo bloqueador anti-IgG o anti-VEGF-A165b. Los datos continuos de distribución normal (n=13 animales por grupo) se expresan como media±desviación estándar y se analizaron mediante la prueba de la t de Student para datos no emparejados. *p <0,05 frente a intervención simulada. +p <0,05 y ++p <0,01 frente a animales con IAM reperfundido tratados con anticuerpo anti-IgG. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
Comparado con los controles, la fosforilación de la AKT fue considerablemente alta en las muestras cardiacas del grupo con IAM reperfundido, mientras que el bloqueo de la función del VEGF-A165b redujo la fosforilación de la AKT (figura 3E). No obstante, la concentración de interleucina 6 circulante no se hallaba alterada en ninguno de los grupos con IAM reperfundido comparado con la intervención simulada (anti-VEGF-A165b, 11,1±3,6 pg/ml y anti-IgG, 14,9±5,7 pg/ml frente a la intervención simulada, 11,7 ± 3,0 pg/ml) (figura 3F).
En resumen, el bloqueo del VEGF-A165b fomentó la neoangiogénesis, mejoró la función sistólica y redujo el infarto en el modelo de IAM reperfundido, pero no en el de IAM no reperfundido.
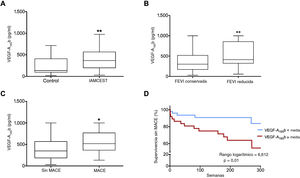
La mayor concentración sérica del VEGF-A165b en pacientes con IAMCEST se relacionó con función sistólica más reducida en las fases crónicas y con la aparición de MACE durante el seguimientoCaracterización del VEGF-A165b después del IAMCESTSe cuantificó la concentración sérica del VEGF-A165b en muestras extraídas 24 h después de la revascularización coronaria de 104 pacientes con IAMCEST y de 25 participantes del grupo de control. La concentración del VEGF-A165b circulante era considerablemente alta en los pacientes con IAMCEST (405±26 pg/ml; IC95%, 355-458 pg/ml; p <0,01) que en los controles (234±35 pg/ml; IC95%, 161-307) (figura 4A).
El aumento del factor de crecimiento endotelial vascular (VEGF)-A165b en pacientes con infarto de miocardio con elevación del segmento ST (IAMCEST) se relacionó con una FEVI más reducida en la resonancia magnética cardiovascular (RMC) a los 6 meses y la aparición de eventos adversos durante el seguimiento. A: la concentración sérica del VEGF-A165b a las 24 h de la reperfusión coronaria está aumentada en los pacientes con IAMCEST (n=104) comparados con los del grupo de control (n=23). Se detecta una concentración alta del VEGF-A165b en los pacientes con IAMCEST y fracción de eyección del ventrículo izquierdo (FEVI) (B) reducida a los 6 meses y con eventos cardiacos adversos mayores (C) (MACE) (muerte cardiaca, reinfarto o reingreso por insuficiencia cardiaca) durante el seguimiento. D: VEGF-A165b circulante y curvas de resultado de Kaplan-Meier para la supervivencia sin MACE durante el seguimiento, dependiendo de la concentración sérica del VEGF-A165b. Los datos continuos de distribución normal se expresan como media±error estándar de la media y el intervalo de confianza del 95% (IC95%) y se analizaron mediante la prueba de la t de Student para datos no emparejados. La relación entre la concentración del VEGF-A165b y el tiempo transcurrido hasta el primer MACE (D) se determinó mediante la curva de Kaplan-Meier y la prueba de rangos logarítmicos. *p <0,05 y **p <0,01 frente al grupo de control.
A continuación, se procuró evaluar la relación entre la concentración del VEGF-A165b en este momento puntual y la FEVI evaluada mediante RMC a los 6 meses. Para ello, se dividió a los pacientes con IAMCEST según tuvieran la FEVI reducida o conservada. Se detectó una menor concentración del VEGF-A165b circulante al cabo de 24 h de la reperfusión coronaria de pacientes con FEVI conservada en la RMC realizada a los 6 meses (conservada, 362±32 pg/ml [IC95%, 298-427] frente a reducida, 533±44 pg/ml [IC95%, 444-621]; p <0,01) (figura 4B).
Relación entre el VEGF-A165b y la aparición de MACEDurante el seguimiento (mediana, 186 [33-242] semanas), se produjeron 21 MACE (5 muertes cardiacas, 9 infartos de miocardio no mortales y 7 reingresos por insuficiencia cardiaca).
Los pacientes con MACE mostraron mayor concentración sérica del VEGF-A165b (552±56 pg/ml; IC95%, 435-670; p <0,05) que los pacientes sin MACE (413±32 pg/ml; IC95%, 350-475) (figura 4C). En realidad, tal como puede observarse en el análisis de las curvas de supervivencia (figura 4D), la concentración del VEGF-A165b> 405 pg/ml (media) se relacionó estrechamente con un aumento de la probabilidad de MACE (inferior el 10% frente a superior el 35%; p <0,01). Así pues, en los pacientes con IAMCEST, los valores del VEGF-A165b durante las primeras 24 h de la reperfusión se relacionaron con un mayor riesgo de eventos cardiacos durante el seguimiento.
DISCUSIÓNLas concentraciones sérica y miocárdica del VEGF-A165b habían aumentado considerablemente en los 2 modelos murinos experimentales (IAM reperfundido y no reperfundido) y se relacionaron con una función sistólica más reducida según la ecocardiografía. En resumen, el bloqueo del VEGF-A165b mejoró la densidad de los capilares, redujo el tamaño del infarto y aumentó la función sistólica en el modelo de IAM reperfundido, pero no en el no reperfundido. Por último, en una cohorte de pacientes con IAMCEST, la mayor concentración sérica del VEGF-A165b se correlacionó con una FEVI reducida según la RMC realizada en la fase crónica (6 meses) tras el IAM y con la aparición de MACE durante el seguimiento.
En pacientes con IAMCEST, hay que realizar una reperfusión coronaria inmediata para minimizar el tamaño del infarto y aumentar la esperanza de vida de los pacientes. A pesar de una reperfusión epicárdica satisfactoria, la microvasculatura se halla afectada en un 50-60% de los pacientes. Este fenómeno, conocido como obstrucción microvascular, desempeña una función perjudicial en la afección estructural resultante y en la supervivencia de los pacientes con IAMCEST1,2. No obstante, los estudios clínicos y experimentales han demostrado claramente la reparación espontánea de la microcirculación tras el IAMCEST, probablemente por el aumento endógeno de los factores proangiogénicos poco después de inducir el IAM7.
Se ha estudiado la angiogénesis como un potente mecanismo para reparar la pérdida de la microcirculación tras el IAM que produce efectos favorables en la curación del infarto, la recuperación sistólica y la oportuna remodelación del VI. La angiogénesis consiste en la formación de nuevos microvasos a partir de capilares preexistentes como respuesta a señales y factores diversos3. En consecuencia, es crucial comprender qué vías fisiopatológicas facilitan la angiogénesis a la hora de buscar alternativas terapéuticas complementarias, aparte de la reperfusión coronaria inmediata, para minimizar la carga del IAM en términos de morbilidad y mortalidad.
Función del VEGF-A165b en ratones que sufren un IAMEl VEGF-A interviene de manera activa en la reparación tisular regulando la angiogénesis, la permeabilidad vascular y la inflamación. Tras el IAM, se ha evaluado su función en suero y en el miocardio infartado tanto en pacientes como en modelos experimentales4. No obstante, el proceso de splicing alternativo del VEGF-A produce varias isoformas de ARNm, que incluyen una selección distal del sitio de corte y empalme en el exón 8 para generar una secuencia de exón 8b, que produce la isoforma antiangiogénica VEGF-A165b5. En estados angiogénicos patológicos, tales como la retinopatía diabética y el cáncer, se observa que la concentración del VEGF-A165b disminuye8,9. En cambio, el VEGF-A165b se relaciona con una menor densidad de capilares en la arteriopatía periférica10,11. En particular tras el IAM, un estudio anterior informó por primera vez de que la concentración del VEGF-A165b circulante se incrementó rápidamente en las primeras fases (1 semana) en pacientes con IAMCEST, lo que indica que esta isoforma también puede contribuir a alterar la neovascularización en la fase aguda posterior al IAM6.
Puesto que hasta ahora ningún estudio in vivo ha investigado la función del VEGF-A165b tras un IAM, nuestro objetivo era dilucidar la función de la isoforma del VEGF-A165b en 2 modelos de IAM experimentales: IAM reperfundido y IAM no reperfundido.
Según los resultados obtenidos, la concentración del VEGF-A165b circulante aumentó en ambos modelos murinos, y una mayor concentración sérica de este factor antiangiogénico se relacionó con menores FEVI y FAVI. Además, cuando se evaluó el área infartada de ambos modelos de IAM, se detectó un aumento de la expresión del VEGF-A165b, principalmente en las células endoteliales. Así pues, la regulación del proceso de splicing en el VEGF-A también es importante en el contexto del IAM en ratones.
Bloqueo del VEGF-A165b como potente diana para recuperar la densidad de los capilares y aumentar la función sistólica tras el IAMCon respecto a los resultados clínicos6 y experimentales previos, se especuló que una concentración alta del VEGF-A165b circulante podría obstaculizar la tendencia endógena hacia la recuperación de la perfusión microvascular. De hecho, cuando se utilizó un test de diferenciación de células endoteliales in vitro, el bloqueo del VEGF-A165b aumentó la capacidad angiogénica del suero de los pacientes con IAMCEST6. En realidad, en un estudio previo realizado con un modelo murino de arteriopatía periférica, se demostró que el tratamiento con un anticuerpo bloqueador contra la isoforma del VEGF-A165b revertía la revascularización alterada en la extremidad posterior isquémica10,11.
En el contexto de un IAM, los estudios clínicos y experimentales han demostrado que, aunque la densidad de los microvasos disminuya unos minutos después de la oclusión coronaria, poco después de la reperfusión coronaria se produce obstrucción microvascular masiva y macroscópica2,7. Este fenómeno se restaura espontáneamente debido a que aumenta la expresión de los factores proangiogénicos inmediatamente después del inicio de la isquemia7. Por lo tanto, investigar el bloqueo funcional del VEGF-A165b en un modelo básico de IAM debería ser el primer paso para descubrir una nueva y prometedora opción terapéutica para acelerar la neoangiogénesis en el área infartada.
Comparados con el grupo con IAM no reperfundido, el grosor de la pared infartada de los ratones sometidos a reperfusión coronaria era mayor, mientras que la FEVI y el tamaño del infarto seguían alterados. La reperfusión coronaria oportuna es el principal objetivo terapéutico para minimizar la apoptosis irreversible de los cardiomiocitos y, por lo tanto, reducir la lesión cardiaca. No obstante, aunque la reperfusión temprana es necesaria por la remodelación adversa, en los estudios clínicos y experimentales se ha observado su relación con estrés hemodinámico y oxidativo1,12. En consecuencia, descubrir nuevos tratamientos complementarios además de la reperfusión disminuirá aún más el tamaño del infarto y mejorará el resultado de los pacientes.
En este contexto, se observó que el bloqueo de la actividad del VEGF-A165b en ratones sometidos a 45min de isquemia seguida de 21 días de reperfusión coronaria aumentaba considerablemente la densidad de los capilares, disminuía el tamaño del infarto y mejoraba la función sistólica. No obstante, no se observaron estos efectos favorables en el modelo de IAM no reperfundido. Según los resultados in vivo, el VEGF-A165b podría ser un prometedor tratamiento complementario a la reperfusión para disminuir aún más el tamaño del infarto y el daño microvascular.
Para comprender el mecanismo de acción del VEGF-A165b, se evaluó la expresión de AKT, dada su participación en múltiples vías de señalización en la regulación de la angiogénesis mediada por el VEGF-A13. Los datos presentes indican que la vía de señalización de la AKT se activa después del IAM y que el efecto antiangiogénico del VEGF-A165b podría estar causado en parte por la activación de la AKT.
Se ha informado de que el VEGF-A165b reduce el factor de necrosis tumoral alfa en las células epiteliales pigmentadas de la retina y, en consecuencia, tiene efectos antiinflamatorios9. No obstante, según los resultados, la concentración de interleucina 6 en ambos grupos de IAM reperfundido 21 días después del IAM fue similar a la de los controles, probablemente debido a la casi completa resolución del ambiente proinflamatorio que aparece durante los primeros días tras la inducción del IAM.
En conclusión, el VEGF-A165b puede representar un nuevo objetivo farmacológico complementario a la reperfusión coronaria (el actual tratamiento de referencia para pacientes con IAMCEST), ya que su bloqueo podría aumentar la actividad de los factores de crecimiento proangiogénicos liberados desde el inicio de la isquemia7.
Implicaciones sistólicas y de pronóstico del VEGF-A165b en pacientes con IAMCESTLa alteración de la microcirculación en pacientes con IAMCEST se relaciona con la remodelación ventricular adversa y con la aparición de eventos cardiacos durante el seguimiento1,2. En consecuencia, comprender la función de un nuevo y potente regulador de la angiogénesis en este contexto podría ser crucial.
Tal como se observó anteriormente en una cohorte preliminar de 50 pacientes6 y como se ha confirmado aquí, la concentración del VEGF-A165b circulante está considerablemente elevada en los pacientes con IAMCEST comparados con los pacientes sanos. En realidad, se ha demostrado una mayor expresión de ácido ribonucleico mensajero (ARNm) de este factor antiangiogénico en la sangre periférica de pacientes con enfermedad coronaria14. Aunque ya se ha informado de que los valores altos del VEGF-A165b se relacionan con función sistólica afectada en la fase aguda (1 semana después del IAM), la novedad de este estudio radica en relacionar los valores del VEGF-A165b circulante con la función sistólica resultante en la fase crónica (6 meses después del IAM) y el pronóstico de los pacientes de la que es hasta ahora la mayor cohorte de pacientes con IAMCEST. Según los resultados, la mayor concentración sérica del VEGF-A165b se relaciona con función del VI más reducida según la RMC en la fase crónica (6 meses) posterior al IAM y con la aparición de MACE durante el seguimiento. Harada et al.15 también observaron la función de esta isoforma en el pronóstico del paciente en una cohorte de pacientes con IAMCEST muy pequeña.
Nuestro objetivo específico es establecer una relación entre este nuevo factor y la función del VI, ambos en las fases aguda6 y crónica, así como en lo que respecta al pronóstico de los pacientes. En este estudio, la intención no es demostrar su valor independiente para la estratificación del riesgo de los pacientes con IAMCEST más allá del arsenal ya disponible para este objetivo.
En resumen, y con respecto a los resultados clínicos y experimentales, la mayor concentración del VEGF-A165b se relacionó con peores función sistólica y pronóstico del paciente. Esto probablemente se deba a su interferencia en el restablecimiento fisiológico endógeno de la microcirculación afectada impulsado por el aumento de moléculas proangiogénicas en la región infartada7. De ahí que el bloqueo del VEGF-A165b pueda representar una estrategia terapéutica prometedora para mejorar la angiogénesis tras el IAMCEST y, por lo tanto, aumentar la función sistólica y la esperanza de vida de los pacientes.
Limitaciones del estudioDado el reducido número de pacientes, esta es solo una prueba de concepto para explorar un marcador en un modelo animal y en un pequeño número de pacientes. Se requiere otra validación en una cohorte de pacientes con IAMCEST más amplia.
CONCLUSIONESSe proporcionan pruebas de que el VEFG-A165b endógeno está considerablemente aumentado en modelos animales experimentales de IAM y en pacientes con IAMCEST. Su neutralización in vivo fomenta la angiogénesis, reduce el tamaño del infarto y aumenta la función sistólica siempre que se permita la reperfusión. En pacientes con IAMCEST, la mayor concentración de esta isoforna se correlaciona con peor función sistólica y con mayor incidencia de eventos adversos durante el seguimiento. La modulación farmacológica del VEGF-A165b podría ser un nuevo objetivo posible como tratamiento complementario a la reperfusión coronaria y merece más investigación clínica.
FINANCIACIÓNEste estudio fue financiado por el Instituto de Salud Carlos III y los Fondos Europeos de Desarrollo Regional FEDER (subvenciones de investigación PIE15/00013, PI17/01836, PI18/00209 y CIBERCV16/11/00486 y un contrato de posgrado FI18/00320 a C.R.-N. y FI19/00033 a L.H.); el Ministerio de Economía y Competitividad de España (SAF2017-89714-R); por la Sociedad Española de Cardiología (subvención SEC2017), y por la Generalitat Valenciana (GV/2018/116, CDEI-04/20 y AICO/2019/250).
CONFLICTO DE INTERESESNinguno.
- –
A pesar de la revascularización completa, la microvasculatura miocárdica se halla alterada en aproximadamente el 50% de los pacientes con IAM. Es fundamental descubrir tratamientos complementarios para disminuir la afección microvascular. La angiogénesis ayuda a restablecer la microvasculatura afectada tras el IAM. El objetivo es evaluar la función de la isoforma antiangiogénica del VEGF-A165b.
- –
Se demuestra que los modelos experimentales de IAM muestran concentraciones del VEGF-A165b circulante y miocárdico aumentadas. Su bloqueo in vivo aumentó la neoangiogénesis, redujo el tamaño del infarto y mejoró la función sistólica en los modelos de IAM reperfundido, pero no en los de IAM no reperfundido. En los pacientes, la mayor concentración del VEGF-A165b se relacionó con una fracción de eyección reducida y con peor pronóstico. El bloqueo de este factor antiangiogénico puede tener efectos favorables después del IAM.