Hay falta de evidencia científica sobre el papel de la ecocardiografía intravascular intravascular (IVUS) para guiar procedimientos de intervencionismo coronario percutáneo (PCI) en pacientes con infarto agudo de miocardio (IAM) y alto riesgo isquémico. El objetivo de este trabajo fue investigar el impacto clínico a largo plazo de la PCI guiada por IVUS en pacientes con IAM y alto riesgo isquémico.
MétodosSe seleccionó una población de 8.890 pacientes sometidos con éxito a PCI con stent recubierto de segunda generación entre un total de 13.104 pacientes con IAM incluidos en el registro Korea Acute Myocardial Infarction Registry-National Institutes of Health. Los pacientes se clasificaron en 2 grupos según la presencia o no de alto riesgo isquémico, definido como la presencia de alguna de las siguientes condiciones: implante ≥ 3 stents, tratamiento ≥ 3 vasos, longitud total de stent> 60mm, PCI en el tronco, diabetes o enfermedad renal crónica. El objetivo primario fue el fracaso a 3 años de la lesión diana revascularizada, incluida muerte cardiaca, infarto de miocardio en el vaso objetivo y revascularización por isquemia relacionada con la lesión objetivo.
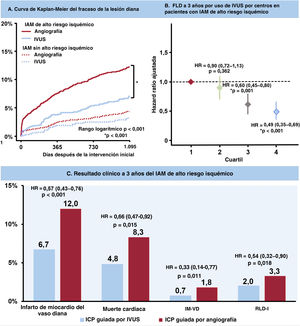
ResultadosEn 4.070 pacientes con IAM y alto riesgo isquémico, la PCI guiada por IVUS se asoció a un riesgo significativamente menor de fracaso a 3 años de la lesión objetivo revascularizada comparado con la PCI guiada por angiografía (6,7 frente a 12,0%; HR=0,54; intervalo de confianza del 95%, 0,41-0,72; p <0,001). Los resultados se mantuvieron tras el ajuste por posibles factores de confusión, ponderación de probabilidad inversa y emparejamiento por puntuación de propensión.
ConclusionesLa PCI guiada por IVUS se asocia a una reducción significativa del fracaso a 3 años de la lesión objetivo revascularizada en pacientes con IAM y alto riesgo isquémico en los que se utilizó stent recubierto de segunda generación.
Número de registro en iCreaT: C110016.
Palabras clave
La intervención coronaria percutánea (ICP) guiada por ecografía intravascular (IVUS) con stent farmacoactivo (SFA) ha mostrado mejores resultados clínicos que la ICP guiada por angiografía en varios ensayos clínicos gracias a la orientación en la clasificación preintervencionista de la lesión, el tamaño del vaso y el tamaño óptimo del balón o del stent, y la evaluación postintervencionista de la complicación, el área mínima del stent y la optimización de este1–5. Recientemente, la ICP guiada por IVUS redujo los eventos adversos cardiovasculares mayores a largo plazo, incluso en pacientes con infarto agudo de miocardio (IAM)6,7.
Junto con la creación de dispositivos de nueva generación, se ha intentado llevar a cabo la ICP con más frecuencia en pacientes con dificultades de la lesión grave8,9. Además, su uso ha aumentado en pacientes con mal pronóstico clínico debido al alto riesgo isquémico10,11. En casos de pacientes complejos y de alto riesgo isquémico, la ICP guiada por IVUS mostró mejores resultados clínicos que la ICP guiada por angiografía en 2 estudios observacionales en los que no todos los pacientes presentaron IAM12,13. Por tanto, estos 2 estudios fueron insuficientes para confirmar el beneficio de la IVUS en el contexto del IAM con la enfermedad isquémica, por lo demás, elevada. Aunque continúa aumentando el número de pacientes con IAM de alto riesgo isquémico, todavía faltan datos sobre el papel de la IVUS en pacientes tratados mediante ICP en la actual era de los SFA de segunda generación. Por tanto, este estudio tuvo como objetivo evaluar el impacto clínico a largo plazo del guiado de la IVUS en el implante de SFA de segunda generación en pacientes con IAM de alto riesgo isquémico.
MÉTODOSPoblación de estudioSe recopilaron datos clínicos del Korea Acute Myocardial Infarction Registry-National Institutes of Health (KAMIR-NIH), un registro nacional coreano, multicéntrico y prospectivo. Veinte grandes centros cardiovasculares incluyeron a pacientes con IAM entre noviembre de 2011 y diciembre de 2015. Los parámetros clínicos detallados de todos los pacientes se han descrito con anterioridad14. Los coordinadores del estudio formados en cada centro recopilaron la información utilizando un formulario de informe de la web del sistema de gestión de ensayos e investigación clínicos en internet. El seguimiento de los resultados clínicos de los pacientes se llevó a cabo a 1, 6, 12, 24 y 36 meses por parte de los especialistas utilizando los formularios de informe de casos de la web. El estudio recibió el apoyo de una subvención de los Korea Centers for Disease Control and Prevention desde noviembre de 2011 (estudio iCreaT No. C110016). Los protocolos del estudio fueron aprobados por los comités de ética de cada centro participante y todos cumplieron los principios de la Declaración de Helsinki revisada (número de aprobación de la Junta de Revisión Institucional: CNUH-2011-172). Se obtuvo el consentimiento informado de todos los pacientes que participaron en el estudio KAMIR-NIH.
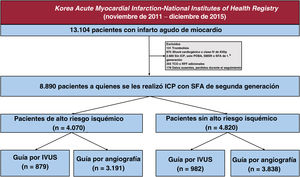
Se seleccionó a 8.890 pacientes tratados con ICP con implante de SFA de segunda generación entre 13.104 pacientes con IAM inscritos en el KAMIR-NIH. Los criterios de exclusión fueron trombolisis antes de la ICP, shock cardiogénico o clase IV de Killip, ausencia de ICP o ICP sin implante de stent, ICP con stent metálico sin recubrimiento o SFA de primera generación, uso de la tomografía de coherencia óptica o de la reserva fraccional de flujo, datos ausentes y pérdida de pacientes durante el seguimiento (p. ej., cuando se dio de alta al paciente de forma segura, pero no volvió a hacer ninguna visita en el hospital). Por último, se dividió a los pacientes en 2 grupos: aquellos con alto riesgo isquémico (figura 1), que se definió como cualquiera de los siguientes: implante ≥ 3 stents, tratamiento de 3 vasos, tratamiento ≥ 3 lesiones, longitud total del stent> 60mm, ICP del tronco coronario izquierdo, diabetes mellitus y enfermedad renal crónica (ERC), y aquellos sin alto riesgo isquémico15–17.
Esquema del estudio. Los datos utilizados en este estudio se obtuvieron del Korea Acute Myocardial Infarction Registry-National Institutes of Health (KAMIR-NIH), un registro nacional coreano, multicéntrico y prospectivo -Institutos Nacionales de Registro de Salud. IVUS: ecografía intravascular; ICP: intervención coronaria percutánea; POBA: angioplastia tradicional con balón; RFF: reserva fraccional de flujo; SFA: stent farmacoactivo; SMSR: stent metálico sin revestimiento; TCO: tomografía de coherencia óptica.
Los pacientes con IAM que recibieron un implante de SFA de segunda generación se trataron de acuerdo con la guía de práctica clínica vigente sobre IAM18,19. Antes de la intervención se administró a los pacientes antiagregantes plaquetarios (300mg de ácido acetilsalicílico y un inhibidor de P2Y12 [clopidogrel, 300-600mg; prasugrel, 60mg, o ticagrelor, 180mg]) de forma habitual, seguidos por ácido acetilsalicílico diario (100mg) e inhibidores de P2Y12 (clopidogrel, 75mg una vez; prasugrel, 10mg una vez, o ticagrelor, 90mg dos veces al día). Cada intervención la llevó a cabo un cirujano mediante técnicas de intervención convencionales. La optimización de la ICP guiada por angiografía o IVUS la seleccionó cada cirujano. Igualmente, se dejó a cada médico la elección del tamaño del balón o el tamaño y tipo del stent preoperatorios, la estrategia de intervención (uso de aspiración de trombos) y los fármacos (uso de inhibidores de la glucoproteína IIb/IIIa o dosis de heparina). La ICP con éxito se definió como flujo postrombolisis en el infarto de miocardio ≥ 2 y estenosis residual <30%.
Objetivos del estudioEl objetivo principal fue el fracaso de la lesión diana (FLD) a los 3 años después de la intervención inicial, definido como el objetivo compuesto de muerte cardiaca, infarto de miocardio del vaso diana (IM-VD) y revascularización de la lesión diana por isquemia (RLD-I). La muerte se consideró como muerte cardiaca a no ser que se hubiera podido identificar una causa de muerte no cardiaca definida. El IM-VD se definió como un IM con evidencia de necrosis miocárdica en la región del vaso diana tratado previamente según la Tercera definición universal de infarto de miocardio20. La RLD-I se consideró como cualquier revascularización de la lesión diana por ICP debido a la presencia de ≥ 50% de estenosis del diámetro angiográfico asociada con síntomas de angina o un estudio funcional positivo, o ≥ 70% de estenosis del diámetro angiográfico sin síntomas de angina ni estudio funcional positivo. Entre los objetivos secundarios se encontraban componentes individuales de FLD con trombosis del stent manifiesta o probable, que se definió según las definiciones del Academic Research Consortium21, y eventos adversos cardiovasculares mayores, que se definieron como el objetivo compuesto de muerte por cualquier causa, cualquier IM y cualquier revascularización.
Análisis estadísticosLas variables cualitativas se expresan como frecuencias y porcentajes. En función del número de cada variable, se realizó la prueba de la χ2 o la prueba exacta de Fisher. Las variables continuas se analizaron con métodos descriptivos según su distribución y las variables con distribución normal se presentan como medias y desviaciones estándar. Las incidencias acumuladas de eventos clínicos a los 3 años se calcularon mediante las curvas de Kaplan-Meier y las comparaciones de los resultados clínicos entre los grupos de ICP guiada por IVUS e ICP guiada por angiografía se analizaron mediante la prueba del orden logarítmico22.
Puesto que las diferencias de las características iniciales podrían afectar a los resultados clínicos, se hicieron análisis de sensibilidad para ajustar los factores de confusión en la medida de lo posible. En primer lugar, se utilizó un modelo de regresión de Cox multivariante para evaluar cada uno de los resultados clínicos. Las variables que fueron significativas en el análisis univariante (p <0,1) se incluyeron en el análisis multivariante con las siguientes covariables: edad, sexo, clase III de Killip como edema pulmonar agudo, infarto de miocardio con elevación del segmento ST, hipertensión, diabetes mellitus, ICP previa, antecedentes de accidente cerebrovascular, fracción de eyección del ventrículo izquierdo ≤ 50% como disfunción del ventrículo izquierdo, tasa de filtrado glomerular estimado ≤ 60ml/min/1,73 m2 como ERC, uso de estatinas, enfermedad multivaso, ICP del tronco coronario izquierdo, inhibidores de la glucoproteína IIb/IIIa y factores de la intervención (abordaje transradial, longitud del stent ≥ 35mm y número de stents ≥ 2). En segundo lugar, realizamos una ponderación por probabilidad inversa (IPW) y un emparejamiento por puntuación de propensión (PSM) entre los grupos por la diferencia numérica entre las 2 estrategias de ICP en pacientes con y sin alto riesgo isquémico, respectivamente. La IPW y el PSM de todas las variables se evaluó mediante el modelo de regresión de riesgos proporcionales. Los valores después del ajuste del PSM y la IPW estuvieron dentro de±10% en todas las covariables emparejadas, lo que demuestra un equilibrio satisfactorio entre los grupos de comparación en pacientes con IAM con alto riesgo isquémico (tablas 1 y 2 del material adicional, figuras 1 y 2 del material adicional). En tercer lugar, le siguieron las comparaciones del objetivo principal entre las estrategias guiadas por IVUS y aquellas por angiografía en pacientes con alto riesgo isquémico de acuerdo con los subgrupos explorados de interés, y se evaluó la interacción entre el efecto de la IVUS y estas covariables mediante un modelo de regresión de Cox. Para evaluar la diferencia en el FLD a 3 años por cuartiles de la proporción de ICP guiadas por IVUS por centros cuando se implantó el SFA de segunda generación en pacientes con IAM, se utilizaron curvas de Kaplan-Meier y un modelo de regresión de Cox multivariante de FLD a los 3 años por cuartiles del volumen de uso de la IVUS por centros.
Todos los análisis estadísticos se hicieron con el software survival, MatchIt y WeightIt packages R, versión 3.6.3 (R Foundation for Statistical Computing, Austria).
RESULTADOSPoblación de estudioLa selección de los pacientes inscritos se muestra en la figura 1. Finalmente, a 8.890 pacientes con IAM se les practicó una ICP con implante de SFA de segunda generación; 4.070 (45,8%) y 4.820 (54,2%) se identificaron como de alto riesgo isquémico y sin alto riesgo isquémico, respectivamente (figura 3 del material adicional). De los 4.070 pacientes con IAM de alto riesgo isquémico, a 879 (21,6%) se les practicó ICP guiada por IVUS y a 3.191 (78,4%), ICP guiada por angiografía. Entre los 4.820 pacientes con IAM que no tenían alto riesgo isquémico, a 982 (20,4%) se les hizo ICP guiada por IVUS y a 3.838 (79,6%) ICP guiada por angiografía, respectivamente.
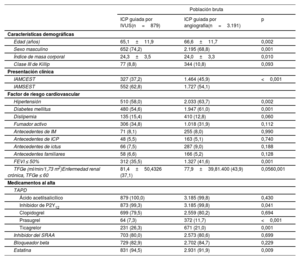
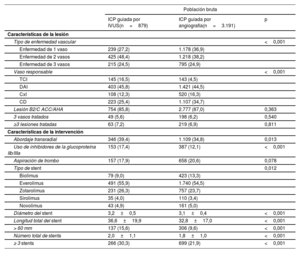
Características iniciales de los pacientesEn general, la media de edad de los pacientes fue de 63,3±12,4 años, y 6.722 pacientes (75,6%) eran varones. Las características clínicas, de lesiones y de intervenciones iniciales de los pacientes con IAM de alto riesgo isquémico se resumen en la tabla 1 y la tabla 2. Los pacientes con ICP guiada por IVUS eran en general varones y más jóvenes que aquellos con ICP guiada por angiografía. El grupo de ICP guiada por IVUS tuvo una menor prevalencia de pacientes con infarto de miocardio con elevación del segmento ST, antecedentes de hipertensión, diabetes mellitus y ERC que el grupo de ICP guiada por angiografía. Se prescribieron tricagrelor y estatinas con mayor frecuencia al alta en el grupo de ICP guiada por IVUS que en el grupo de ICP guiada por angiografía. El grupo de ICP guiada por IVUS tuvo niveles más altos de enfermedad multivaso, enfermedad del tronco coronario izquierdo, uso del abordaje transradial y uso de inhibidores de la glucoproteína IIb/IIIa que el grupo de ICP guiada por angiografía. Se observó un diámetro del stent considerablemente mayor, mayor longitud del stent y mayor número de implantes de stent (≥ 3 stents) en el grupo de ICP guiada por IVUS que en el grupo de ICP guiada por angiografía. Las características iniciales de los pacientes con IAM sin alto riesgo isquémico se muestran en la tabla 3 y en la tabla 4 del material adicional.
Características clínicas iniciales de los pacientes con IAM de alto riesgo isquémico
| Población bruta | |||
|---|---|---|---|
| ICP guiada por IVUS(n=879) | ICP guiada por angiografía(n=3.191) | p | |
| Características demográficas | |||
| Edad (años) | 65,1±11,9 | 66,6±11,7 | 0,002 |
| Sexo masculino | 652 (74,2) | 2.195 (68,8) | 0,001 |
| Índice de masa corporal | 24,3±3,5 | 24,0±3,3 | 0,010 |
| Clase III de Killip | 77 (8,8) | 344 (10,8) | 0,093 |
| Presentación clínica | |||
| IAMCEST | 327 (37,2) | 1.464 (45,9) | <0,001 |
| IAMSEST | 552 (62,8) | 1.727 (54,1) | |
| Factor de riesgo cardiovascular | |||
| Hipertensión | 510 (58,0) | 2.033 (63,7) | 0,002 |
| Diabetes mellitus | 480 (54,6) | 1.947 (61,0) | 0,001 |
| Dislipemia | 135 (15,4) | 410 (12,8) | 0,060 |
| Fumador activo | 306 (34,8) | 1.018 (31,9) | 0,112 |
| Antecedentes de IM | 71 (8,1) | 255 (8,0) | 0,990 |
| Antecedentes de ICP | 48 (5,5) | 163 (5,1) | 0,740 |
| Antecedentes de ictus | 66 (7,5) | 287 (9,0) | 0,188 |
| Antecedentes familiares | 58 (6,6) | 166 (5,2) | 0,128 |
| FEVI ≤ 50% | 312 (35,5) | 1.327 (41,6) | 0,001 |
| TFGe (ml/min/1,73 m2)Enfermedad renal crónica, TFGe ≤ 60 | 81,4±50,4326 (37,1) | 77,9±39,81.400 (43,9) | 0,0560,001 |
| Medicamentos al alta | |||
| TAPD | |||
| Ácido acetilsalicílico | 879 (100,0) | 3.185 (99,8) | 0,430 |
| Inhibidor de P2Y12 | 873 (99,3) | 3.185 (99,8) | 0,041 |
| Clopidogrel | 699 (79,5) | 2.559 (80,2) | 0,694 |
| Prasugrel | 64 (7,3) | 372 (11,7) | <0,001 |
| Ticagrelor | 231 (26,3) | 671 (21,0) | 0,001 |
| Inhibidor del SRAA | 703 (80,0) | 2.573 (80,6) | 0,699 |
| Bloqueador beta | 729 (82,9) | 2.702 (84,7) | 0,229 |
| Estatina | 831 (94,5) | 2.931 (91,9) | 0,009 |
Los valores se presentan como media±desviación estándar o en cifras (%).
IVUS: ecografía intravascular; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; IM: infarto de miocardio; SRAA: sistema renina-angiotensina-aldosterona; TAPD: tratamiento antiagregante plaquetario doble; TFGe: tasa de filtrado glomerular estimado.
Lesión y características de la intervención de los pacientes con infarto agudo de miocardio de alto riesgo isquémico
| Población bruta | |||
|---|---|---|---|
| ICP guiada por IVUS(n=879) | ICP guiada por angiografía(n=3.191) | p | |
| Características de la lesión | |||
| Tipo de enfermedad vascular | <0,001 | ||
| Enfermedad de 1 vaso | 239 (27,2) | 1.178 (36,9) | |
| Enfermedad de 2 vasos | 425 (48,4) | 1.218 (38,2) | |
| Enfermedad de 3 vasos | 215 (24,5) | 795 (24,9) | |
| Vaso responsable | <0,001 | ||
| TCI | 145 (16,5) | 143 (4,5) | |
| DAI | 403 (45,8) | 1.421 (44,5) | |
| CxI | 108 (12,3) | 520 (16,3) | |
| CD | 223 (25,4) | 1.107 (34,7) | |
| Lesión B2/C ACC/AHA | 754 (85,8) | 2.777 (87,0) | 0,363 |
| 3 vasos tratados | 49 (5,6) | 198 (6,2) | 0,540 |
| ≥3 lesiones tratadas | 63 (7,2) | 219 (6,9) | 0,811 |
| Características de la intervención | |||
| Abordaje transradial | 346 (39,4) | 1.109 (34,8) | 0,013 |
| Uso de inhibidores de la glucoproteína IIb/IIIa | 153 (17,4) | 387 (12,1) | <0,001 |
| Aspiración de trombo | 157 (17,9) | 658 (20,6) | 0,078 |
| Tipo de stent | 0,012 | ||
| Biolimus | 79 (9,0) | 423 (13,3) | |
| Everolimus | 491 (55,9) | 1.740 (54,5) | |
| Zotarolimus | 231 (26,3) | 757 (23,7) | |
| Sirolimus | 35 (4,0) | 110 (3,4) | |
| Novolimus | 43 (4,9) | 161 (5,0) | |
| Diámetro del stent | 3,2±0,5 | 3,1±0,4 | <0,001 |
| Longitud total del stent | 36,6±19,9 | 32,8±17,0 | <0,001 |
| > 60 mm | 137 (15,6) | 306 (9,6) | <0,001 |
| Número total de stents | 2,0±1,1 | 1,8±1,0 | <0,001 |
| ≥ 3 stents | 266 (30,3) | 699 (21,9) | <0,001 |
Los valores se presentan como media±desviación estándar o en cifras (%).
ACC: American College of Cardiology; CD: arteria coronaria derecha; CxI: arteria circunfleja izquierda; DAI: arteria descendente anterior izquierda; AHA: American Heart Association; IVUS: ecografía intravascular; SFA: stent farmacoactivo; TCI: tronco coronario izquierdo.
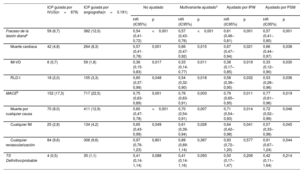
Comparación del resultado clínico a 3 años en pacientes con infarto agudo de miocardio de alto riesgo isquémico
| ICP guiada por IVUS(n=879) | ICP guiada por angiografía(n=3.191) | No ajustado | Multivariante ajustadoc | Ajustado por IPW | Ajustado por PSM | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | HR (IC95%) | p | |||
| Fracaso de la lesión dianaa | 59 (6,7) | 382 (12,0) | 0,54 (0,41-0,72) | <0,001 | 0,57 (0,43-0,76) | <0,001 | 0,61 (0,46–0,81) | 0,001 | 0,57 (0,41–0,80) | 0,001 |
| Muerte cardiaca | 42 (4,8) | 264 (8,3) | 0,57 (0,41-0,78) | 0,001 | 0,66 (0,47-0,92) | 0,015 | 0,67 (0,47–0,94) | 0,021 | 0,66 (0,44–0,97) | 0,038 |
| IM-VD | 6 (0,7) | 59 (1,8) | 0,36 (0,15-0,83) | 0,017 | 0,33 (0,14-0,77) | 0,011 | 0,38 (0,17–0,85) | 0,019 | 0,33 (0,12–0,90) | 0,030 |
| RLD-I | 18 (2,0) | 105 (3,3) | 0,60 (0,37-0,99) | 0,048 | 0,54 (0,32-0,90) | 0,018 | 0,58 (0,36–0,95) | 0,032 | 0,53 (0,28–0,96) | 0,036 |
| MACEb | 152 (17,3) | 717 (22,5) | 0,75 (0,63-0,89) | 0,001 | 0,76 (0,63-0,91) | 0,003 | 0,79 (0,65–0,95) | 0,011 | 0,77 (0,61–0,96) | 0,019 |
| Muerte por cualquier causa | 70 (8,0) | 411 (12,9) | 0,60 (0,47-0,78) | <0,001 | 0,70 (0,54-0,91) | 0,007 | 0,71 (0,54–0,93) | 0,014 | 0,72 (0,52–0,99) | 0,046 |
| Cualquier IM | 25 (2,8) | 134 (4,2) | 0,65 (0,43-0,99) | 0,049 | 0,61 (0,39-0,94) | 0,026 | 0,64 (0,42–0,98) | 0,041 | 0,57 (0,33–0,98) | 0,045 |
| Cualquier revascularización | 84 (9,6) | 306 (9,6) | 0,97 (0,76-1,23) | 0,801 | 0,89 (0,69-1,14) | 0,367 | 0,93 (0,72–1,20) | 0,577 | 0,91 (0,67–1,24) | 0,544 |
| TS Definitivo/probable | 4 (0,5) | 35 (1,1) | 0,41 (0,14-1,14) | 0,088 | 0,41 (0,14-1,16) | 0,093 | 0,50 (0,17–1,47) | 0,206 | 0,42 (0,11–1,64) | 0,214 |
A menos que se indique lo contrario, los valores se presentan en cifras (%).
ERC: enfermedad renal crónica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IM-VD: infarto de miocardio del vaso diana; IPW: ponderación por probabilidad inversa; MACE: eventos adversos cardiovasculares mayores; PSM: emparejamiento por puntuación de propensión; RLD-I: revascularización de la lesión diana por isquemia; TCI: tronco coronario izquierdo; TS: trombosis del stent.
Variables ajustadas: edad, sexo, clase III de Killip, IAMCEST, hipertensión, diabetes, antecedentes de ICP, ictus, FEVI ≤ 50%, ERC, uso de estatinas, enfermedad multivaso, ICP del TCI, inhibidores de la glucoproteína IIb/IIIa y factores de la intervención (abordaje transradial, longitud del stent ≥ 35mm y número de stents ≥ 2).
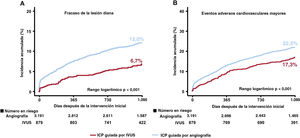
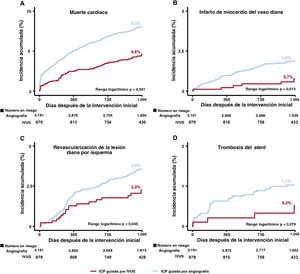
La mediana de la duración del seguimiento fue de 3 años (rango intercuartílico: 2,88-3,23 años). En la figura 2, figura 3 y tabla 3 se presenta una comparación de los resultados clínicos entre el grupo de ICP guiada por IVUS y el de ICP guiada por angiografía en pacientes con IAM de alto riesgo isquémico. El riesgo de FLD a 3 años fue significativamente menor en el grupo guiado por IVUS que en el grupo guiado por angiografía (el 6,7 y el 12,0%, respectivamente; hazard ratio [HR] = 0,54; intervalo de confianza del 95% [IC95%], 0,41-0,72; p <0,001) (figura 2A). Los resultados concordaron después del análisis de regresión de Cox multivariante (HR con un ajuste multivariable, 0,57; IC95%, 0,43-0,76; p <0,001), con un ajuste por IPW (HR con un ajuste por IPW, 0,61; IC95%, 0,46-0,81; p=0,001), y con un ajuste por PSM (HR con un ajuste por PSM, 0,57; IC95%, 0,41-0,80; p=0,001) (tabla 3). La ICP guiada por IVUS se asoció significativamente con una reducción de los eventos adversos cardiovasculares mayores, muerte cardiaca, IM-VD, RLD-I, muerte por cualquier causa y todos los IM después de varios ajustes por diversos factores de confusión (figura 2, figura 3, y tabla 3). Sin embargo, no hubo diferencia significativa en el riesgo de revascularización ni de trombosis del stent entre los grupos (figura 3 y tabla 3). En pacientes con IAM sin alto riesgo isquémico, la ICP guiada por IVUS no redujo los resultados clínicos a 3 años en comparación con la ICP guiada por angiografía (tabla 5 del material adicional).
Incidencia acumulada de resultados clínicos según el uso de la IVUS. Se muestran las curvas de Kaplan-Meier para comparar los niveles de fracaso de la lesión diana (A) y los eventos adversos cardiovasculares mayores (B) entre la ICP guiada por IVUS frente a la ICP guiada por angiografía en pacientes con infarto agudo de miocardio de alto riesgo isquémico. IVUS: ecografía intravascular; ICP: intervención coronaria percutánea.
Incidencia acumulada de elementos de fracaso de la lesión diana y trombosis del stent. Se muestran las curvas de Kaplan-Meier para la comparación de los niveles de muerte cardiaca (A), infarto de miocardio del vaso diana (B), revascularización de la lesión diana por isquemia (C) y trombosis del stent (D) entre la ICP guiada por IVUS frente a la ICP guiada por angiografía en pacientes con infarto agudo de miocardio de alto riesgo isquémico. IVUS: ecografía intravascular; ICP: intervención coronaria percutánea.
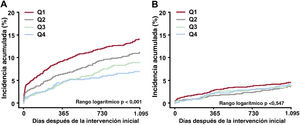
Los 20 centros inscritos se dividieron en cuartiles clasificados por la proporción de ICP guiadas por IVUS por centro entre los pacientes con IAM a los que se les realizó ICP con implantación de SFA de segunda generación (cuartiles 1-4). En pacientes con IAM de alto riesgo isquémico, el FLD ajustado a 3 años disminuyó gradualmente de los cuartiles 1 a 4 (figura 4A). El cuartil 4 se asoció significativamente con una reducción del FLD ajustado a 3 años en comparación con el cuartil 1 (HR con un ajuste por multivariante = 0,49; IC95%, 0,35-0,69; p <0,001) (figura 5). No hubo reducción del FLD a 3 años en pacientes con IAM sin alto riesgo isquémico (figura 4B).
Fracaso de la lesión diana ajustado a 3 años por cuartiles. El fracaso de la lesión diana ajustado a 3 años muestra una disminución gradual de los cuartiles 1 a 4 en pacientes con IAM de alto riesgo isquémico (A), pero no en pacientes con infarto agudo de miocardio sin alto riesgo isquémico (B).
Figura central. Resultados clínicos entre la ICP guiada por IVUS y la ICP guiada por angiografía en pacientes con IAM de alto riesgo isquémico. En pacientes con IAM de alto riesgo isquémico, la ICP guiada por IVUS se asoció con un riesgo considerablemente menor de FLD a 3 años en comparación con la ICP guiada por angiografía, aunque no se observó el beneficio de la ICP guiada por IVUS en pacientes con IAM sin alto riesgo isquémico (A). El análisis de cuartiles por la proporción de ICP guiada por IVUS por centros mostró que el cuartil 4 se asoció significativamente con una reducción en la TLF ajustada a los 3 años en comparación con el cuartil 1 (B). En comparación con la ICP guiada por angiografía, la guía IVUS se asoció significativamente con un menor riesgo de FLD a 3 años, impulsado por muerte cardiaca, IM-VD y RDL-I, en pacientes con IAM de alto riesgo isquémico (C).
IAM: infarto agudo de miocardio; HR: hazard ratio (todos los hazard ratio de esta figura representan el hazard ratio ajustado multivariante). IVUS: ecografía intravascular; FLD: fracaso de la lesión diana; IM-VD: infarto de miocardio del vaso diana; RLD-I: revascularización de la lesión diana por isquemia.
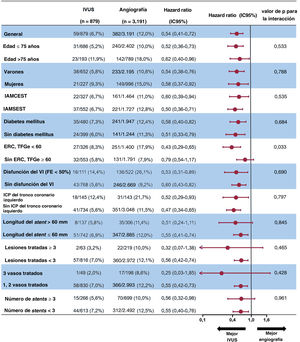
La figura 6 presenta un gráfico de bosque que muestra el impacto pronóstico de la ICP guiada por IVUS sobre el FLD entre los diversos factores isquémicos de los pacientes con IAM con alto riesgo isquémico. El impacto favorable de la ICP guiada por IVUS sobre el FLD a 3 años concordó en todos los subgrupos. En especial, el impacto de la ICP guiada por IVUS fue más dominante entre los pacientes con ERC (HR = 0,43; IC95%, 0,29-0,65) que entre aquellos sin ERC (HR = 0,79; IC95%, 0,54-1,17; p=0,033 de la interacción).
Análisis exploratorio de subgrupos del fracaso de la lesión diana a 3 años mediante el uso de IVUS en pacientes con infarto agudo de miocardio de alto riesgo isquémico. ERC: enfermedad renal crónica; IVUS: ecografía intravascular; FE: fracción de eyección; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; ICP: intervención coronaria percutánea; VI: ventrículo izquierdo.
En este estudio comparamos los resultados clínicos a 3 años entre la ICP guiada por IVUS y la ICP guiada por angiografía en implantes de SFA de segunda generación en pacientes con IAM con o sin alto riesgo isquémico utilizando datos de un registro nacional, especializado, multicéntrico y prospectivo de IAM. Los principales resultados del presente estudio son los siguientes: a) en comparación con la ICP guiada por angiografía, la ICP guiada por IVUS se asoció significativamente con un menor riesgo de FLD a 3 años, impulsado por muerte cardiaca, IM-VD y RLD-I, en pacientes con IAM de alto riesgo isquémico, pero no en pacientes sin alto riesgo isquémico (figura 5); y b) en el análisis de cuartiles por la proporción de ICP guiadas por IVUS por centros, el mayor uso de la ICP guiada por IVUS se asoció con una reducción del FLD a 3 años en pacientes con alto riesgo isquémico.
Los resultados ampliados de un estudio previo de distribución aleatoria a 1 año que comunicó que la mejora clínica de la ICP guiada por IVUS dura de 3 a 5 años se han publicado recientemente y los objetivos de valoración de la ICP guiada por IVUS también mejoraron incluso en el síndrome coronario agudo en un análisis de subgrupos23,24. Más recientemente, los datos del registro mostraron que el implante de SFA guiado por IVUS se asoció con una reducción de los resultados clínicos, incluyendo los objetivos más duros, como la muerte, el IM en el contexto del IAM, pero un análisis de subgrupos no mostró ningún beneficio significativo en la ICP de alto riesgo isquémico, definida como ICP de lesiones de bifurcación, oclusión total crónica, lesión del tronco coronario izquierdo, enfermedad multivaso, reestenosis, lesiones largas difusas (≥ 60mm) e implantes ≥ 3 stents6.
Con la creación del perfil del stent, las modalidades de las técnicas de imagen intravascular y medicamentos como los antiagregantes plaquetarios potentes, los niveles de eventos isquémicos han disminuido y el uso de la ICP en pacientes con lesiones complejas y alto riesgo isquémico ha aumentado paulatinamente25,26. Aunque la definición de alto riesgo isquémico varió ligeramente en cada estudio y no hay ningún ensayo de distribución aleatoria sobre el tema, la ICP guiada por IVUS de lesiones complejas incluye bifurcación, oclusión total crónica, tronco coronario izquierdo, longitud del stent ≥ 38mm, ICP multivaso, implante ≥ 3 stents, reestenosis del stent y lesiones muy calcificadas asociadas a menos eventos adversos a largo plazo, como muerte, IM y FLD13. Además de los beneficios de la ICP guiada por IVUS en pacientes con IAM a quienes se les implantó un SFA de segunda generación, que comúnmente comporta alto riesgo isquémico, esta también mostró mejores resultados clínicos que la ICP guiada por angiografía7. Nuestro estudio específico de pacientes con IAM con implante de SFA de segunda generación y alto riesgo isquémico incluyó otros factores relacionados con la intervención y los pacientes respecto a otros estudios sobre alto riesgo isquémico15–17. En el presente estudio, el alto riesgo isquémico de los pacientes con IAM a quienes se les implantó un SFA de segunda generación guiado por IVUS mostró mejores resultados clínicos en la muerte por cualquier causa, cualquier IM y todos los elementos personales de FLD. Sin embargo, este beneficio clínico no se observó en pacientes con IAM que no tenían un alto riesgo isquémico.
Hay varias explicaciones posibles del resultado de este estudio sobre el hecho de que la ICP guiada por IVUS mejoró los objetivos duros, como la muerte y el IM, solo en pacientes con IAM con alto riesgo isquémico. Entre 2012 y 2015, el uso de la IVUS en situaciones de IAM aumentó del 17,5 al 23,5% en estos registros27, más del doble que en EE. UU.28, de modo que los cirujanos adquirieron mayores niveles de experiencia con la ICP guiada por IVUS, y el perfil mejorado del stent de la segunda generación de SFA les permitió realizar una ICP más compleja con más optimización del stent que en la época de los SFA de primera generación. Además, de forma similar a un estudio previo6,7,13, el presente estudio también mostró que los pacientes tratados con ICP guiada por IVUS tenían un mayor número y diámetro, y mayor longitud de los stents que aquellos tratados con ICP guiada por angiografía. Se cree que la ICP guiada por IVUS fue útil en la cobertura completa de la lesión, la optimización del stent con posdilatación con balón no distensible y la corrección de las complicaciones de la intervención incluso en situaciones de IAM de alto riesgo isquémico. Sin embargo, este beneficio de la IVUS no se observó en pacientes con IAM que no tenían un alto riesgo isquémico. El desarrollo del perfil del stent y los medicamentos podría haber generado el bajo nivel de eventos isquémicos con o sin ICP guiada por IVUS, a pesar de las situaciones de IAM sin alto riesgo isquémico. Este resultado debe confirmarse mediante ensayos de distribución aleatoria de pacientes con IAM con y sin alto riesgo isquémico a quienes se les implantó un SFA de segunda generación.
Un análisis de cuartiles por la proporción de ICP guiadas por IVUS por centros mostró que el centro con la mayor proporción presentó mejores resultados clínicos en pacientes de alto riesgo isquémico. Un estudio previo mostró que la variabilidad terapéutica entre regiones condujo a diferencias importantes en los resultados clínicos de pacientes con IAM29,30. También se cree que, cuanto más familiarizados estén los cirujanos con la ICP guiada por IVUS en pacientes de alto riesgo isquémico, mejor podrán implantar SFA con una cobertura más completa de la lesión y optimización del stent, y administrar los antiagregantes plaquetarios personalizados adecuados en función de los resultados con la IVUS.
En el análisis de subgrupos, el beneficio de la ICP guiada por IVUS coincidió en varios factores isquémicos. Curiosamente, el beneficio clínico del uso de la IVUS demostró ser más predominante en pacientes con IAM con ERC que en aquellos sin ERC. Los datos recientes del registro de IAM también mostraron que los beneficios de la ICP guiada por IVUS fueron mayores en pacientes con ERC6. Los pacientes con ERC tienen más probabilidades de correr mayor riesgo de lesiones largas, enfermedad multivaso y calcificación asociada con la mortalidad periprocedimiento y a largo plazo31. Un estudio de subgrupos del ensayo Intravascular Ultrasound Guided Drug Eluting Stents Implantation in All-Comers Coronary Lesions mostró el beneficio del uso de la IVUS en el fracaso del vaso diana en el contexto de la ERC en comparación con el uso de ICP guiada por angiografía10. La ICP guiada por IVUS podría haber llevado a la selección de un tamaño del stent/balón mayor y a la realización más frecuente de la posdilatación con dilatación con balón no distensible, y podría haber contribuido a una mayor área mínima del stent con la optimización del stent; se cree que estos factores tienen un mayor beneficio en pacientes con ERC con características de riesgo isquémico complejo y alto32–34. Por tanto, nuestro análisis de subgrupos sugirió que el uso de la IVUS para la optimización del stent durante la ICP en pacientes con IAM con insuficiencia renal debe considerarse más firmemente, aunque se necesitan más estudios de distribución aleatoria para establecer los beneficios de la ICP guiada por IVUS en pacientes con IAM y ERC.
LimitacionesEste estudio tiene algunas limitaciones. En primer lugar, tiene las limitaciones inherentes a los datos de los registros observacionales no aleatorizados, que inevitablemente tienen sesgos de selección e información. Sin embargo, se realizaron varios análisis de sensibilidad para ajustar los factores de confusión medidos o no medidos de diferentes factores de confusión en la medida de lo posible. En segundo lugar, el estudio actual excluyó la ICP de oclusión total crónica o bifurcación, o de lesiones muy calcificadas, porque esas lesiones son raras en pacientes con IAM y esos factores no pudieron identificarse en los datos del registro. En tercer lugar, puesto que la selección y el uso de la IVUS se hicieron a criterio del cirujano, no se llegó a saber el motivo exacto del uso de la IVUS a partir de este registro. Por tanto, la experiencia personal de cada cirujano podría haber afectado al uso de la IVUS y a los resultados clínicos. En cuarto lugar, no hubo datos detallados de la intervención, como la posdilatación con balón no distensible después de la colocación del stent. Además, la programación previa o posterior del uso de la IVUS y los parámetros detallados de la IVUS no se recopilaron en este registro durante la ICP. En quinto lugar, sin criterios específicos para la ICP guiada por IVUS, es probable que la optimización del stent haya subestimado los efectos beneficiosos observados con el uso de la IVUS en este registro. En sexto lugar, es posible que el beneficio del uso de la IVUS en pacientes con ERC se debiera a la complejidad de la lesión en lugar de a la función renal en sí, y también es posible que el uso de un menor contraste en pacientes con ERC afectara al beneficio de la IVUS; sin embargo, no se dispone de información sobre la cantidad de contraste. Para superar estas limitaciones, se necesitarán ensayos clínicos de distribución aleatoria para demostrar que la IVUS es beneficiosa en pacientes con IAM de alto riesgo.
CONCLUSIONESEn este registro multicéntrico de nivel nacional, la ICP guiada por IVUS en pacientes con IAM de alto riesgo isquémico que recibieron un implante de SFA de segunda generación se asoció con un menor riesgo de FLD a 3 años, impulsado por muerte cardiaca, IM-VD y RLD-I, aunque la ICP guiada por IVUS no mostró beneficios en pacientes con IAM sin alto riesgo isquémico.
FINANCIACIÓNEste trabajo fue financiado por los Research of Korea Centers for Disease Control and Prevention (2016-ER6304-02).
CONTRIBUCIÓN DE LOS AUTORESConcepción del diseño de la obra: Y. Kim, M.H. Jeong, J.W. Roh. Adquisición: Y. Kim, M.H. Jeong, J.W. Roh, S. Bae. Análisis: Y. Kim, M.H. Jeong, J.W. Roh, S. Bae. Interpretación, redacción y revisión del original, y aprobación final: Y. Kim, M.H. Jeong, J.W. Roh, S. Bae, T.W. Johnson, D.K. Cho, J.S. Kim, B.K. Kim, D. Choi, M.K. Hong, Y. Jang.
CONFLICTO DE INTERESEST.W. Johnson ha recibido honorarios de asesoría y como conferenciante de Boston Scientific. El resto de los autores no tienen conflictos de interés que declarar. Y. Kim, M.H. Jeong, J.W. Roh, S. Bae, T.W. Johnson, D.K. Cho, J.S. Kim, B.K. Kim, D. Choi, M.K. Hong e Y. Jang se comprometen a asumir toda la responsabilidad por todos los aspectos del trabajo al garantizar que las cuestiones relacionadas con la precisión o integridad de cualquier parte del trabajo se han investigado y se han resuelto de manera adecuada.
- •
Aunque no hay un ensayo clínico de distribución aleatoria sobre el tema, la ICP guiada por IVUS mejora el resultado clínico de pacientes con IAM.
- •
El uso de la ICP en pacientes de alto riesgo isquémico ha aumentado y la ICP guiada por IVUS en estos pacientes con IAM ha demostrado el beneficio clínico de reducir el FLD, como la muerte cardiaca, el infarto de miocardio del vaso diana y la revascularización de la lesión diana por isquemia. Parece que esta tendencia es más beneficiosa en centros institucionales con un alto volumen de IVUS y pacientes con ERC.