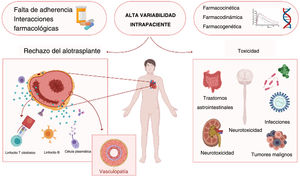
El trasplante cardiaco (TxC) sigue siendo el tratamiento de elección para la insuficiencia cardiaca avanzada y otras enfermedades terminales1. Aunque el éxito del TxC depende en gran parte de una cuidadosa selección de receptor y donante, los resultados a largo plazo también dependen de conseguir un equilibrio excelente de la inmunosupresión. Aunque la supervivencia a corto plazo ha mejorado en los últimos años gracias a los avances tanto en los procedimientos quirúrgicos como en los cuidados posoperatorios, no se ha visto una mejoría equivalente en la supervivencia a largo plazo2. En el aspecto del injerto, los motivos de dicha estaticidad son diversos, aunque destacan los episodios de rechazo agudo clínico e incluso asintomático y la vasculopatía coronaria como los mecanismos más comunes que conducen a la disfunción crónica del injerto. Además, los efectos secundarios de la inmunodepresión y la toxicidad de los fármacos inmunomoduladores son cruciales para la supervivencia del paciente en general, independientemente de la viabilidad del órgano trasplantado (figura 1).
El tratamiento actual del trasplante de órganos sólidos (TOS) se centra en bloquear la respuesta tanto directa como indirecta de los linfocitos T combinando distintos fármacos inmunomoduladores con distintos mecanismos de acción3. En concreto, cuando el receptor presente en la membrana de los linfocitos T reconoce los aloantígenos, se desencadena una cascada de reacciones en la que participan varias enzimas, en especial la calcineurina. Esto, junto con otras proteínas, estimula la formación de interleucina 2, el principal activador autocrino de los linfocitos T4. La introducción de inhibidores de la calcineurina (ICN) tales como la ciclosporina (Cs) y el tacrolimus (TAC) ha mejorado considerablemente la supervivencia del injerto y del receptor, y actualmente se consideran la piedra angular del tratamiento inmunodepresor en el TxC. El enfoque actual del TOS consiste en combinar un ICN, habitualmente TAC, con otros inmunomoduladores adyuvantes, como los fármacos antiproliferativos (micofenolato mofetilo), los inhibidores de mTOR (everolimus y sirolimus) o la azatioprina y los esteroides, ya que, al actuar contra distintas dianas, promueven un efecto terapéutico aditivo.
Los fármacos inmunosupresores se consideran «medicamentos de alto riesgo» debido a su estrecho margen terapéutico, la relación entre su concentración y su efecto y la elevada variabilidad de la concentración sanguínea, por lo que requieren un control terapéutico minucioso. La subexposición puede llevar al riesgo de rechazo del trasplante, mientras que la sobreexposición se relaciona con riesgo de efectos adversos tales como nefrotoxicidad, neurotoxicidad, neoplasias e infecciones. La complejidad es tal que dosis idénticas de ICN pueden dar lugar a exposiciones sanguíneas distintas y, en consecuencia, a efectos diversos entre pacientes; en una misma persona, dosis idénticas pueden dar lugar a concentraciones sanguíneas distintas. Estas fluctuaciones constantes de la concentración sanguínea del fármaco constituyen una dificultad importante a la hora de asegurar una concentración plasmática terapéutica en equilibrio estacionario. Para un control terapéutico preciso de los fármacos inmunomoduladores, el área bajo la curva (AUC) de 24 horas —que representa cómo la concentración sanguínea cambia con el tiempo— se considera el marcador farmacocinético más representativo de la exposición del fármaco en sangre y de su efecto clínico. No obstante, en la mayoría de los centros de trasplantes se utiliza la monitorización de la concentración valle (C0) y la AUC se relega al ámbito de la investigación, ya que se trata de un proceso que requiere más tiempo y recursos. La determinación de la C0, a pesar de ser práctico y accesible, es un proceso impreciso, ya que una misma dosis farmacológica en un mismo paciente genera grandes fluctuaciones de la concentración (variabilidad intrapaciente [VIP]). De hecho, en varios estudios se ha demostrado una correlación negativa entre una gran VIP y eventos adversos en pacientes trasplantados, por lo que el control de las causas de dicha variabilidad se considera una buena oportunidad para mejorar los resultados5,6.
La causa más importante de VIP es la falta de adherencia al tratamiento. No obstante, la concentración sanguínea también se ve afectada por múltiples factores, como la edad, la etnia, los polimorfismos genéticos, las funciones hepática y renal, el metabolismo presistémico y las interacciones farmacológicas o con plantas medicinales o alimentos que influyen en la farmacocinética, la farmacodinámica y la farmacogenética del fármaco5,7,8. Aunque todavía se desconoce el mecanismo exacto mediante el cual los cambios en la exposición a un inmunodepresor que tienen lugar en un sujeto influyen en la integridad del injerto, una elevada VIP en las concentraciones de TAC se ha relacionado con eventos adversos en forma de episodios de rechazo agudo y crónico, aparición de anticuerpos anti-HLA (complejo principal de histocompatibilidad) específicos del donante y una progresiva afección fibrótica del trasplante8–11. La evaluación sistemática de estas fluctuaciones utilizando la VIP por medio del análisis periódico de la concentración sanguínea puede ser un biomarcador útil para un control minucioso de los pacientes con TxC8.
En este sentido, el trabajo publicado recientemente en Revista Española de Cardiología por González-Vílchez et al.12 contribuye de manera significativa a evaluar el impacto de la VIP de los ICN en los receptores de TxC. Con el Registro Español de Trasplante Cardiaco —una base de datos multicéntrica y nacional que contiene información de los donantes y los receptores de un TxC desde 1984—, los autores realizaron un estudio observacional, longitudinal y retrospectivo para examinar el impacto clínico de la variabilidad de los ICN en los resultados de los pacientes sometidos a TxC. Hasta la fecha, posiblemente esta sea el mayor estudio con estas características y el primero que compara el impacto de la variabilidad en cada ICN. Según el registro, entre los años 2000 y 2014 se realizaron en total 3.387 TxC, de los cuales 1.581 recibieron TAC de liberación inmediata (33,3%), TAC de liberación prolongada (16,7%) o Cs (50%) y se realizaron por lo menos 3 mediciones de la C0 durante el primer año después del TxC. Entre el cuarto y el duodécimo mes después del TxC, se utilizó la mediana de las concentraciones sanguíneas mínimas de los ICN y la mediana de la concentración de aquellas mediciones para calcular un coeficiente de variación (CV) de la siguiente forma: desviación estándar de la concentración mínima de los ICN) / (mediana)×100. Se dividió a los pacientes en 2 grupos, CV alto y bajo, conforme a la VIP media de los ICN durante el primer año: 27,8%. Los resultados a largo plazo relacionados con la supervivencia de los pacientes y el rechazo o pérdida del trasplante se evaluaron según esta dicotomía.
Los principales hallazgos de González-Vílchez et al.12 fueron: en primer lugar, que en los pacientes del grupo con un CV alto se observó una tendencia hacia un mayor riesgo del evento combinado rechazo o mortalidad/pérdida del injerto o rechazo del trasplante o rechazo y mortalidad por cualquier causa/pérdida del trasplante pasados 1-5 años (intervalo de confianza del 95% [IC95%], 0,993-1,695; p=0,056). En segundo lugar, en los pacientes tratados con TAC se observó un CV menor que en los tratados con Cs. Tercero, entre las 2 formas farmacéuticas del TAC evaluadas, la de liberación prolongada se relacionó con un CV menor. Por último, en los subanálisis realizados al subgrupo de pacientes sin antecedentes de rechazo durante el primer año (n=967), se observó que los pacientes con CV alto presentaron un riesgo significativamente mayor de la combinación rechazo, pérdida del trasplante y mortalidad a los 5 años (hazard ratio [HR]=1,609; IC95%, 1,129-2,295; p=0,011). A pesar de la ausencia de significación estadística en algunas de las cuestiones evaluadas, los datos generales de este estudio coinciden con datos anteriormente publicados en TOS9,11,13. Por ejemplo, en receptores recientes de trasplante renal, una gran VIP de TAC al inicio se relacionó con la aparición de anticuerpos específicos del donante5,14 y con un mayor riesgo de rechazo del injerto. Como los autores argumentan en la discusión, esto podría explicarse por la falta de potencia estadística debido a un número relativamente reducido de eventos adversos (138 muertes y 4 retrasplantes por pérdida del trasplante).
Como ya se ha mencionado, son varios los factores implicados en la VIP, y aunque el incumplimiento terapéutico de la pauta posológica de fármacos inmunosupresores siempre se ha considerado la causa más importante15 hasta la fecha, aunque no se han proporcionado pruebas fehacientes. En efecto, Ko et al.16 no han podido demostrar ninguna relación clara entre el incumplimiento terapéutico de los ICN y una mayor VIP. Sin embargo, en el presente estudio, González-Vílchez et al.12 han mostrado que la CV fue menor con el TAC de liberación prolongada, posiblemente por una posología más sencilla que permite un mejor cumplimiento terapéutico. Además, las formas farmacéuticas del TAC de liberación prolongada pueden minimizar las fluctuaciones de la C0 y generar una curva de concentraciones sanguíneas más estable17. Por otro lado, un tema candente en el TOS es la aparición de los preparados genéricos de fármacos inmunomoduladores, lo que constituye un problema importante para los profesionales sanitarios pues, aunque se consideran alternativas bioequivalentes, hay diferencias entre los efectos farmacocinéticos del fármaco innovador y el genérico, y entre las distintas formas farmacéuticas genéricas18. Estas diferencias importantes se relacionan con un aumento de la VIP y podrían resultar en un incremento de los eventos adversos. Así pues, cualquier cambio de un fármaco de marca a otro genérico o entre genéricos debe hacerse tras evaluar cuidadosamente al paciente y con un control minucioso de la exposición al fármaco y de las instrucciones apropiadas que recibe el paciente.
Las complejas interacciones involucradas en el tratamiento de la inmunosupresión requieren un esfuerzo importante con un enfoque multidisciplinario para comprender en profundidad los efectos de doble cara de los inmunomoduladores. La medición de la VIP permite a los facultativos identificar de manera precoz a los pacientes en riesgo y optimizar su tratamiento y su seguimiento para equilibrar el efecto terapéutico y los efectos adversos de los fármacos, aunque esto requiera un esfuerzo adicional de su parte. Entre las alternativas posibles al control terapéutico estándar, la evaluación del cociente entre 2 mediciones consecutivas de la C0 puede ser útil para determinar fácilmente la VIP y su impacto en la supervivencia del trasplante6,19. Iniciativas como la de González-Vílchez et al.12 son cruciales para destacar la importancia de la VIP en el tratamiento de los pacientes con TxC. Si se tienen en cuenta los datos acumulados hasta ahora, la comunidad médica involucrada en el TOS debería insistir en la importancia del estrecho control terapéutico y el análisis de los factores que intervienen en la variabilidad de la concentración sanguínea de los inmunomoduladores. La propuesta de que exista una dosis universal que sirva para todo el mundo es imprecisa y arcaica, la aparición de la nueva medicina de precisión en lo que respecta a la farmacogenética, los biomarcadores, los análisis de datos masivos, dispositivos específicos, inteligencia artificial y la Internet de las cosas constituye una gran oportunidad para crear nuevas herramientas para un seguimiento fácil, estrecho y centrado en el paciente, que asegure la viabilidad del trasplante y una mejora de la supervivencia y la calidad de vida del paciente.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESNinguno.