El envejecimiento de la población se asocia con una prevalencia creciente de fibrilación auricular (FA) y demencia. Con este estudio se pretende analizar el impacto de la anticoagulación oral en pacientes ancianos con FA y demencia de grado moderado-grave.
MétodosEstudio retrospectivo unicéntrico que analiza a pacientes de edad ≥ 85 años con diagnóstico de FA entre 2013 y 2018. El impacto de la anticoagulación en la mortalidad, las embolias y las hemorragias se evaluó mediante un análisis multivariado de Cox. En los pacientes con demencia, dicho análisis se complementó con un propensity score matching en función de que se les prescribiera tratamiento anticoagulante o no.
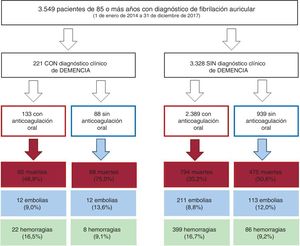
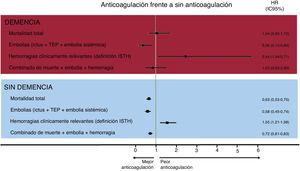
ResultadosDe los 3.549 pacientes de 85 o más años con FA, 221 presentaban demencia de grado moderado-grave (6,1%), de los que 88 (60,2%) fueron anticoagulados. Durante un seguimiento de 2,8 ±1,7 años, la anticoagulación se asoció con menor riesgo embólico y mayor riesgo hemorrágico tanto en pacientes con demencia (HRembolias=0,36; IC95%, 0,15-0,84; HRhemorragias=2,44; IC95%, 1,04-5,71) como sin demencia (HRembolias=0,58; IC95%, 0,45-0,74; HRhemorragias=1,55; IC95%, 1,21-1,98). Sin embargo, la anticoagulación únicamente se asoció con menor mortalidad en los pacientes sin demencia (HR=0,63; IC95%, 0,53-0,75), no en pacientes con demencia (HR ajustada=1,04; IC95%, 0,63-1,72; p=0,541; HR después de propensity score matching=0,91; IC95%, 0,45-1,83; p=0,785).
ConclusionesEn pacientes de 85 o más años con demencia moderada-grave y FA, la anticoagulación oral se asoció de manera significativa con menor riesgo de embolias y mayor riesgo hemorrágico, sin encontrarse diferencias en cuanto a mortalidad total.
Palabras clave
El creciente envejecimiento de la población ha supuesto un incremento en la prevalencia de enfermedades crónicas, caso de la fibrilación auricular (FA) y de la demencia1. En pacientes de edad ≥ 85 años, la prevalencia estimada de FA es del 15%2, y la de demencia, del 20%3. No es infrecuente encontrar en pacientes ancianos la coexistencia de ambas enfermedades (FA y demencia). Así se estima que entre el 3 y el 5% de los pacientes con FA tienen diagnosticada una demencia4, y ese porcentaje se aproxima al 10% en los pacientes octagenarios5. Aplicando estos datos a la población española, se puede estimar que actualmente hay en España unos 40.000 octogenarios con FA y demencia, y para 2050 se estiman cifras superiores a 100.000 pacientes1.
La importancia de este subgrupo poblacional (ancianos con FA y demencia) no radica únicamente en la magnitud de su prevalencia creciente, sino en su tratamiento6,7. La anticoagulación se ha asociado con una reducción significativa del riesgo de eventos embólicos en pacientes con FA, también los pacientes ancianos. Sin embargo, los pacientes con demencia, sobre todo en sus estadios avanzados, están infrarrepresentados en los ensayos clínicos que evaluaron la anticoagulación. Con este estudio se pretende analizar el impacto pronóstico de la terapia anticoagulante en pacientes ancianos (edad ≥ 85 años) con FA y demencia.
MÉTODOSPoblación de estudioSe analizó a los pacientes procedentes del registro de Cardiología del Complejo Hospitalario de Vigo centrado en Fibrilación Auricular (CardioCHUVI-FA). Se trata de un registro retrospectivo que incluyó a todos los pacientes con diagnóstico de FA procedentes del área sanitaria de Vigo entre el 1 de enero de 2014 y el 1 de enero de 2018. Para la elaboración de dicho registro, inicialmente se procedió a la identificación de los pacientes empleando bases de datos administrativas tanto hospitalarias como ambulatorias. Para ello se recurrió a los sistemas de información de análisis complejo del Servicio Gallego de Salud tanto de atención primaria como de asistencia hospitalaria, utilizando los códigos 427.31 de la novena edición de la Clasificación Internacional de Enfermedades y K78 de la Clasificación Internacional de Atención Primaria. Del total de 16.975 pacientes identificados, se seleccionó el subgrupo de pacientes de edad ≥ 85 años. Posteriormente, en una segunda fase, se revisó la historia clínica de cada paciente, con vistas a confirmar el diagnóstico de FA (documentado mediante electrocardiograma) y con la intención de recoger datos sobre las variables clínicas basales, estrategia terapéutica y eventos en el seguimiento.
Se excluyó a los pacientes con prótesis mecánicas y estenosis mitral moderada-grave. También se excluyó a los pacientes que recibían tratamiento crónico con heparinas de bajo peso molecular.
De las variables analizadas, hubo menos de un 2% de valores perdidos para cada variable (n<70), por lo que se decidió no realizar ningún método específico de ajuste por la presencia de estos valores perdidos.
El estudio se ha desarrollado de acuerdo con los principios de la Declaración de Helsinki y fue aprobado por el Comité Ético Autonómico de Investigación de Galicia (código HAC-ACO-2018-01, registro 2018/258).
Objetivos y seguimientoEl objetivo clínico principal de este estudio es la mortalidad total. Como objetivos secundarios se han analizado los eventos embólicos y hemorrágicos. Como eventos embólicos se han considerado los accidentes cerebrovasculares (ictus isquémico y accidente isquémico transitorio), la tromboembolia pulmonar y la embolia periférica. Como eventos hemorrágicos, se han considerado las hemorragias clínicamente relevantes según la definición de la International Society on Thrombosis and Haemostasis8,9. La finalización del seguimiento para cada uno de los pacientes se produjo en el momento de su fallecimiento o en la última fecha en que se tuvo constancia de su estado vital. La decisión de anticoagular o no para cada uno de los pacientes se estableció en función del criterio clínico del médico responsable del paciente. Los pacientes que han experimentado cambios de tratamiento (de sin anticoagulación a anticoagulación oral o viceversa) se han considerado en el estudio dentro de cada grupo de tratamiento mientras lo estuvieron recibiendo, por lo que la variable anticoagulación oral resulta dependiente del tiempo.
DefinicionesEn nuestro estudio se analiza únicamente a los pacientes de 85 o más años con diagnóstico de «FA no valvular» según las recomendaciones europeas, por lo que no se considera a los pacientes con prótesis mecánicas y estenosis mitral con área ≤ 1,5cm2. Los pacientes fueron clasificados en 2 grupos: con y sin demencia moderada-grave, considerando como tales a los pacientes con deterioro cognitivo entre los estadios 5 y 7 de la escala de deterioro cognitivo global de Reisberg10, que a su vez correspondían con estadios de la escala Functional Assessment Staging ≥ 511. Así pues, no se consideraron los casos de deterioro cognitivo leve ni demencia incipiente/leve, etapa en la que los pacientes desarrollan amnesia pero son funcionalmente autónomos para las actividades de la vida diaria. El diagnóstico de infarto isquémico se confirmó con estudios de imagen concomitantes, incluidas la tomografía computarizada o la resonancia magnética. Se definió como accidente isquémico transitorio el episodio transitorio de disfunción neurológica causada por una focalidad en el cerebro, la médula espinal o isquemia retiniana, sin lesión de infarto agudo. Las hemorragias se definieron según la clasificación de la International Society on Thrombosis and Haemostasis, y se consideró evento las hemorragias clínicamente relevantes (tanto mayores como menores)8,9.
Análisis estadísticoLas variables continuas se expresan como media ±desviación típica y se compararon con el test de la t de Student. Las variables categóricas se expresan como porcentajes y se compararon con el test de la χ2. El impacto de la anticoagulación oral en la mortalidad, las embolias y las hemorragias se evaluó mediante análisis de regresión de Cox con estimación robusta de la varianza, y la la variable anticoagulación oral resulta dependiente del tiempo. En dichos análisis se ajustó por las variables que se habían asociado con eventos en el análisis univariado () o cuya asociación con los eventos clínicos se había demostrado previamente de forma consistente. Así, los análisis multivariados fueron ajustados por: edad, sexo, hipertensión arterial, diabetes mellitus, historia de cardiopatía isquémica, insuficiencia cardiaca, ictus previos, enfermedad pulmonar obstructiva crónica, ingreso previo por hemorragia, anemia, filtrado glomerular según la ecuación CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration), fracción de eyección del ventrículo izquierdo ≤ 40%, puntuaciones de las escalas CHA2DS2-VASc y HAS-BLED, tratamiento con antiagregantes plaquetarios, bloqueadores beta, digoxina, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II, estatinas e inhibidores de la bomba de protones. La asunción de riesgos proporcionales se probó utilizando el test residual de Schoenfeld. Los resultados se expresaron como hazard ratio (HR), con sus intervalos de confianza del 95% (IC95%). Se consideraron significativos los resultados con valor de p<0,05. Gráficamente, los resultados se expresaron en forma de curvas de Kaplan Meier.
Asimismo, dentro del grupo de pacientes con demencia, los análisis se complementaron con un propensity score matching, con vistas a igualar las características basales de los pacientes con y sin anticoagulación. Para dicho análisis se utilizó un protocolo 1:1 sin reemplazo, con caliper 0,2 para desviaciones estándar y con el método de emparejamiento nearest neighbour. Las variables independientes para la obtención del propensity score fueron: edad, sexo, hipertensión arterial, diabetes mellitus, cardiopatía isquémica, ictus o embolia previa, insuficiencia cardiaca previa o fracción de eyección del ventrículo izquierdo ≤ 40%, antecedente de hemorragias, anemia, CKD-EPI<60ml/min/1,73 m2, puntuación de la escala CHA2DS2-VASc, puntuación de la escala HAS-BLED, tratamiento antiagregante, terapia con bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina o antagonistas del receptor de la angiotensina II, digoxina, estatinas e inhibidores de la bomba de protones. Los análisis estadísticos se realizaron con los programas informáticos SPSS versión 25.0 y Stata MP64 versión 15.0.
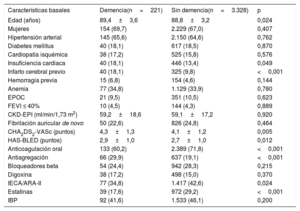
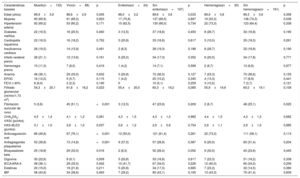
RESULTADOSCaracterísticas basalesSe identificó a 3.595 pacientes de edad ≥ 85 años con diagnóstico confirmado de FA. De ellos se excluyó a aquellos con prótesis mecánicas y estenosis mitral moderada-grave (n=10) o que recibían tratamiento crónico con heparinas de bajo peso molecular (n=36). Por lo tanto, la población final del estudio estaba constituida por 3.549 pacientes (figura 1), de los que 2.382 eran mujeres; la edad media del grupo era 88,9±3,2 años. De esos pacientes, 221 tenían demencia de grado moderado-grave (6,2%). El 68,3% de los casos de demencia fueron clasificados como enfermedad de Alzhéimer; el 20,8%, como demencia vascular; el 3,6%, como otras causas de demencia y el 7,2%, como demencia mixta degenerativa-vascular. En la tabla 1 se muestran las diferencias en las características basales entre los pacientes con y sin demencia. Los pacientes con demencia eran más mayores, con tasas más altas de historia de insuficiencia cardiaca e ictus isquémico previo, y con mayor puntuación en las puntaciones CHA2DS2-VASc y HAS-BLED.
Diferencias en las características basales, analíticas y ecocardiográficas en el tratamiento médico entre pacientes de edad ≥ 85 años con y sin demencia
| Características basales | Demencia(n=221) | Sin demencia(n=3.328) | p |
|---|---|---|---|
| Edad (años) | 89,4±3,6 | 88,8±3,2 | 0,024 |
| Mujeres | 154 (69,7) | 2.229 (67,0) | 0,407 |
| Hipertensión arterial | 145 (65,6) | 2.150 (64,6) | 0,762 |
| Diabetes mellitus | 40 (18,1) | 617 (18,5) | 0,870 |
| Cardiopatía isquémica | 38 (17,2) | 525 (15,8) | 0,576 |
| Insuficiencia cardiaca | 40 (18,1) | 446 (13,4) | 0,049 |
| Infarto cerebral previo | 40 (18,1) | 325 (9,8) | <0,001 |
| Hemorragia previa | 15 (6,8) | 154 (4,6) | 0,144 |
| Anemia | 77 (34,8) | 1.129 (33,9) | 0,780 |
| EPOC | 21 (9,5) | 351 (10,5) | 0,623 |
| FEVI ≤ 40% | 10 (4,5) | 144 (4,3) | 0,889 |
| CKD-EPI (ml/min/1,73 m2) | 59,2±18,6 | 59,1±17,2 | 0,920 |
| Fibrilación auricular de novo | 50 (22,6) | 826 (24,8) | 0,464 |
| CHA2DS2-VASc (puntos) | 4,3±1,3 | 4,1±1,2 | 0,005 |
| HAS-BLED (puntos) | 2,9±1,0 | 2,7±1,0 | 0,012 |
| Anticoagulación oral | 133 (60,2) | 2.389 (71,8) | <0,001 |
| Antiagregación | 66 (29,9) | 637 (19,1) | <0,001 |
| Bloqueadores beta | 54 (24,4) | 942 (28,3) | 0,215 |
| Digoxina | 38 (17,2) | 498 (15,0) | 0,370 |
| IECA/ARA-II | 77 (34,8) | 1.417 (42,6) | 0,024 |
| Estatinas | 39 (17,6) | 972 (29,2) | <0,001 |
| IBP | 92 (41,6) | 1.533 (46,1) | 0,200 |
ARA-II: antagonistas del receptor de la angiotensina II; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad mayor 65 años y toma concomitante de fármacos o alcohol; IBP: inhibidores de la bomba de protones; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
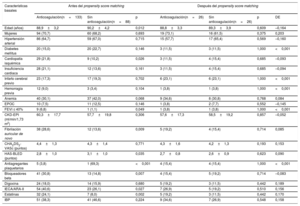
De los 3.549 pacientes, 2.522 (71,1%) recibieron tratamiento anticoagulante (figura 1). Los pacientes con demencia recibían menos anticoagulación oral que los pacientes sin demencia (el 60,2 frente al 71,8%; p<0,001). El tipo de anticoagulante oral más empleado fueron los antagonistas de la vitamina K (AVK) (el 75,9 y el 79,6% de los pacientes con y sin demencia respectivamente; p=0,598), con un tiempo en rango terapéutico que fue similar en ambos grupos (> 60%; el 45,5 frente al 46,3%; p=0,883). En la tabla 2 se especifican las características basales de los pacientes con demencia en función de si recibieron tratamiento anticoagulante o no.
Características basales, analíticas, ecocardiográficas y del tratamiento médico de los pacientes de edad ≥ 85 años con demencia tratados con y sin anticoagulación. Resultados antes y después del emparejamiento por puntuación de propensión
| Características basales | Antes del propensity score matching | Después del propensity score matching | |||||
|---|---|---|---|---|---|---|---|
| Anticoagulación(n=133) | Sin anticoagulación(n=88) | p | Anticoagulación(n=26) | Sin anticoagulación(n=26) | p | DE | |
| Edad (años) | 88,9±3,2 | 90,2±4,2 | 0,012 | 88,8±3,3 | 89,3±3,9 | 0,609 | –0,164 |
| Mujeres | 94 (70,7) | 60 (68,2) | 0,693 | 19 (73,1) | 16 (61,5) | 0,375 | 0,203 |
| Hipertensión arterial | 86 (64,7) | 59 (67,0) | 0,715 | 15 (57,7) | 17 (65,4) | 0,569 | –0,160 |
| Diabetes mellitus | 20 (15,0) | 20 (22,7) | 0,146 | 3 (11,5) | 3 (11,5) | 1,000 | <0,001 |
| Cardiopatía isquémica | 29 (21,8) | 9 (10,2) | 0,026 | 3 (11,5) | 4 (15,4) | 0,685 | –0,093 |
| Insuficiencia cardiaca | 28 (21,1) | 12 (13,6) | 0,161 | 3 (11,5) | 4 (15,4) | 0,685 | –0,094 |
| Infarto cerebral previo | 23 (17,3) | 17 (19,3) | 0,702 | 6 (23,1) | 6 (23,1) | 1,000 | <0,001 |
| Hemorragia previa | 12 (9,0) | 3 (3,4) | 0,104 | 1 (3,8) | 1 (3,8) | 1,000 | <0,001 |
| Anemia | 40 (30,1) | 37 (42,0) | 0,068 | 9 (34,6) | 8 (30,8) | 0,768 | 0,084 |
| EPOC | 10 (7,5) | 11 (12,5) | 0,146 | 1 (3,8) | 2 (7,7) | 0,552 | –0,145 |
| FEVI ≤ 40% | 9 (6,8) | 1 (1,1) | 0,049 | 1 (3,8) | 1 (3,8) | 1,000 | <0,001 |
| CKD-EPI (ml/min/1,73 m2) | 60,3±17,7 | 57,7±19,8 | 0,306 | 57,6±17,3 | 58,5±19,2 | 0,857 | –0,052 |
| Fibrilación auricular de novo | 38 (28,6) | 12 (13,6) | 0,009 | 5 (19,2) | 4 (15,4) | 0,714 | 0,085 |
| CHA2DS2-VASc (puntos) | 4,4±1,3 | 4,3±1,4 | 0,771 | 4,3±1,6 | 4,2±1,3 | 0,193 | 0,153 |
| HAS-BLED (puntos) | 2,8±1,0 | 3,1±1,0 | 0,035 | 2,7±0,8 | 2,6±0,9 | 0,623 | 0,090 |
| Antiagregantes plaquetarios | 5 (3,8) | 1 (69,3) | <0,001 | 4 (15,4) | 4 (15,4) | 1,000 | <0,001 |
| Bloqueadores beta | 41 (30,8) | 13 (14,8) | 0,007 | 4 (15,4) | 5 (19,2) | 0,714 | –0,083 |
| Digoxina | 24 (18,0) | 14 (15,9) | 0,680 | 5 (19,2) | 3 (11,5) | 0,442 | 0,189 |
| IECA/ARA-II | 54 (40,6) | 23 (26,1) | 0,027 | 7 (26,9) | 5 (19,2) | 0,510 | 0,156 |
| Estatinas | 32 (24,1) | 7 (8,0) | 0,002 | 5 (19,2) | 3 (11,5) | 0,442 | 0,170 |
| IBP | 51 (38,3) | 41 (46,6) | 0,224 | 9 (34,6) | 7 (26,9) | 0,548 | 0,158 |
ARA-II: antagonistas del receptor de la angiotensina II; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad mayor 65 años y toma concomitante de fármacos o alcohol; IBP: inhibidores de la bomba de protones; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar (DE).
A lo largo del seguimiento, 29 pacientes (14,2%) con demencia presentaron cambios en el tratamiento antitrombótico (1 inició anticoagulación, 10 suspendieron anticoagulación, 18 cambiaron de AVK a anticoagulante de acción directa [ACOD] y 0 pacientes cambiaron de ACOD a AVK). El 41,4% de los cambios se debieron a mal control de la razón internacional normalizada en pacientes a tratamiento con AVK, el 20,7% por percepción de alto riesgo hemorrágico, el 10,3% por percepción de alto riesgo embólico y el 27,6% por motivos desconocidos. De los pacientes sin demencia, 471 (13,1%) cambiaron de tratamiento antitrombótico (16 iniciaron anticoagulación, 73 suspendieron anticoagulación, 381 cambiaron de AVK a ACOD y 1 cambió de ACOD a AVK). El 44,4% de los cambios se debieron a mal control de la razón internacional normalizada en pacientes a tratamiento con AVK, el 18,9% por percepción de alto riesgo hemorrágico, el 10,9% por percepción de alto riesgo embólico y el 25,9% por motivos desconocidos ().
Eventos en el seguimientoSe siguió a los pacientes durante 2,8±1,7 años (2,9±1,7 en el grupo de demencia, 2,4±1,6 en el grupo sin demencia). Los pacientes con demencia tenían una mayor mortalidad (incidencia anual, el 25,9 frente al 13,7%; p <0,001), pero similares tasas de eventos embólicos (incidencia anual, el 4,7 frente al 3,6%; p=0,219) y hemorrágicos (incidencia anual, el 5,6 frente al 5,3%; p=0,765) que los pacientes sin demencia. En la tabla 3 se especifican las características basales de los pacientes con demencia en función de los eventos que presentaron en el seguimiento (mortalidad, embolias y hemorragias). Asimismo en la se puede ver la localización de la hemorragia en función de que haya demencia o no y de si se prescribió tratamiento anticoagulante o no.
Diferencias en las características basales de los pacientes con demencia en función de los eventos (mortalidad, embolias y hemorragias)
| Características basales | Muerto(n=133) | Vivo(n=88) | p | Embolias(n=24) | Sin embolias(n=197) | p | Hemorragias(n=30) | Sin hemorragias(n=191) | p |
|---|---|---|---|---|---|---|---|---|---|
| Edad (años) | 89,9±3,9 | 88,6±2,9 | 0,005 | 88,0±3,2 | 89,6±3,6 | 0,033 | 89,9±3,8 | 89,3±3,6 | 0,358 |
| Mujeres | 93 (69,9) | 61 (69,3) | 0,923 | 17 (70,8) | 137 (69,5) | 0,897 | 16 (53,3) | 138 (74,3) | 0,036 |
| Hipertensión arterial | 92 (69,2) | 53 (60,2) | 0,171 | 15 (62,5) | 130 (66,0) | 0,734 | 22 (73,3) | 123 (64,4) | 0,338 |
| Diabetes mellitus | 22 (16,5) | 18 (20,5) | 0,460 | 3 (12,5) | 37 (18,8) | 0,450 | 8 (26,7) | 32 (16,8) | 0,190 |
| Cardiopatía isquémica | 22 (16,5) | 16 (18,2) | 0,752 | 5 (20,8) | 33 (16,8) | 0,617 | 3 (10,0) | 35 (18,3) | 0,261 |
| Insuficiencia cardiaca | 26 (19,5) | 14 (15,9) | 0,491 | 2 (8,3) | 38 (19,3) | 0,188 | 8 (26,7) | 32 (16,8) | 0,190 |
| Infarto cerebral previo | 28 (21,1) | 12 (13,6) | 0,161 | 6 (25,0) | 34 (17,3) | 0,352 | 6 (20,0) | 34 (17,8) | 0,771 |
| Hemorragia previa | 15 (11,3) | 7 (8,0) | 0,419 | 1 (4,2) | 14 (7,1) | 0,599 | 2 (6,7) | 13 (6,8) | 0,977 |
| Anemia | 48 (36,1) | 29 (33,0) | 0,632 | 5 (20,8) | 72 (36,5) | 0,127 | 7 (23,3) | 70 (36,6) | 0,155 |
| EPOC | 16 (12,0) | 5 (5,7) | 0,115 | 1 (4,2) | 20 (10,2) | 0,345 | 4 (13,3) | 17 (8,9) | 0,441 |
| FEVI ≤ 40% | 8 (6,0) | 2 (2,3) | 0,190 | 0 | 10 (5,1) | 0,259 | 3 (10,0) | 7 (3,7) | 0,121 |
| Filtrado glomerular (ml/min/1,73 m2) | 54,3±20,1 | 61,8±18,2 | 0,023 | 55,4±20,0 | 60,3±19,2 | 0,085 | 55,9±19,9 | 60,0±19,1 | 0,109 |
| Fibrilación auricular de novo | 5 (3,8) | 45 (51,1) | <0,001 | 3 (12,5) | 47 (23,9) | 0,209 | 2 (6,7) | 48 (25,1) | 0,025 |
| CHA2DS2-VASc (puntos) | 4,5±1,4 | 4,1±1,2 | 0,061 | 4,3±1,5 | 4,3±1,3 | 0,982 | 4,4±1,5 | 4,3±1,3 | 0,682 |
| HAS-BLED (puntos) | 3,1±1,0 | 2,8±1,0 | 0,037 | 2,8±1,2 | 2,9±0,9 | 0,754 | 2,9±1,1 | 2,9±1,0 | 0,985 |
| Anticoagulación oral | 66 (49,6) | 67 (76,1) | <0,001 | 12 (50,0) | 121 (61,4) | 0,281 | 22 (73,3) | 111 (58,1) | 0,113 |
| Antiagregantes plaquetarios | 53 (39,8) | 13 (14,8) | <0,001 | 9 (37,5) | 57 (28,9) | 0,387 | 6 (20,0) | 60 (31,4) | 0,204 |
| Bloqueadores beta | 25 (18,8) | 29 (33,0) | 0,016 | 2 (8,3) | 52 (26,4) | 0,052 | 9 (30,0) | 45 (23,6) | 0,445 |
| Digoxina | 30 (22,6) | 8 (9,1) | 0,009 | 5 (20,8) | 33 (16,8) | 0,617 | 7 (23,3) | 31 (16,2) | 0,338 |
| IECA/ARA-II | 48 (36,1) | 29 (33,0) | 0,402 | 10 (41,7) | 67 (34,0) | 0,226 | 12 (40,0) | 65 (34,0) | 0,256 |
| Estatinas | 20 (15,0) | 19 (21,6) | 0,211 | 5 (20,8) | 34 (17,3) | 0,665 | 7 (23,3) | 32 (14,5) | 0,380 |
| IBP | 58 (43,6) | 34 (38,6) | 0,463 | 7 (29,2) | 85 (43,1) | 0,190 | 13 (43,3) | 79 (41,4) | 0,839 |
ARA-II: antagonistas del receptor de la angiotensina II; CHA2DS2-VASc: insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75 años (doble), diabetes mellitus, ictus (doble), enfermedad vascular, edad 65-74 años y sexo (mujer); CKD-EPI: Chronic Kidney Disease Epidemiology Collaboration; EPOC: enfermedad pulmonar obstructiva crónica; FEVI: fracción de eyección del ventrículo izquierdo; HAS-BLED: hipertensión, función renal/hepática anormal, ictus, antecedentes de hemorragia o predisposición a ella, labilidad de la razón internacional normalizada, edad mayor 65 años y toma concomitante de fármacos o alcohol; IBP: inhibidores de la bomba de protones; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los valores expresan n (%) o media ± desviación estándar.
Tras el análisis multivariado, la anticoagulación oral no se asoció con menor mortalidad en los pacientes con demencia (HR=1,04; IC95%, 0,63-1,72; p=0,880), a diferencia de lo que ocurre en los pacientes sin demencia (figura 2). Sin embargo, en los pacientes con demencia la terapia anticoagulante sí se asoció con una reducción significativa en la tasa de eventos embólicos (HR=0,36; IC95%, 0,15-0,84; p=0,018), a costa de un aumento considerable del riesgo de eventos hemorrágicos (HR=2,44; IC95%, 1,04-5,71; p=0,041) (). Para los eventos combinados, el tratamiento anticoagulante no se asoció con tasas diferentes de mortalidad, eventos embólicos y hemorragia totales en los pacientes con demencia (HR ajustada=0,83; IC95%, 0,45-1,53; p=0,541).
Forest plot para la hazard ratio ajustada del tratamiento anticoagulante (frente a sin anticoagulación) para mortalidad, embolias y hemorragias. HR: hazard ratio; IC95%: intervalo de confianza del 95%; ISTH: International Society Thrombosis and Haemostasis; TEP: tromboembolia pulmonar.
De los 133 pacientes demenciados tratados inicialmente con anticoagulación, a 6 se les quitó la anticoagulación durante el seguimiento sin relación con ningún evento, y a 4 se les suspendió tras un evento hemorrágico (). Por su parte, de los 88 pacientes demenciados no anticoagulados inicialmente, a 1 se le inició anticoagulación durante el seguimiento sin relación con ningún evento embólico ni hemorrágico (). Se repitieron los análisis tras excluir a los 11 pacientes con cambios de tratamiento durante el seguimiento, y se obtuvieron resultados similares (HR ajustada por mortalidad=1,09; IC95%, 0,67-1,77; p=0,731; HR ajustada para embolias=0,43; IC95%, 0,21-0,95; p=0,033; HR ajustada por hemorragias=2,35; IC95%, 1,01-5,97; p=0,047).
Finalmente, los análisis se complementaron con un análisis con propensity score matching, emparejando a los pacientes demenciados en función del tratamiento anticoagulante. Con base en ello se obtuvieron 2 grupos de 26 pacientes equiparables en cuanto a las características del uso o no uso de tratamiento anticoagulante (tabla 2). En estos pacientes con FA y demencia, la anticoagulación no se asoció con la mortalidad (HR=0,91; IC95%, 0,45-1,83; p=0,785) ni con el combinado de muerte, embolias y hemorragia (HR=1,02; IC95%, 0,52-2,00; p=0,962).
DISCUSIÓNNuestro estudio aporta una información clínica relevante en un tema que hasta la ahora apenas se ha abordado en la comunidad científica: la utilidad de la anticoagulación oral en los pacientes muy ancianos, de 85 o más años, con demencia y FA. El principal resultado del estudio es que, en esta población, la anticoagulación oral parece que no se asocia con una menor mortalidad. Sin embargo, este no es el único resultado relevante del estudio. A continuación se discuten los hallazgos más relevantes de nuestro trabajo.
Empezamos por la prevalencia de la demencia en los pacientes con FA. Nuestro estudio se centra en los pacientes de edad ≥ 85 años y considera demencia los casos de grado moderado-grave. Hasta 1 de cada 16 (6,2%) pacientes de 85 o más años tenía diagnóstico de demencia de grado moderado-grabe. El grupo de Rodríguez-Mañero había documentado previamente una incidencia de demencia (sin especificar gravedad) del 3,6% en una población de pacientes con FA con una edad media de 76,8 años4. Teniendo en cuenta que la prevalencia de la demencia aumenta de forma exponencial con la edad y que la mayor parte de los casos son catalogados de demencias leves, nuestro porcentaje de demencia moderada-grave en el grupo de ancianos de 85 y más años con FA parece consistente. Esto traduce un problema de una magnitud relevante, dado el sobreenvejecimiento de la población. Y dicho problema se acentúa según estudios recientes, que han encontrado una asociación entre la FA y el desarrollo posterior de demencia, sobre todo en pacientes no anticoagulados12. Sin embargo, ¿sabemos cómo tratar a estos pacientes con demencia y FA en lo referente al tratamiento antitrombótico?
Un estudio previamente publicado sobre una encuesta realizada a médicos de Estados unidos puso de relieve que la demencia era la segunda causa por la que un paciente anciano no se anticoagulaba13. Los pacientes con demencia tienen un mayor riesgo de caídas, hemorragias e incumplimiento terapéutico, aspectos que pueden condicionar el menor uso de la anticoagulación14–16. En la población de nuestro estudio, 4 de cada 10 pacientes de 85 o más años con demencia no se anticoagulaba pese a tener todos ellos una puntuación CHA2DS2-VASc ≥ 2. De los que se anticoagulaban, 8 de cada 10 lo hacían con AVK (79,6%), aunque el uso de ACOD aumentaba durante el seguimiento (del 20,4% inicial al 37,2% final). No hubo diferencias en el uso de ACOD entre pacientes con y sin demencia, y tampoco hubo diferencias en el tiempo en rango terapéutico entre ambos grupos de pacientes.
En los pacientes con demencia de nuestro estudio, la anticoagulación oral se asoció de manera significativa con menor riesgo de embolias, pero también con un mayor riesgo hemorrágico. Sin embargo, no se encontraron diferencias en cuanto a mortalidad total, aspecto diferencial con respeto a los pacientes sin demencia. Este supuesto efecto neutro de la anticoagulación en la mortalidad de los pacientes con demencia debe interpretarse con cautela, teniendo en cuenta el carácter retrospectivo del análisis y el impacto negativo que puede tener en la mortalidad el tratamiento diagnóstico y terapéutico más conservador al que se somete a los pacientes con demencia, y que pudiese neutralizar un plausible impacto beneficioso de los anticoagulantes orales en estos pacientes. Hasta la fecha, y según nuestro conocimiento, solamente 2 estudios han analizado el aspecto de la anticoagulación en pacientes con FA y demencia. En el registro nacional sueco de demencia (2007-2014), los autores reportaron menor mortalidad con la anticoagulación oral, pero únicamente cuando se comparaban específicamente con el grupo sin tratamiento antitrombótico, y esas diferencias se diluían cuando el grupo de referencia para la comparación incluía la antiagregación plaquetaria simple17. Esto resulta difícil de explicar, ya que la antiagregación plaquetaria simple no ha demostrado beneficio pronóstico en la demencia vascular18 ni en los pacientes ancianos con alto riesgo cardiovascular19. En comparación con nuestro estudio, el registro nacional sueco presenta diferencias llamativas. Si en nuestro estudio, con una edad ≥ 85 años en todos los pacientes, el 60% de los pacientes con demencia y FA se anticoagulaban (el 75,9% con AVK), en el registro nacional sueco, con una edad media de 82 años, únicamente se anticoagulaba al 26% de los pacientes con FA y demencia (el 100% con AVK), lo cual indica que hay un importante sesgo de selección que condiciona los resultados. Además, en nuestro trabajo únicamente se incluyó a pacientes con demencia moderada-grave, mientras que en el registro nacional sueco se incluyó a pacientes con cualquier grado de deterioro cognitivo, lo que explica que hasta un 40% de los pacientes que se anticoagulaban vivían solos. De forma complementaria, en el registro procedente del Veterans Affairs National Healthcare System, en el que únicamente el 19% de los pacientes tenían 85 o más años), los autores encontraron una reducción significativa de la mortalidad total con la continuación de la anticoagulación oral en pacientes con FA a los que se diagnosticaba demencia20. Las fortalezas de nuestro estudio, frente a los 2 descritos, radican en su contemporaneidad (por lo que son aplicables a la era de los ACOD), así como en el grupo poblacional estudiado, que incluye únicamente a los pacientes con demencia de grado moderado-grave (excluyendo deterioro cognitivo leve) y de más edad (≥ 85 años), de los que los cardiólogos clínicos carecemos de evidencia científica para una toma de decisiones realmente compleja. Cuando los clínicos se enfrentan a este tipo de pacientes siempre se plantean la pregunta de si vale la pena iniciar la anticoagulación o no, siendo conocedores del riesgo hemorrágico asociado. En este sentido, nuestro estudio aporta nueva evidencia al respecto, en un grupo de pacientes que suele ser excluido de los ensayos clínicos. Debemos ser conscientes de la necesidad de realizar un esfuerzo científico para la especialización de la atención a los pacientes con deterioro cognitivo moderado a grave. Nuestro estudio constituye ese primer paso para la creación de una evidencia científica consistente que fundamente o no el uso de la terapia anticoagulante en estos pacientes. Sin embargo, es necesaria la realización de un ensayo clínico para poder contestar de forma consistente a esta pregunta. Mientras tanto, se debe destacar la necesidad de hacer una evaluación individualizada de ambos riesgos (embólico y hemorrágico) pasa consensuar tanto con el paciente como con la familia la decisión terapéutica sobre la anticoagulación.
LimitacionesA pesar del interés que puedan tener nuestros resultados, se deben considerar las siguientes limitaciones del estudio. Por un lado, las inherentes a su carácter retrospectivo que, pese a la meticulosidad en la recogida de los datos y en la consistencia de estos, siempre aportan la posibilidad de errores a la hora de catalogar a los pacientes en los diferentes grupos. Dicho carácter retrospectivo supone, por un lado, el riesgo de subestimar el porcentaje real de pacientes con demencia (posibilidad de que cierto porcentaje de pacientes con demencia no sean identificados por sus médicos con dicho diagnóstico en su historia clínica), y por otro no conocer con exactitud el motivo por el que los clínicos responsables deciden no anticoagular a estos pacientes. Además, el tamaño muestral impide hacer estudios de subgrupos que serían de gran interés. A pesar de que se analiza a más de 3.500 pacientes, solo 221 tienen demencia moderada-grave, de los que solo 133 reciben anticoagulación oral. Si bien es cierto que la tasa de eventos en los pacientes con demencia es alta (> 50% de mortalidad y >10% de embolias y hemorragias), la potencia del estudio es subóptima para hacer análisis por tipo de anticoagulante. Además, tampoco se ha analizado si el ajuste de dosis de los ACOD, de acuerdo con la ficha técnica, se realizó correctamente, por lo que es posible que en nuestra cohorte exista una infradosificación relacionada con la sensación de fragilidad y riesgo hemorrágico que estos pacientes transmiten. Pese a todo ello, consideramos muy interesantes nuestros datos pues aportan, por primera vez, evidencia en el tratamiento anticoagulante de los pacientes ancianos con demencia y FA y sientan las bases para futuros estudios (idealmente aleatorizados) que confirmen nuestros hallazgos.
CONCLUSIONESLa coexistencia de FA y demencia en pacientes ancianos es frecuente (hasta 1 de cada 16 pacientes de edad ≥ 85 años con FA tiene demencia de grado moderado-grave). De estos pacientes, menos de 2/3 reciben anticoagulación. El tratamiento anticoagulante de los pacientes de 85 o más años con FA y demencia moderada-grave no se asoció con una menor mortalidad. Sin embargo, sí se asoció con una reducción de los eventos embólicos, aunque con un incremento marcado del riesgo hemorrágico.
- –
En España se estima que en torno al 10% de los pacientes octogenarios con fibrilación auricular tienen diagnóstico de demencia. Sin embargo, poco se sabe acerca del impacto de la demencia en el riesgo embólico y hemorrágico en función del tratamiento anticoagulante, pues los pacientes con demencia, sobre todo en estadios moderados-graves, no han sido incluidos en los ensayos clínicos realizados con los fármacos anticoagulantes.
- –
Nuestro trabajo aporta información clínica relevante acerca de la prevalencia y el impacto del tratamiento anticoagulante en pacientes de edad ≥ 85 años con fibrilación auricular y demencia moderada-grave. Se trata de un subgrupo de pacientes muy prevalente en el que la anticoagulación no se asocia de manera significativa con una disminución de la mortalidad, aunque sí con una reducción de los eventos embólicos y un aumento de los eventos hemorrágicos.
E. Abu Assi es editor asociado de Revista Española de Cardiología; se ha seguido el procedimiento editorial establecido en Revista para garantizar la gestión imparcial del manuscrito.
Los demás autores no tienen ningún conflicto de intereses que declarar en relación con el presente manuscrito.