El desarrollo del implante percutáneo de válvula aórtica ha revolucionado el tratamiento de la estenosis de válvula aórtica calcificada. Los pacientes ancianos a los que se consideraba inoperables ahora cuentan con un tratamiento eficaz y seguro que proporciona una mejor supervivencia. Además, las guías de práctica actuales tienden a recomendar una intervención más temprana para evitar las consecuencias irreversibles de la sobrecarga de presión de larga duración causada por la válvula aórtica estenótica. El momento adecuado para la intervención depende en gran medida de las técnicas de imagen que informan de la gravedad de la estenosis aórtica, pero también de las consecuencias hemodinámicas y el remodelado cardiaco. Si bien la fracción de eyección del ventrículo izquierdo sigue siendo uno de los principales parámetros funcionales para la estratificación del riesgo de los pacientes con estenosis aórtica grave, los avances en las técnicas de imagen han proporcionado nuevos parámetros estructurales y funcionales que permiten identificar a los pacientes que se beneficiarán de la intervención antes de que aparezcan síntomas o daño cardiaco irreversible. Además, el desarrollo de tratamientos médicos que pueden detener de manera efectiva la progresión de la estenosis aórtica depende en gran medida de la información que las técnicas de imagen aportan, y la caracterización de la actividad metabólica de la estenosis aórtica calcificada con técnicas de medicina nuclear o tomografía computarizada ha permitido monitorizar los efectos de esos tratamientos. El presente artículo de revisión brinda una visión actualizada de los avances en técnicas de imagen que caracterizan la fisiopatología y han cambiado el paradigma del tratamiento de la estenosis aórtica.
Palabras clave
En Europa y Norteamérica hay más de 7 millones de personas con estenosis de la válvula aórtica (EA). En Europa la EA significativa es la principal indicación de intervención quirúrgica o percutánea de valvulopatías y se prevé que su prevalencia aumente significativamente en los próximos años debido al envejecimiento de la población1,2. El tratamiento y la indicación de reemplazo de la válvula aórtica (RVA) están determinados por la presencia de signos y síntomas asociados con una EA grave y por las consecuencias hemodinámicas evaluadas mediante técnicas de diagnóstico por la imagen.
Las guías de práctica clínica vigentes recomiendan el RVA para pacientes con EA grave sintomática y pacientes asintomáticos que presentan disfunción sistólica del ventrículo izquierdo (VI)3-5. Las guías consideran también el RVA para los pacientes con una EA grave asintomática y marcadores de mal pronóstico, como una velocidad máxima del chorro aórtico >5 m/s, un gradiente valvular medio> 60?mmHg o una fracción de eyección del VI (FEVI)<55%6. Además, una respuesta patológica a la prueba de esfuerzo, la hipertrofia del VI grave o un aumento de las concentraciones de péptidos natriuréticos son factores que se tienen en cuenta en la toma de decisiones respecto a los pacientes con EA grave asintomáticos. Otros aspectos de las exploraciones de imagen que las guías actuales no incluyen pero se han asociado con el pronóstico de los pacientes con EA grave son, entre otros, el deterioro de la mecánica miocárdica evaluada mediante imágenes de strain (deformación) y la fibrosis miocárdica evaluada mediante resonancia magnética cardiaca (RMC). Así pues, las técnicas de imagen cardiacas son clave en el diagnóstico y el tratamiento de los pacientes con EA grave7–10.
La ecocardiografía transtorácica es la técnica de imagen de elección para evaluar la gravedad y las consecuencias hemodinámicas de la EA11. Sin embargo, en la práctica clínica diaria, la ecocardiografía a menudo muestra resultados contradictorios, lo cual dificulta el diagnóstico de la gravedad de la EA. La ecocardiografía de estrés con dobutamina en dosis bajas y la tomografía computarizada cardiaca (TCC) aportan una información útil para identificar a los pacientes con una EA grave real12–15. Además, con el envejecimiento de la población, se producirá un aumento de la prevalencia de comorbilidades cardiacas que dificultan el diagnóstico y el tratamiento cuando coexiste una EA grave (p. ej., la amiloidosis cardiaca), y en estos casos otras técnicas de imagen, como las nucleares o la RMC, tienen un papel importante. Por último, aunque la fisiopatología de la EA se ha estudiado ampliamente, la posibilidad de visualizar con técnicas de imagen los mecanismos fisiopatológicos de la progresión de la EA con las nuevas técnicas de imagen moleculares ha reavivado la investigación sobre tratamientos médicos que podrían detener la evolución natural de la EA16,17.
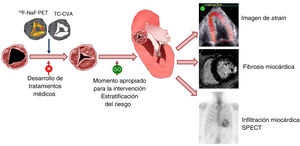
En esta revisión se valoran las actualizaciones más recientes en las técnicas de imagen cardiacas que permiten comprender la fisiopatología de la EA, el diagnóstico y la estratificación del riesgo de los pacientes con EA grave. Se aborda también el papel de las técnicas de imagen cardiacas en el desarrollo de tratamientos alternativos al RVA (figura 1).
Figura central. Técnicas de imagen multimodales en la estenosis aórtica. En la evaluación del efecto de los tratamientos dirigidos a la fisiopatología subyacente en la progresión de la estenosis aórtica calcificada, las técnicas de imagen como la PET con 18F-NaF o la TC pueden detectar alteraciones estructurales de la válvula de manera más temprana que las consecuencias hemodinámicas de la estenosis. Una vez diagnosticada una estenosis aórtica grave, los marcadores distintos de los síntomas y la fracción de eyección del ventrículo izquierdo pueden ser útiles para estratificar el riesgo de los pacientes que pueden beneficiarse de una intervención temprana. Entre estos marcadores se encuentran las imágenes de strain miocárdico y la fibrosis miocárdica en la resonancia magnética cardiovascular; en algunos pacientes, la presencia de amiloidosis cardiaca por transtirretina puede descartarse mediante una gammagrafía con pirofosfato de tecnecio-99m. CVA: calcio de válvula aórtica; PET: tomografía por emisión de positrones; SPECT: tomografía computarizada por emisión monofotónica; TC: tomografía computarizada.
La ecocardiografía transtorácica es la técnica de imagen de elección para diagnosticar la presencia y la gravedad de la EA. Según lo indicado por la guía vigente4, la EA grave se basa en una velocidad máxima del chorro aórtico> 4 m/s, un gradiente transvalvular?medio> 40?mmHg y un área valvular aórtica (AVA) calculada <1?cm2. Sin embargo, estas mediciones plantean algunos retos. En el cálculo del AVA mediante la ecuación de continuidad influyen mucho las variaciones en la medición del tracto de salida del VI. La ecocardiografía bidimensional parte del supuesto de que el tracto de salida del VI es circular en vez de ovalado, por lo que introduce un valor más bajo de las mediciones del tracto de salida del VI en la ecuación de continuidad, lo cual comporta una subestimación significativa del AVA en comparación con las técnicas tridimensionales18. Además, la velocidad máxima del chorro aórtico y el gradiente transvalvular medio son parámetros determinados mediante Doppler, en el que influyen la función del VI, la situación hemodinámica del paciente y la alineación correcta del haz de ultrasonidos con el chorro eyectado a través de la válvula aórtica. Por consiguiente, es bien sabido que el 40% de los pacientes con EA grave definida por un AVA <1?cm2 pueden presentar un gradiente bajo (< 40mmHg) debido a un volumen sistólico reducido (flujo bajo, <35ml/m2) a causa de una FEVI reducida (EA grave de bajo flujo y bajo gradiente clásica) o a causa de una hipertrofia grave del VI y una cavidad ventricular pequeña (EA grave de bajo flujo y bajo gradiente paradójica). En la EA grave de flujo bajo y gradiente bajo clásica, la inducción de la reserva contráctil y del flujo con la ecocardiografía de estrés con dobutamina en dosis bajas y la demostración de que el gradiente transvalvular medio aumenta en> 40mmHg mientras que el AVA se mantiene en valores <1cm2 es útil para establecer el diagnóstico de una EA grave real12,19. En consecuencia, las guías actuales incluyen la ecocardiografía de estrés con dobutamina en dosis bajas con una recomendación de clase I en esta situación clínica. Sin embargo, el papel de la ecocardiografía de estrés con dobutamina en dosis bajas en los pacientes con EA grave de bajo flujo y bajo gradiente paradójica no está tan bien establecido. Los pacientes con EA grave de bajo flujo y bajo gradiente paradójica son en su mayor parte mujeres con antecedentes de hipertensión, un VI pequeño y una hipertrofia significativa asociada20. Clavel et al.21 han propuesto el cálculo del AVA proyectada que tiene en cuenta el flujo transvalvular medio, un parámetro que varía ampliamente de un paciente a otro durante la ecocardiografía de estrés. El AVA proyectada a un flujo normal mostró una correlación con el peso de la válvula aórtica explantada más importante que la del AVA en estrés máximo o la del gradiente medio22. Sin embargo, debe señalarse que, los pacientes con una EA grave de bajo flujo y bajo gradiente paradójica pueden no tolerar bien hemodinámicamente la ecocardiografía de estrés con dobutamina en dosis bajas, y las guías actuales no incluyen esta técnica de imagen para ellos.
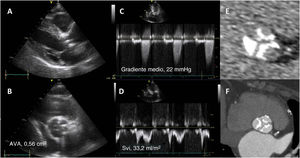
Cuando la ecocardiografía de estrés con dobutamina a dosis bajas no es concluyente y no puede inducirse la reserva contráctil o normalizarse el flujo, se debe considerar otros indicadores indirectos de la EA grave. La tomografía computarizada (TC) permite cuantificar la carga de calcificación de la válvula aórtica. La mejor forma de visualizar las cúspides aórticas engrosadas hiperecogénicas que indican una EA calcificada en la ecocardiografía es la TCC sin contraste. En estudios observacionales grandes se ha observado una asociación entre la carga de calcio de la válvula aórtica y el gradiente transvalvular medio y el AVA23. Es importante señalar que los valores de corte de la carga de calcio de la válvula aórtica utilizados para definir la EA grave difieren entre los varones y las mujeres:> 2.000 y> 1.200 respectivamente (figura 2)14,15. En el algoritmo diagnóstico de los pacientes con una EA grave de bajo flujo y bajo gradiente, se considera la TCC para establecer el diagnóstico y tomar decisiones4.
Diagnóstico de la estenosis aórtica grave con tomografía computarizada en un paciente con discordancia en el grado determinado por ecocardiografía. En la proyección de eje largo paraesternal (A) y la proyección de eje corto (B) de la válvula aórtica, pueden observarse unas valvas engrosadas hiperecogénicas que indican estenosis aórtica grave. Sin embargo, mediante la señal Doppler de onda continua a través de la válvula aórtica, el gradiente de presión transvalvular medio es <40 mmHg y en la señal Doppler de onda pulsada, el volumen sistólico calculado es <35ml/m2. El AVA calculada es <1cm2. La tomografía computarizada sin contraste muestra una puntuación de calcio de la válvula aórtica de 2.500 unidades arbitrarias (E) y en la tomografía computarizada con contraste la válvula muestra 3 valvas intensamente calcificadas, mientras que no puede visualizarse el engrosamiento (F). AVA: área de válvula aórtica; Svi: índice de volumen sistólico.
Más recientemente, la medición de la carga de calcio de la válvula aórtica mediante TCC con contraste se ha validado en comparación con la TCC sin contraste y el peso de la válvula aórtica explantada en un grupo de pacientes con diversos grados de EA24. Esta técnica de imagen proporciona una resolución espacial superior a la de la TCC sin contraste y permite estimar el componente fibroso de la válvula aórtica. La medición del volumen fibrocalcificado de la válvula aórtica mediante TCC con contraste mostró una mejor correlación con la velocidad máxima del chorro aórtico, sobre todo en las mujeres. Además, el cociente entre el componente fibroso y el calcificado de la válvula aórtica se redujo según aumentaba la gravedad de la EA. Estos resultados son prometedores, ya que la TCC con contraste se emplea con frecuencia en los pacientes sometidos a implante percutáneo de la válvula aórtica, y en aquellos que presentan una EA grave de bajo flujo y bajo gradiente puede obviarse la TCC sin contraste.
NUEVAS PERSPECTIVAS DE LAS TÉCNICAS DE IMAGEN EN LA ESTRATIFICACIÓN DEL RIESGO DE LOS PACIENTES CON ESTENOSIS DE LA VÁLVULA AÓRTICALa reducción progresiva de la mortalidad hospitalaria tras un RVA quirúrgico a lo largo de los años hasta llegar a cifras inferiores al 3% se relaciona no solo con los avances técnicos, sino también con la probable remisión de pacientes con una enfermedad menos avanzada, que incluso pueden haber estado asintomáticos25. La determinación del momento adecuado para una intervención en la válvula aórtica es un aspecto fundamental para mejorar los resultados de los pacientes y reducir el riesgo a corto y largo plazo de las intervenciones. La guía actual recomienda intervenir la válvula aórtica cuando la EA es grave y causa síntomas o una reducción de la FEVI4. Sin embargo, se ha planteado la hipótesis de que antes de que una EA grave cause síntomas o de que la FEVI se reduzca a <50%, una intervención más temprana podría mejorar los resultados al evitar que se produzcan las consecuencias adversas hemodinámicas y estructurales de la EA grave. Los resultados de los ensayos RECOVERY y AVATAR pusieron de manifiesto que los pacientes con EA grave asintomáticos sometidos a RVA presentaron resultados mejores que los de los pacientes asignados aleatoriamente a una conducta de vigilancia expectante y resaltan la necesidad de nuevos marcadores que permitan identificar de manera fiable a los pacientes que obtendrán un beneficio con la intervención26,27.
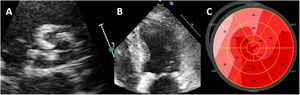
La sobrecarga de presión causada por la EA grave induce un aumento de la tensión en la pared del VI. Para mantener la función sistólica del VI, este responde con una hipertrofia miocárdica que se caracteriza por un aumento del diámetro de las fibras musculares y una adición paralela de miofibrillas28. Además, se produce un aumento de la fibrosis perivascular, la fibrosis intersticial y la apoptosis miocitaria como consecuencia del deterioro de la reserva de flujo coronario y la isquemia miocárdica29. Estas alteraciones estructurales aparecen antes de que haya una reducción de la FEVI. Sin embargo, se ha observado que hay otros parámetros de las exploraciones de imagen que son más sensibles que la FEVI para la detección de tales alteraciones. Se ha demostrado que las técnicas de imagen de strain y la medición de la deformación miocárdica son más sensibles que la FEVI en la detección de la disfunción sistólica del VI. Los pacientes con EA grave y FEVI> 50% generalmente muestran un deterioro de los valores de strain longitudinal global del VI (SLG-VI) (figura 3). El SLG-VI es una medida más reproducible que la FEVI y se ha asociado con los resultados clínicos de los pacientes con EA grave asintomáticos. En comparación con los controles sin EA igualados por edad y sexo, los pacientes con EA grave asintomática presentaron un mayor deterioro del SLG-VI (el 19,6± 2,1% frente al 17,9±2,5%; p <0,001), pero con una FEVI similar (del 61,5±5,9% frente al 62,1±6,3%; p=0,001)30. Además, el deterioro del SLG-VI se incrementó a lo largo de 12 meses de seguimiento bajo vigilancia, mientras que la FEVI se mantuvo inalterada30. Estas observaciones indican que la FEVI es un marcador tardío de las consecuencias de la EA en el miocardio. Además, el SLG-VI tiene un valor pronóstico incremental respecto al de la FEVI. En un metanálisis basado en datos de pacientes individuales, en el que se incluyó a pacientes con EA grave y FEVI conservada, un valor de corte de SLG-VI <14,7% se asoció con un aumento de la mortalidad en 2,5 veces31. Las guías vigentes no incluyen el SLG-VI como base para la toma de decisiones respecto al RVA, ya que no hay ensayos aleatorizados prospectivos que basen esta decisión en los valores de SLG-VI.
Evaluación de la función sistólica del ventrículo izquierdo con imágenes de strain en la estenosis aórtica. Ejemplo de un paciente con estenosis aórtica calcificada. A: proyección de eje corto de la válvula tricúspide calcificada, causante de una hipertrofia grave del ventrículo izquierdo (B); pese a una fracción de eyección del ventrículo izquierdo normal, el strain longitudinal global del ventrículo izquierdo está deteriorado, en especial en los segmentos más hipertrofiados (C, septal).
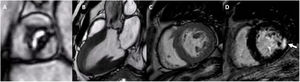
Los valores de SLG-VI han mostrado una correlación con los parámetros de fibrosis de sustitución y reactiva del miocardio obtenidos en la RMC32. La fracción de volumen extracelular y los valores de mapeo T1 nativos y tras contraste (como indicadores indirectos de la fibrosis intersticial reactiva) y la presencia y la masa de realce tardío de gadolinio (que refleja la fibrosis de sustitución) en la RMC se han asociado con los resultados clínicos de los pacientes con EA33 (figura 4). Tanto la fibrosis reactiva (mapeo T1) como la de sustitución progresan a medida que disminuye el AVA, y la progresión más rápida es la que se produce cuando la EA es grave34. El aumento de la fracción de volumen extracelular y del mapeo T1 se ha asociado al remodelado VI adverso y a la insuficiencia cardiaca. Sin embargo, después del RVA, la fibrosis reactiva muestra una regresión y los valores de mapeo T1 disminuyen35. En cambio, el RTG no desaparece una vez reemplazada la válvula aórtica. Se observa con más frecuencia un patrón de RTG no similar al del infarto que un patrón de tipo infarto en los pacientes con EA grave36. Los puntos de inserción en el ventrículo derecho y el realce miocárdico mesoparietal y focal moteado son las ubicaciones más frecuentes del patrón de RTG no similar al del infarto. La presencia de RTG se asocia con reducción de la supervivencia y ausencia de mejoría de los síntomas clínicos después del RVA37,38. Así pues, parece concebible que la caracterización de la fibrosis miocárdica en la EA pueda ser útil para definir mejor el momento apropiado para la intervención. Estudios como el ensayo EVOLVED permitirán esclarecer el papel de la RMC en la estratificación del riesgo de estos pacientes39.
Resonancia magnética cardiovascular de un paciente con estenosis aórtica grave. Las imágenes de cine de la válvula aórtica (A), las proyecciones de 3 cámaras (B) y las proyecciones de eje corto (C) del ventrículo izquierdo muestran la apertura restrictiva de la válvula aórtica y la marcada hipertrofia del ventrículo izquierdo. D: realce tardío de gadolinio en el eje corto del ventrículo izquierdo con fibrosis focal en el segmento posterior (flecha).
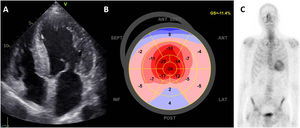
Recientemente se ha descrito una asociación entre la EA y la amiloidosis cardiaca por transtirretina (AC-ATTR) en diversas series40,41. Ambas enfermedades se relacionana con el proceso de envejecimiento de la población y su prevalencia aumenta con la edad. El depósito de proteína amiloide en la matriz extracelular intersticial conduce a una hipertrofia del VI que puede ser imposible de diferenciar de la causada por la EA sola. Las señales de alerta que aumentan la sospecha de una AC-ATTR son la hipertrofia del ventrículo derecho y el tabique interauricular, un patrón de llenado diastólico del VI marcadamente restrictivo y un engrosamiento de las válvulas mitral y tricúspide. Con el empleo de la ecocardiografía con speckle tracking (rastreo de marcas), la presencia de un «patrón de cereza» con un strain longitudinal más conservado en los segmentos apicales del VI en comparación con los segmentos medios y basales apunta también a una AC-ATTR, pero no es específica42. El aumento de la concienciación respecto a la AC-ATTR, la introducción de tratamientos eficaces para detener el proceso de la enfermedad y el mayor uso de la gammagrafía con pirofosfato de tecnecio-99m (99mTc PYP) como exploración de diagnóstico han aumentado de manera significativa la prevalencia de esta enfermedad (figura 5). En los pacientes con EA grave sometidos a implante percutáneo de la válvula aórtica, la prevalencia de la AC-ATTR oscila entre el 8 y el 16%, mientras que en los pacientes con amiloidosis cardiaca la prevalencia de EA grave es del 1,8%40,43. Sin tratamiento, la concomitancia de ambas enfermedades tiene un pronóstico infausto44. Sin embargo, el implante percutáneo de la válvula aórtica se ha asociado con una mejora de la supervivencia40,41. Continúa habiendo varias incógnitas en este rompecabezas. Sigue sin conocerse la prevalencia de la AC-ATTR en los pacientes con EA, ya que la gammagrafía con 99mTc PYP, que es una técnica de imagen más sensible y específica que la RMC o la ecocardiografía con speckle tracking, no se utiliza de manera sistemática. La relación fisiopatológica entre la AC-ATTR y la EA no se conoce por completo y, aun cuando ambas se relacionan con la edad, continúa existiendo la hipótesis de que el depósito de amiloide podría ser la causa de la miocardiopatía y la EA. La infiltración de las cúspides aórticas podría ser un desencadenante del daño endotelial y la calcificación45. Por último, el RVA, cuando está indicado, se asocia con una supervivencia mejor que la obtenida con el tratamiento médico. No obstante, los pacientes con AC-ATTR concomitante siguen teniendo un riesgo elevado de hospitalizaciones por insuficiencia cardiaca después del RVA, y ello indica que es necesario un seguimiento estrecho. Queda por investigar si los tratamientos modificadores de la enfermedad para la miocardiopatía amiloide después del RVA pueden conducir a una mejor supervivencia.
Amiloidosis cardiaca por transtirretina en un paciente con estenosis aórtica grave. A: proyección tetracameral apical con hipertrofia congénita del ventrículo izquierdo, valvas mitrales engrosadas y aurículas dilatadas. En el análisis del strain ecocardiográfico, el gráfico de ojo de buey del ventrículo izquierdo muestra la conservación apical con valores más conservados del strain longitudinal en el vértice (B). En la gammagrafía ósea hay una captación en el corazón (C). GS: strain global.
En varios ensayos clínicos aleatorizados se han evaluado tratamientos médicos dirigidos a la progresión de la EA calcificada con objeto de retrasar el RVA. Entre estos tratamientos se encuentran los hipolipemiantes, los inhibidores del sistema renina-angiotensina-aldosterona y los medicamentos dirigidos a dianas metabólicas que fomentan la osteogénesis en la válvula46. Sin embargo, hasta el momento los resultados han sido desalentadores, puesto que no hay ningún tratamiento que se haya demostrado eficaz. Se han propuesto varias hipótesis para explicar los resultados de los ensayos. En primer lugar, es posible que la enfermedad de los pacientes incluidos en estos ensayos estuviera demasiado avanzada (EA moderada o grave) para que el tratamiento médico fuera capaz de detener la progresión o que la enfermedad se encontrara en una fase muy inicial (esclerosis aórtica o EA leve) y hubiera sido necesario un seguimiento a muy largo plazo para demostrar la eficacia del tratamiento médico. Además, para evaluar la progresión de la enfermedad, la mayoría de los ensayos utilizaron criterios de valoración ecocardiográficos, que consistieron en las consecuencias hemodinámicas de la EA (p. ej., velocidad máxima del chorro aórtico, gradiente transvalvular medio…), que podrían verse influidas por otras variables y no solo por la válvula aórtica en sí (p. ej., FEVI, presión arterial sistólica…).
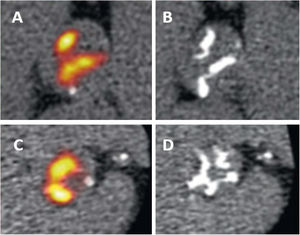
A este respecto, la TC y las técnicas de imagen nucleares han aportado nuevos medios para el seguimiento de la progresión del proceso de calcificación de la válvula aórtica, y es posible que puedan conducir a nuevos criterios de valoración de imagen para mostrar la eficacia de estos tratamientos. La evaluación de la carga de calcio de la válvula aórtica con la TC sin contraste es un método reproducible y que tiene una excelente repetibilidad de exploración-reexploración. Además, la cantidad de calcio presente en la válvula aórtica se ha asociado con la gravedad de la EA y la aparición de eventos cardiovasculares adversos14,15,23. Esto ha llevado a la adopción de esta técnica de imagen para el seguimiento de la progresión de la calcificación de la válvula aórtica y a su uso como criterio principal de eficacia en varios ensayos clínicos aleatorizados que han evaluado nuevos tratamientos47,48. Además, la actividad de calcificación y la inflamación de la válvula aórtica pueden evaluarse con técnicas de imagen nucleares. La 18F-fluorodesoxiglucosa (18F-FDG) y el 18F-fluoruro sódico (18F-NaF) son 2 radiotrazadores de la tomografía de emisión de positrones (PET) que evalúan, respectivamente, la inflamación y la actividad de calcificación49,50 (figura 6). La captación de 18F-NaF en la válvula aórtica se correlaciona con la progresión de la puntuación de calcio de la válvula aórtica en la TC sin contraste, al contrario que la captación de 18F-FDG49. En consecuencia, la 18F-NaF PET podría ser una técnica de imagen apropiada para medir la progresión de la EA calcificada y la eficacia del tratamiento médico. Lamentablemente, los posibles tratamientos médicos que se han evaluado en ensayos clínicos aleatorizados con criterios de valoración de la TC o la 18F-NaF PET no han mostrado eficacia. En el ensayo SALTIRE2 se incluyó a 150 pacientes con EA calcificada aleatorizados a denosumab o ácido alendrónico (inhibidores de la resorción ósea) en comparación con un placebo, y se observó que estos fármacos no afectaron a la progresión de la enfermedad y no hubo diferencias en el cambio de la puntuación del calcio de la válvula aórtica en la TC ni en la captación de 18F-NaF en la PET entre los grupos de tratamiento aleatorizados47. Una de las razones más plausibles para explicar estos resultados es que los osteoclastos de los vasos sanguíneos no fueran funcionales, por lo que ningún inhibidor dirigido a la resorción osteoclástica (como los bisfosfonatos) sería eficaz para modular la calcificación cardiovascular51.
Tomografía por emisión de positrones (PET) con 18F-NaF de 2 pacientes con estenosis aórtica calcificada. Los paneles A y C muestran el aumento basal de captación valvular en la 18F-NaF PET, que predecía la progresión a una macrocalcificación en la tomografía computarizada obtenida 2 años después (B y D). Reproducido con permiso de Zheng et al.50.
En el ensayo AVADEC se incluyó a 365 varones con EA calcificada —definida por una puntuación del calcio de la válvula aórtica ≥ 300 unidades arbitrarias— pero con una velocidad máxima del chorro aórtico ≤ 3 m/s aleatorizados a menaquinona-7 o placebo48. La menaquinona-7, también denominada vitamina K2, es un cofactor que participa en la carboxilación de las proteínas que inhiben la calcificación arterial. Se evaluó la progresión de la calcificación de la válvula aórtica mediante TC sin contraste y medición de la puntuación del calcio de la válvula aórtica a los 2 años de seguimiento. No hubo diferencias significativas en los cambios de la puntuación del calcio de la válvula aórtica entre los 2 grupos de tratamiento aleatorizados y, por consiguiente, el estudio llegó a la conclusión de que la menaquinona-7 no influye en el proceso de calcificación de la válvula aórtica. Es importante señalar que en el ensayo solamente participaron varones y que los efectos de este tratamiento en las mujeres no se conocen aún. Los ensayos clínicos aleatorizados actualmente en curso aportarán información adicional sobre el uso de estas técnicas de imagen para evaluar la eficacia de los tratamientos médicos46. Será preciso tener en cuenta la carga de radiación que estas técnicas conllevan al realizar el seguimiento de los pacientes en tratamiento médico.
CONCLUSIONESAunque la ecocardiografía continúa siendo la piedra angular de las técnicas de imagen para evaluar a los pacientes con EA calcificada, la información aportada por otras técnicas de imagen que permiten la caracterización de las alteraciones miocárdicas inducidas por la sobrecarga de presión y el proceso de calcificación de la válvula aórtica ha abierto la puerta a múltiples oportunidades para reconsiderar el tratamiento de la enfermedad. La capacidad de detectar las alteraciones estructurales iniciales en el miocardio del VI que es posible que el RVA no resuelva y pueden influir negativamente en los resultados clínicos abre la posibilidad a una remisión más temprana de los pacientes a RVA. Las técnicas de imagen que permiten dar seguimiento al proceso de calcificación de la válvula aórtica pueden ser útiles para encontrar tratamientos médicos eficaces que retrasen o incluso eviten el RVA.
FINANCIACIÓNNinguna.
CONTRIBUCIÓN DE LOS AUTORESE. Ferrer-Sistach: revisión de la literatura, redacción de la versión inicial del manuscrito, aprobación final. A. Teis: revisión crítica del manuscrito y aprobación final, asesoramiento respecto a ilustraciones. A. Bayés-Genís: revisión crítica del manuscrito y aprobación final. V. Delgado: revisión de la literatura, redacción de la versión inicial del manuscrito, aprobación final, ilustraciones.
CONFLICTO DE INTERESESV. Delgado recibe pagos por conferencias de Abbott Vascular, Edwards Lifesciences, Medtronic, Novartis y GE Healthcare. A. Bayés-Genís ha dictado conferencias o ha participado en consejos asesores de Abbott, AstraZeneca, Boehringer-Ingelheim, Novartis, Roche Diagnostics y Vifor. Los demás autores no tienen nada que declarar.