La hipertrofia ventricular izquierda (HVI) es un hallazgo frecuente después del trasplante cardiaco (TxC)1, y se ha asociado con un peor pronóstico. Existen variables que se han relacionado con un mayor riesgo de HVI grave después del trasplante, como la edad, la obesidad, la diabetes o la hipertensión previa1, la terapia inmunosupresora y la posible presencia de una miocardiopatía primaria en el injerto que se pusiera de manifiesto después del trasplante.
La miocardiopatía hipertrófica apical es una variante relativamente infrecuente, asociada con un aumento de espesores de los segmentos apicales del ventrículo izquierdo y una cavidad ventricular reducida3. Los síntomas son poco específicos, y el diagnóstico a menudo es tardío3,4. El objetivo de nuestro trabajo es describir las características y la evolución de una cohorte de pacientes que presentaron HVI de localización apical después del TxC.
Se realizó una búsqueda en pacientes trasplantados cardiacos desde 1988, en seguimiento activo, de HVI apical definida por un espesor miocárdico> 15 mm en el ápex del ventrículo izquierdo o> 13 mm con una relación segmentos basales/ápex> 1,55. De un total de 233 trasplantados vivos en seguimiento se identificaron 8 casos de HVI apical (prevalencia del 3,4%). La media de edad al diagnóstico fue 56,4± 8,8 años y había una mayor proporción de mujeres que entre los pacientes sin HVI (el 62,5 frente al 26,2% respectivamente).
La causa más frecuente del trasplante en los pacientes con HVI apical fue la miocardiopatía dilatada, 5 pacientes (62,5%) (tabla 1). En la donación, ninguno de los corazones presentaba HVI significativa (en ecocardiogramas realizados en el centro de procedencia del donante) y la función ventricular se encontraba dentro de los límites normales. Todos los pacientes recibieron un régimen inmunosupresor después del trasplante que incluía tratamiento con un anticalcineurínico, pero en un caso este se sustituyó por everolimus antes del diagnóstico por enfermedad vascular del injerto en presencia de insuficiencia renal. En otros 2 casos se hizo un cambio de pauta a everolimus después del diagnóstico de HVI, pero no se observó una regresión significativa de esta en el tiempo de evolución hasta la fecha (1 y 2 años respectivamente). En los electrocardiogramas de todos los casos había datos de HVI con el patrón característico de aumento de voltajes y ondas T negativas gigantes en derivaciones precordiales (figura 1). La resonancia magnética cardiaca confirmó el diagnóstico en los 4 casos en que se realizó esta prueba. No se observaron aneurismas apicales en ningún paciente. Dos pacientes presentaban hipertrofia ventricular «mixta» septal y apical, sin diferencias en su forma de presentación ni su evolución. En las muestras de biopsia endomiocárdica de seguimiento de los pacientes después de un TxC, no se observaron hallazgos que indicaran fibrosis endomiocárdica, eosinofilia o fibrosis significativas.
Pacientes con hipertrofia ventricular apical después del trasplante cardiaco
| Causa del TxC | Edad al diagnóstico (años) | Sexo | FRCV | Inmunosupresión* | NYHA | EVI | Antecedentes de rechazo agudo | HVI apical (mm) | Historia de arritmias auriculares | Años de evolución desde el diagnóstico | RM cardiaca | BNP | NT-proBNP | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Isquémica | 68 | Varón | Hipertensión, dislipemia, diabetes | Ciclosporina+azatioprina | II | CAV 1 | Sin rechazo | 15 | No | 13 | — | 145 | 2.481 |
| 2 | Periparto | 46 | Mujer | Hipertensión | Tacrolimus+micofenolato | I | CAV 1 | Sin rechazo | 14 | Aleteo | 8 | Hipertrofia apical, 14 mm; sin realce tardío de gadolinio | 116 | 269 |
| 3 | Periparto | 39 | Mujer | Hipertensión | Tacrolimus+micofenolato | II | CAV 0 | Sin rechazo | 15 | No | 8 | Hipertrofia apical, 15 mm; realce tardío mesocárdico apical | 108 | 483 |
| 4 | Miocarditis | 71 | Varón | Hipertensión | Everolimus+micofenolato+prednisona | II-III | CAV 1 | 2R | 19 | No | 3 | Hipertrofia de hasta 20mm, apical con realce mesocárdico en zona de mayor hipertrofia | 458 | 4.390 |
| 5 | Dilatada idiopática | 65 | Varón | Hipertensión | Tacrolimus+micofenolato+prednisona | II-III | CAV 0 | 2R | 23 | No | 1 | — | 384 | 17.895 |
| 6 | Isquémica | 54 | Mujer | Hipertensión | Tacrolimus (cambio a everolimus)+micofenolato | II | CAV 0 | Sin rechazo | 19 | No | 3 | Hipertrofia apical, 18 mm; con realce de gadolinio mesocárdico inferolateral | 145 | 903 |
| 7 | Isquémica | 39 | Mujer | No | Tacrolimus (cambio a everolimus)+micofenolato+prednisona | II | CAV 3 | Sin rechazo | 18 | Aleteo | 14 | — | 254 | 4.655 |
| 8 | Dilatada idiopática | 65 | Mujer | No | Tacrolimus+micofenolato | II | CAV 0 | Sin rechazo | 20 | No | 6 | — | 283 | 2.930 |
BNP: propéptido natriurético cerebral; CAV: cardiac allograft vasculopathy, nomenclatura de la International Society for Heart and Lung Transplantation: CAV 0 (no significativa); CAV 1 (leve); CAV 2 (moderada), y CAV 3 (grave); EVI: enfermedad vascular del injerto; FRCV: factores de riesgo cardiovascular; NYHA: New York Heart Association; NT-proBNP: fracción aminoterminal del propéptido natriurético cerebral; RM: resonancia magnética; TxC: trasplante cardiaco.
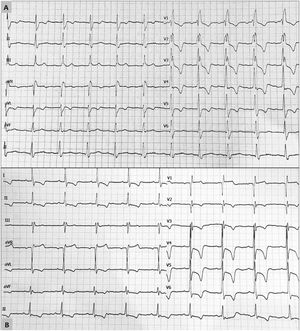
Dos electrocardiogramas con datos característicos de hipertrofia ventricular apical en 2 pacientes después del trasplante cardiaco. A: imagen de bloqueo completo de rama derecha con aumento de voltajes y criterios de hipertrofia ventricular izquierda. B: aumento de voltajes con criterios de hipertrofia ventricular izquierda e inversión profunda de ondas T en las derivaciones precordiales.
Ninguno de los pacientes con HVI apical después del trasplante tuvo hospitalizaciones por insuficiencia cardiaca ni arritmias ventriculares malignas o muerte súbita. El síntoma predominante fue la disnea de esfuerzo (7 pacientes, 87,5%). Un caso previamente publicado también mostró una evolución benigna de la HVI después del TxC6. Solo 1 paciente presentó síncopes de repetición, con un traumatismo craneoencefálico debido a uno de los episodios sincopales, y falleció por causa de una hemorragia intracraneal por este motivo.
La mayoría de los pacientes en nuestra serie no mostraron consecuencias clínicas importantes, aunque la HVI era grave en todos, y el deterioro de la clase funcional fue el síntoma más habitual. Esta evolución es comparable a la de otras cohortes de pacientes con miocardiopatía hipertrófica apical, en las que se ha descrito una mortalidad baja y eventos adversos de causa cardiovascular poco frecuentes4,5. Aunque una proporción importante de pacientes con HVI apical tenían antecedentes de hipertensión arterial, dada la localización de la HVI y los hallazgos de la resonancia magnética cardiaca, es poco probable que tal HVI fuera justificable por una causa hipertensiva. No se ha identificado una causa específica para la HVI tras excluir el rechazo o causas microbiológicas como la infección por citomegalovirus. Es importante señalar que un efecto adverso infrecuente derivado del tratamiento con anticalcineurínicos es la HVI2, que se ha descrito en pacientes que han recibido el fármaco como tratamiento inmunosupresor en procesos autoinmunitarios, neoplasias hematológicas y trasplantes de órganos sólidos. El origen de la HVI apical en estos pacientes probablemente sea multifactorial e incluya la acción de citocinas, la sobrecarga hemodinámica o una posible miocardiopatía sarcomérica en el donante que se desarrollara posteriormente. Entre las limitaciones del presente estudio, destacan el escaso número de casos con HVI apical y la disparidad en su seguimiento (entre 1 y 14 años).
La novedad de este trabajo radica en que se trata de la primera serie consecutiva de casos de pacientes con HVI apical después del TxC hasta la fecha, aunque probablemente sea una entidad infradiagnosticada. La evolución fue benigna en la mayoría de los casos.