99mTc-PYP pirofosfato de tecnecio asistencia circulatoria mecánica anticoagulante oral de acción directa apnea central del sueño ácido desoxirribonucleico aurícula izquierda antiinflamatorios no esteroideos anticuerpos anticitoplasma de neutrófilos área del orificio regurgitante efectivo apnea obstructiva del sueño arteria pulmonar antagonistas del receptor de la angiotensina II ácido ribonucleico de unión al motivo 20 antagonistas del receptor de mineralcortidoides ácido ribonucleico ácido ribonucleico mensajero auriculoventricular antagonistas de la vitamina K bloqueadores de los canales del calcio balón de contrapulsación intraaórtico biopsia endomiocárdica péptido natriurético cerebral bloqueo de rama izquierda cirugía de revascularización coronaria citomegalovirus enfermedad coronavírica de 2019 cardiovascular contracción ventricular prematura insuficiencia cardiaca, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer) dispositivo de asistencia biventricular desfibrilador automático implantable dispositivo de asistencia ventricular dispositivo de asistencia ventricular derecha dispositivo de asistencia ventricular izquierda diabetes mellitus tipo 2 diámetro telediastólico del VI velocidad temprana de llenado en Doppler transmitral/velocidad temprana de relajación en Doppler tisular enfermedad coronaria enzima de conversión de la angiotensina ensayo controlado con distribución aleatoria electrocardiograma oxigenador extracorpóreo de membrana European Heart Rhythm Association Agencia Europea de Medicamentos enfermedad pulmonar obstructiva crónica enfermedad renal crónica Sociedad Europea de Cardiología fibrilación auricular Food and Drug Administration fracción de eyección fracción de eyección del ventrículo izquierdo fracción de oxígeno inspirada sobrepeso (IMC > 30), hipertensión (al menos 2 fármacos antihipertensivos), fibrilación auricular (paroxística o persistente), hipertensión pulmonar (presión arterial pulmonar sistólica por ecocardiografía Doppler > 35 mmHg), edad avanzada (edad > 60 años), presión de llenado (E/e’ calculada por ecocardiografía Doppler > 9) (escala) glucohemoglobina heparina de bajo peso molecular algoritmo diagnóstico de la Heart Failure Association de la ESC —P: evaluación inicial (paso 1: evaluación pretest); E: proceso diagnóstico (paso 2: escala ecocardiográfica y péptidos natriuréticos); F1: evaluación avanzada (paso 3: pruebas funcionales en caso de dudas) y F2: evaluación etiológica (paso 4: etiología final) hazard ratio hipertrofia ventricular izquierda intravenoso infarto agudo de miocardio con elevación del segmento ST insuficiencia cardiaca insuficiencia cardiaca aguda insuficiencia cardiaca crónica insuficiencia cardiaca con fracción de eyección conservada insuficiencia cardiaca con fracción de eyección ligeramente reducida insuficiencia cardiaca con fracción de eyección reducida intervención coronaria percutánea inhibidor de la enzima de conversión de la angiotensina infarto de miocardio índice de masa corporal razón internacional normalizada inhibidores de la neprilisina y el receptor de la angiotensina inhibidor del sistema renina-angiotensina-aldosterona latido ventricular prematuro miocardiopatía arritmogénica del ventrículo derecho miocardiopatía arritmogénica miocardiopatía dilatada miocardiopatía hipertrófica región media del propéptido natriurético auricular fracción N-terminal del propéptido natriurético cerebral New York Heart Association Organización Mundial de la Salud modificada presión arterial presión parcial de oxígeno presión arterial sistólica presión parcial de dióxido de carbono reacción en cadena de la polimerasa presión de enclavamiento capilar tomografía por emisión de positrones péptido natriurético presión telediastólica del VD presión telediastólica del VI consumo máximo de oxígeno durante el ejercicio ondas Q, R y S en el ECG resonancia magnética resonancia magnética cardiaca reemplazo quirúrgico de válvula aórtica realce tardío de gadolinio síndrome respiratorio agudo grave por coronavirus 2 saturación de transferrina síndrome coronario agudo síndrome coronario crónico subunidad alfa del canal de sodio cardiaco 5 cotransportador de sodio-glucosa tipo 2 tomografía por emisión monofotónica saturación periférica de oxígeno sistema renina-angiotensina-aldosterona predicción del riesgo de mortalidad de la Society of Thoracic Surgeons soporte vital extracorpóreo implante percutáneo de válvula aórtica tomografía computarizada tasa de filtrado glomerular estimada tratamiento médico óptimo troponina T terapia de resincronización cardiaca terapia de resincronización cardiaca con desfibrilador terapia de resincronización cardiaca con marcapasos receptor de potencial transitorio de subfamilia M, miembro 4 terapia de reemplazo renal tirotropina transtirretina amiloidosis cardiaca por transtirretina unidad de cuidados coronarios unidad de cuidados intensivos Unión Europea ventrículo derecho ventrículo izquierdo virus de la inmunodeficiencia humana consumo de oxígeno
Las guías de práctica clínica (GPC) tienen como objetivo reunir y evaluar toda la evidencia relevante disponible durante el proceso de elaboración sobre un tema particular para ayudar a los médicos a seleccionar la mejor estrategia posible de tratamiento para un paciente en particular, que sufre una enfermedad determinada, no solo teniendo en cuenta el resultado final, sino también sopesando los riesgos y los beneficios de un procedimiento diagnóstico o terapéutico concreto. Las GPC deben ayudar a los profesionales de la salud en la toma de decisiones clínicas en su ejercicio diario. No obstante, la decisión final sobre un paciente concreto la debe tomar el médico responsable de su salud, en consulta con el propio paciente y, si fuera necesario, con su representante legal.
En los últimos años, la Sociedad Europea de Cardiología (ESC), además de otras sociedades y organizaciones científicas, han publicado un gran número de GPC. Debido al impacto de las GPC, se han establecido criterios de calidad para su elaboración de modo que todas las decisiones se presenten de manera clara y transparente al usuario. Las recomendaciones de la ESC para la elaboración y publicación de GPC están disponibles en la sección de guías de la página web de la ESC (https://www.escardio.org/Guidelines). Las GPC representan la postura oficial de la ESC sobre un tema particular y se actualizan con regularidad.
La ESC lleva a cabo el EURObservational Research Programme sobre registros internacionales de enfermedades e intervenciones cardiovasculares que son esenciales para evaluar los procesos diagnósticos y terapéuticos, el consumo de recursos y la adherencia a las recomendaciones de las guías. El objetivo de estos registros es comprender mejor la práctica clínica en Europa y en el mundo con base en los datos recogidos en la práctica clínica cotidiana.
En esta guía la ESC ha desarrollado e integrado un paquete de indicadores de calidad que sirven para evaluar el nivel de implementación y pueden emplear la ESC, los hospitales y los proveedores y profesionales de la salud, así como programas formativos, junto con los mensajes clave para medir y mejorar la calidad de la atención y los resultados clínicos.
Los miembros de este Grupo de Trabajo, entre los que se incluyen representantes de los grupos de subespecialidades, fueron seleccionados por la ESC en representación de los profesionales de la salud dedicados a los cuidados médicos de la patología tratada en el presente documento. Los expertos seleccionados llevaron a cabo una revisión exhaustiva de la evidencia publicada sobre el diagnóstico, el tratamiento y la prevención de esta entidad concreta según las normas establecidas por el Comité de la ESC para la Elaboración de GPC. Se realizó una evaluación crítica de los procedimientos diagnósticos y terapéuticos, además de la relación entre el riesgo y el beneficio. Se valoraron el nivel de evidencia y la fuerza de la recomendación de una opción terapéutica particular de acuerdo con escalas predefinidas, tal como se indica en las tablas 1 y 2.
Los expertos responsables de la redacción y la revisión del documento han declarado por escrito cualquier relación que se pueda considerar conflicto de intereses real o potencial. Estas declaraciones escritas están archivadas y disponibles en la página web de la ESC (http://www.escardio.org/guidelines); además, se han recogido en un informe publicado al mismo tiempo que la guía con el objetivo de garantizar la transparencia del proceso y prevenir sesgos potenciales durante el desarrollo y revisión de la guía. Durante el periodo de redacción, las modificaciones en las relaciones que se pudiera considerar conflicto de intereses se notificaron a la ESC y se actualizaron. El informe del Grupo de Trabajo fue financiado en su totalidad por la ESC y se desarrolló sin ninguna participación de la industria.
El Comité para la elaboración de GPC de la ESC supervisó y coordinó la preparación de esta nueva edición. El Comité es responsable también del proceso de aprobación de las GPC. Expertos externos revisaron exhaustivamente el documento, tras lo cual fue aprobado por todos los miembros del Grupo de Trabajo. Por último, el documento final fue aprobado por el Comité de GPC de la ESC para su publicación en European Heart Journal. La guía se desarrolló tras la evaluación exhaustiva de los datos científicos, el conocimiento médico y la evidencia disponible en el momento de su elaboración.
La tarea de elaboración de GPC incluye no solo la integración de la investigación más reciente, sino también la creación de instrumentos formativos y programas de implementación de las recomendaciones. Para su implementación, se desarrollan ediciones de bolsillo, resúmenes en diapositivas, folletos con mensajes clave y versiones electrónicas para aplicaciones digitales (smartphones, etc.).
Estas versiones son resumidas y, por lo tanto, en caso de necesidad, debe consultarse la versión completa que se encuentra disponible gratuitamente en las páginas web de la ESC y European Heart Journal. Se recomienda a las sociedades nacionales que forman parte de la ESC suscribir, traducir e implementar las GPC de la ESC. Los programas de implementación son necesarios porque se ha demostrado que los resultados clínicos se ven favorablemente influidos por la aplicación de las recomendaciones clínicas.
Se recomienda a los profesionales de la salud que tengan en consideración la presente guía de la ESC en la toma de decisiones clínicas en su ejercicio diario, así como en la determinación y la implementación de estrategias preventivas, diagnósticas y terapéuticas; no obstante, la decisión final sobre el cuidado de un paciente concreto, en consulta con dicho paciente y, si fuera necesario, con su representante legal, debe tomarla el médico responsable de su cuidado. Además, es responsabilidad del profesional de la salud comprobar la normativa aplicable a fármacos y dispositivos médicos antes de su prescripción.
2INTRODUCCIÓNEl objetivo de esta guía de la ESC es ayudar a los profesionales de la salud a tratar a personas con insuficiencia cardiaca (IC) según la evidencia científica disponible. Actualmente existen numerosos ensayos clínicos que permiten seleccionar la mejor estrategia de tratamiento para mejorar la evolución de los pacientes con IC. Para muchos de estos pacientes hoy en día la IC es prevenible y tratable. Esta guía proporciona recomendaciones prácticas basadas en la evidencia.
Se ha cambiado el formato de la edición de la guía de 20161 para diferenciar cada fenotipo específico de la IC en términos de diagnóstico y tratamiento. Las recomendaciones sobre tratamiento, que se presentan en tablas, incluyen el efecto del tratamiento basado en la clase y el nivel de la evidencia. Para la IC con fracción de eyección reducida (IC-FEr), las recomendaciones se centran en los resultados de mortalidad y morbilidad. Cuando existen beneficios relativos a los síntomas, estos aparecen resaltados en el texto de la guía y en los anexos de la web. Estos anexos también recogen resúmenes de los estudios en que se apoyan las recomendaciones. En cuanto a las indicaciones sobre el diagnóstico, se proponen pruebas que se debe hacer a todos los pacientes con IC y pruebas para circunstancias específicas. Dado que las pruebas diagnósticas rara vez han sido objeto de estudio en ensayos clínicos con distribución aleatoria (ECDA), la mayor parte de la evidencia se considera de nivel C. Esto no implica que las pruebas diagnósticas no se hayan evaluado rigurosamente.
Esta guía se centra en el diagnóstico y el tratamiento de la IC, no en su prevención. El control de los factores de riesgo y el tratamiento de las enfermedades cardiovasculares (especialmente la hipertensión sistémica, la diabetes mellitus, la enfermedad coronaria [EC], el infarto de miocardio, la fibrilación auricular [FA] y la disfunción ventricular izquierda asintomática) reducen el riesgo de IC. Estas cuestiones se tratan en numerosas guías de la ESC y en la sección 9.1 de este documento2−7.
Esta guía es el resultado de la colaboración entre el Grupo de Trabajo (que incluye a 2 representantes de los pacientes), los revisores y el CGPC de la ESC y recoge la opinión consensuada y mayoritaria de los expertos consultados durante su elaboración.
2.1¿Qué hay nuevo en la edición de 2021?Además de las recomendaciones enumeradas a continuación, la siguiente tabla recoge algunos conceptos nuevos respecto a la edición de 2016.
Conceptos nuevos.
| Sustitución del término «insuficiencia cardiaca con fracción de eyección en rango medio» por «insuficiencia cardiaca con fracción de eyección ligeramente reducida» (IC-FElr) |
|---|
| Nuevo algoritmo simplificado de tratamiento para la IC-FEr |
| Nuevo algoritmo de tratamiento según los fenotipos |
| Modificación de la clasificación de la IC aguda (ICA) |
| Actualización de los tratamientos de las comorbilidades no cardiovasculares, como diabetes, hiperpotasemia, déficit de hierro y cáncer |
| Actualización de las miocardiopatías, el papel de las pruebas genéticas y nuevos tratamientos |
| Inclusión de los indicadores de calidad más importantes |
Nuevas recomendaciones.
| Recomendaciones | Clase |
|---|---|
| Recomendaciones para el diagnóstico de la IC | |
| Se debe considerar el cateterismo de corazón derecho para los pacientes con IC causada probablemente por pericarditis constrictiva, miocardiopatía restrictiva, cardiopatía congénita y estados de gasto cardiaco elevado | IIa |
| Se puede considerar el cateterismo de corazón derecho para pacientes con IC-FEc seleccionados para confirmar el diagnóstico | IIb |
| Recomendaciones para el tratamiento de la IC crónica | |
| IC-FEr | |
| Se recomienda el tratamiento con dapagliflozina o empagliflozina para los pacientes con IC-FEr para reducir el riesgo de hospitalización por IC y muerte | I |
| Se puede considerar la administración de vericiguat para pacientes en NYHA II-IV cuya IC ha empeorado a pesar del tratamiento con un IECA (o INRA), un bloqueador beta y un ARM, para reducir el riesgo de muerte CV y hospitalización por IC | IIb |
| IC-FElr | |
| Se puede considerar un IECA para pacientes con IC-FElr para reducir el riesgo de hospitalización por IC y muerte | IIb |
| Se puede considerar un ARA-II para pacientes con IC-FElr para reducir el riesgo de hospitalización por IC y muerte | IIb |
| Se puede considerar un bloqueador beta para pacientes con IC-FElr para reducir el riesgo de hospitalización por IC y muerte | IIb |
| Se puede considerar un ARM para pacientes con IC-FElr para reducir el riesgo de hospitalización por IC y muerte | IIb |
| Se puede considerar sacubitrilo-valsartán para pacientes con IC-FElr para reducir el riesgo de hospitalización por IC y muerte | IIb |
| IC-FEc | |
| Se recomienda el cribado y el tratamiento de las etiologías y las comorbilidades cardiovasculares y no cardiovasculares para los pacientes con IC-FEc (véase las correspondientes secciones de la guía) | I |
| Prevención y monitorización | |
| Se recomiendan estrategias de autocuidado para reducir el riesgo de hospitalización por IC y muerte | I |
| Los programas de atención domiciliaria o en consulta mejoran los resultados y están recomendados para reducir el riesgo de hospitalización por IC y muerte | I |
| Se debe considerar la inmunización contra la gripe y la enfermedad neumocócica para prevenir las hospitalizaciones por IC | IIa |
| Se debe considerar un programa de rehabilitación cardiaca basada en el ejercicio supervisado para pacientes con enfermedad más avanzada, fragilidad o comorbilidades | IIa |
| Se puede considerar la telemonitorización domiciliaria no invasiva para pacientes con IC para reducir el riesgo de hospitalizaciones recurrentes por IC o ECV y muerte CV | IIb |
| Recomendaciones para el tratamiento de los pacientes con IC avanzada | |
| Los pacientes valorados para ACM a largo plazo deben tener buena adherencia al tratamiento, una capacidad adecuada para el manejo del dispositivo y apoyo psicológico | I |
| Se recomienda el trasplante cardiaco para los pacientes con IC avanzada refractaria al tratamiento con fármacos o dispositivos que no tengan contraindicaciones absolutas | I |
| Se puede considerar el tratamiento continuo con inotrópicos y vasopresores para pacientes con gasto cardiaco bajo y evidencia de hipoperfusión de órganos vitales como tratamiento puente a la ACM o el trasplante cardiaco | IIb |
| Recomendaciones para la atención de los pacientes tras la hospitalización por IC | |
| Se recomienda el examen minucioso de los pacientes hospitalizados por IC para descartar signos persistentes de congestión antes del alta y optimizar el tratamiento oral | I |
| Se recomienda administrar antes del alta tratamiento oral basado en la evidencia | I |
| Se recomienda una consulta de seguimiento 1 o 2 semanas después del alta para valorar signos de congestión, la tolerancia al tratamiento farmacológico e iniciar o aumentar el tratamiento basado en la evidencia | I |
| Recomendaciones para el tratamiento de los pacientes con IC y FA | |
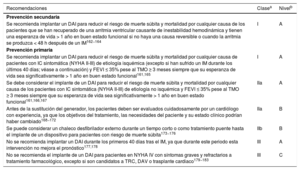
| Se debe considerar el tratamiento anticoagulante oral a largo plazo para la prevención del ictus en pacientes con FA y puntuación CHA2DS2-VASc 1 los varones y 2 las mujeres | IIa |
| Recomendaciones para el tratamiento de los pacientes con IC y SCC | |
| Se debe considerar la CABG como estrategia de revascularización de primera elección para los pacientes candidatos a cirugía, especialmente para aquellos con diabetes o enfermedad multivaso | IIa |
| Para candidatos a DAVI que requieren revascularización coronaria, se debe evitar la CABG siempre que sea posible | IIa |
| Se puede considerar la revascularización coronaria para mejorar los resultados de los pacientes con IC-FEr, SCC y anatomía coronaria adecuada para revascularización, tras la evaluación del riesgo-beneficio individual, incluida la anatomía coronaria (estenosis proximal>90% en vasos grandes, estenosis en tronco común o estenosis proximal en descendente anterior izquierda), comorbilidades, esperanza de vida y perspectivas del paciente | IIb |
| Se puede considerar la ICP como alternativa a la CABG según la evaluación del equipo cardiológico y teniendo en cuenta la anatomía coronaria, las comorbilidades y el riesgo quirúrgico | IIb |
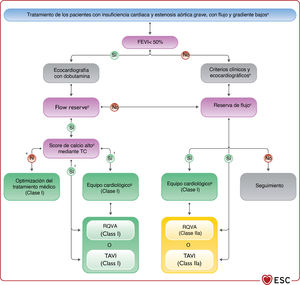
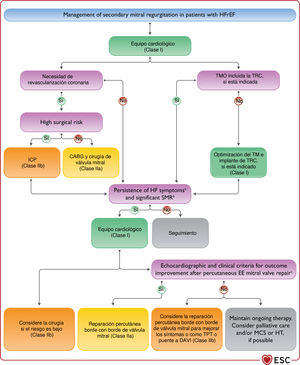
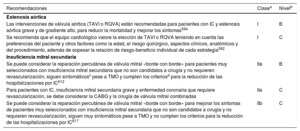
| Recomendaciones para el tratamiento de los pacientes con IC y valvulopatías | |
| Se recomienda la intervención de válvula aórtica (TAVI o RQVA) para los pacientes con IC y estenosis aórtica avanzada de gradiente alto para reducir la mortalidad y mejorar los síntomas | I |
| Se recomienda que el equipo cardiológico decida la elección entre TAVI o RQVA teniendo en cuenta las preferencias del paciente y aspectos como la edad, el riesgo quirúrgico, aspectos clínicos, anatómicos y del procedimiento, además de valorar los riesgos y los beneficios de cada estrategia | I |
| Se debe considerar la reparación percutánea de la válvula mitral «borde con borde» para pacientes seleccionados con insuficiencia mitral secundaria que no sean candidatos a cirugía y no requieran revascularización coronaria, permanezcan sintomáticos a pesar del TMO y cumplan los criterios para la reducción de las hospitalizaciones por IC | II |
| Se puede considerar la reparación percutánea de la válvula mitral «borde con borde» para mejorar los síntomas de pacientes seleccionados con insuficiencia mitral secundaria que no sean candidatos a cirugía y no requieran revascularización coronaria, permanezcan muy sintomáticos a pesar del TMO y no cumplan los criterios para la reducción de las hospitalizaciones por IC | IIb |
| Recomendaciones para el tratamiento de los pacientes con IC y diabetes | |
| Se recomienda el tratamiento con inhibidores del SGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) para pacientes con DM2 y riesgo de complicaciones CV para reducir las hospitalizaciones por IC, las complicaciones CV mayores, la disfunción renal grave y la muerte CV | I |
| Se recomienda el tratamiento con inhibidores del SGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) para pacientes con DM2 e IC-FEr para reducir las hospitalizaciones por IC y la muerte CV | I |
| La saxagliptina, un inhibidor de la DPP-4, no está recomendada para pacientes con IC | III |
| Recomendaciones para el tratamiento de los pacientes con IC y déficit de hierro | |
| Se recomienda el cribado periódico de la anemia y el déficit de hierro con recuento sanguíneo completo, concentración sérica de ferritina y Sat-T para todos los pacientes con IC | I |
| Se debe considerar la administración intravenosa de un suplemento de hierro con carboximaltosa férrica para pacientes con IC sintomática recientemente hospitalizados con FEVI ≤ 50% y déficit de hierro, definido como ferritina sérica < 100ng/ml o ferritina sérica 100-299ng/ml con Sat-T<20%, para reducir el riesgo de hospitalización por IC | IIa |
| No se recomienda el tratamiento de la anemia con estimuladores de la eritropoyetina en la IC si no hay otras indicaciones para este tratamiento | III |
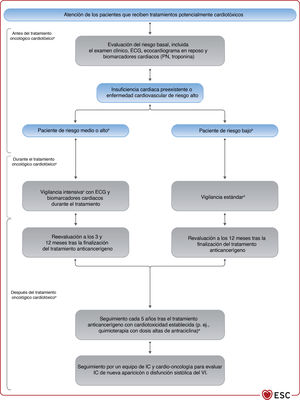
| Recomendaciones para el tratamiento de los pacientes con IC y cáncer | |
| Se recomienda que los pacientes con cáncer y riesgo aumentado de cardiotoxicidad, definida como antecedentes o factores de riesgo de ECV, cardiotoxicidad previa o exposición a fármacos cardiotóxicos, sean evaluados antes de iniciarse el tratamiento oncológico, preferiblemente por un cardiólogo con experiencia e interés en cardio-oncología | I |
| Se debe considerar el tratamiento con un IECA y un bloqueador beta (preferiblemente carvedilol) para los pacientes con cáncer y disfunción sistólica del VI, definida como una disminución ≥ 10% de la FEVI o a un valor < 50% durante la quimioterapia con antraciclina | IIa |
| Se debe considerar la evaluación basal del riesgo CV de todo paciente con cáncer que vaya a recibir algún tratamiento oncológico que pueda causar IC | IIa |
| Recomendaciones para el tratamiento de los pacientes con IC y amiloidosis | |
| Se recomienda el tafamidis para los pacientes con miocardiopatía por TTR hereditaria demostrada en pruebas genéticas y síntomas de clase I o II de la NYHA, para mejorar los síntomas y reducir las hospitalizaciones y la muerte CV | I |
| Se recomienda el tafamidis para los pacientes con miocardiopatía por TTR hereditaria (wild type) y síntomas de NYHA I-II, para mejorar los síntomas y reducir las hospitalizaciones y la muerte CV | I |
ACM: asistencia circulatoria mecánica; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; CABG: cirugía de revascularización coronaria; CHA2DS2-VASc: insuficiencia cardiaca, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer); CV: cardiovascular; DAVI: dispositivo de asistencia ventricular izquierda; DM2: diabetes mellitus tipo 2; DPP-4: dipeptidil peptidasa 4; ECV: enfermedad cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; hTTR: transtirretina hereditaria; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; IECA: inhibidor de la enzima de conversión de la angiotensina; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; RQVA: reemplazo quirúrgico de válvula aórtica; Sat-T: saturación de transferrina; SCC: síndrome coronario crónico; SGLT2: cotransportador de sodio-glucosa tipo 2; TAVI: implante percutáneo de válvula aórtica; TMO: tratamiento médico óptimo; TTR-CA: amiloidosis cardiaca por transtirretina; VI: ventrículo izquierdo.
Cambios en las recomendaciones.
| 2021 | Clase | 2016 | Clase |
|---|---|---|---|
| Recomendaciones para el diagnóstico de la IC | |||
| Se puede considerar la coronariografía invasiva para pacientes con IC-FEr, una probabilidad pretest intermedia o alta de EC e isquemia documentada en prueba de estrés no invasiva | IIb | Se debe considerar la coronariografía invasiva en pacientes con IC, una probabilidad pretest intermedia o alta de EC e isquemia documentada en prueba de estrés no invasiva (que se consideran posibles candidatos a revascularización coronaria), con el objetivo de establecer el diagnóstico de EC y su gravedad | IIa |
| Se debe considerar la angio-TC para pacientes con una probabilidad pretest baja o intermedia de EC o con resultados dudosos en pruebas de estrés no invasivas para descartar la presencia de estenosis coronaria | IIa | Se puede considerar la TC cardiaca para pacientes con IC y una probabilidad pretest baja o intermedia de EC o para aquellos con resultados dudosos en pruebas de estrés no invasivas para descartar la presencia de estenosis coronaria | IIb |
| Se puede considerar el cateterismo de corazón derecho para pacientes con sospecha de hipertensión pulmonar, evaluada mediante ecocardiografía, para confirmar el diagnóstico y valorar su reversibilidad antes de la corrección de la enfermedad valvular o estructural | IIb | Se debe considerar el cateterismo de corazón derecho con catéter arterial pulmonar para pacientes con sospecha de hipertensión pulmonar, evaluada mediante ecocardiografía, para confirmar el diagnóstico de hipertensión pulmonar y valorar su reversibilidad antes de la corrección de la enfermedad valvular o estructural | IIa |
| Recomendaciones sobre tratamiento con dispositivos en la IC-FEr | |||
| Se debe considerar un DAI para reducir el riesgo de muerte súbita y por cualquier causa de los pacientes con IC sintomática (NYHA II-III) de etiología no isquémica y FEVI ≤ 35%, a pesar al menos 3 meses de TMO siempre que se considere que la esperanza de vida del paciente sea sustancialmente superior a 1 año con un estado funcional bueno | IIa | Prevención primariaSe recomienda el uso de un DAI para reducir el riesgo de muerte súbita y muerte por todas las causas en pacientes con IC sintomática (NYHA II-III) y FEVI ≤ 35%, a pesar de recibir TMO ≥ 3 meses, siempre que se considere que la esperanza de vida del paciente sea sustancialmente superior a 1 año con un estado funcional bueno y tenga miocardiopatía dilatada | I |
| Se debe considerar la TRC para pacientes sintomáticos con IC en ritmo sinusal, un QRS de 130-149 ms y morfología de BRI con FEVI ≤ 35% a pesar de TMO para mejorar los síntomas y reducir la morbimortalidad | IIa | Se recomienda la TRC para pacientes sintomáticos con IC en ritmo sinusal, un QRS de 130-149 ms y morfología de BRI con FEVI ≤ 35% a pesar de TMO para mejorar los síntomas y reducir la morbimortalidad | I |
| Se debe valorar para TRC a los pacientes con FEVI ≤ 35% receptores de un marcapasos convencional o un DAI que después sufren un empeoramiento de la IC a pesar de TMO y reciben un alto porcentaje de estimulación del VD | IIa | Se debe valorar para TRC a los acientes con IC-FEr receptores de un marcapasos convencional o DAI que después sufren un empeoramiento de la IC a pesar de TMO y reciben un alto porcentaje de estimulación del VD. Esto no debe aplicarse a los pacientes con IC estable | IIb |
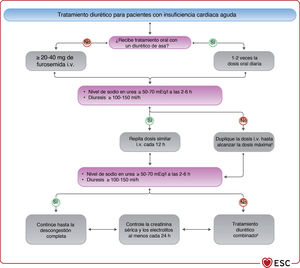
| Recomendaciones para el tratamiento de pacientes con IC aguda | |||
| Se debe considerar la combinación de un diurético del asa con una tiacida para pacientes con edema persistente que no responde a un aumento de las dosis del diurético del asa | IIa | Se puede considerar la combinación de un diurético del asa con una tiacida o espironolactona para pacientes con edema persistente o una respuesta sintomática insuficiente | IIb |
| Para los pacientes con ICA y PAS>110mmHg, se puede considerar la administración intravenosa de vasodilatadores como tratamiento inicial para mejorar los síntomas y reducir la congestión | IIb | Para pacientes con ICA hipertensiva, se puede considerar la administración intravenosa de vasodilatadores como tratamiento inicial para mejorar los síntomas y reducir la congestión | IIa |
| No se recomienda la prescripción sistemática de opiáceos, excepto para pacientes seleccionados con dolor intenso o intratable o ansiedad | III | Se puede considerar el uso prudencial de opiáceos para aliviar la disnea y la ansiedad en pacientes con disnea grave, aunque pueden producirse náuseas e hipopnea | IIb |
| Se debe considerar la ACM a corto plazo para pacientes en shock cardiogénico como tratamiento «puente hasta la recuperación», «puente hasta la decisión» o «puente a tratamiento». Otras indicaciones incluyen el tratamiento de la causa del shock cardiogénico, ACM a largo plazo o trasplante | IIa | Se puede considerar la ACM a corto plazo para pacientes en shock cardiogénico refractario, dependiendo de la edad, las comorbilidades y la función neurológica | IIb |
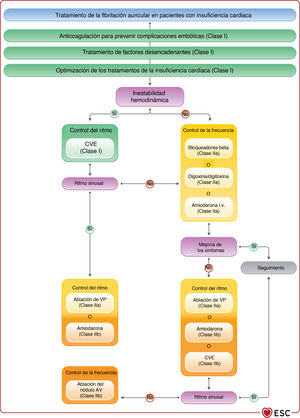
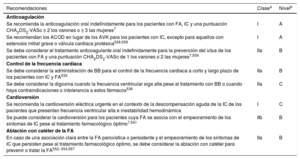
| Recomendaciones para el tratamiento de pacientes con IC y FA | |||
| Los anticoagulantes orales de acción directa son preferibles a los AVK para pacientes con IC, excepto para aquellos con estenosis mitral moderada o grave o prótesis valvular mecánica | I | Para pacientes con IC y FA no valvular candidatos a anticoagulación según la puntuación CHA2DS2-VASc, se debe considerar el tratamiento con NACO, en lugar de warfarina, pues se asocian con reducciones en los riesgos de ictus, hemorragia intracraneal y mortalidad que superan el aumento del riesgo de hemorragia gastrointestinal | IIa |
| Se debe considerar los bloqueadores beta a corto y largo plazo para el control de la frecuencia cardiaca de los pacientes con IC y FA | IIa | Para los pacientes en NYHA I-III, un bloqueador beta, normalmente por vía oral, es seguro y, por lo tanto, se recomienda como tratamiento de primera línea para controlar la frecuencia cardiaca siempre que el paciente esté euvolémico | I |
| En caso de una asociación clara entre la FA paroxística o persistente y unos síntomas de empeoramiento de la IC que persisten a pesar del tratamiento farmacológico, se debe considerar la ablación con catéter para prevenir o tratar la FA | IIa | Se puede considerar la ablación por catéter del NAV para controlar la frecuencia cardiaca y aliviar los síntomas de los pacientes que no responden o no toleran el tratamiento farmacológico intensivo para el control del ritmo y la frecuencia, aceptando que estos pacientes dependerán del marcapasos | IIb |
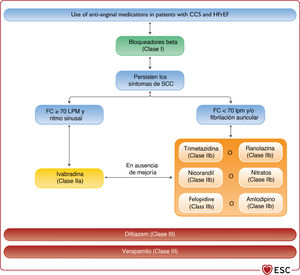
| Recomendaciones para el tratamiento de los pacientes con IC y SCC | |||
| Se debe considerar la revascularización coronaria para aliviar los síntomas de angina (o equivalentes a la angina) que persisten pese al TMO, incluidos fármacos antianginosos, para los pacientes con IC-FEr, SCC y anatomía coronaria adecuada para revascularización | IIa | Se recomienda la revascularización miocárdica cuando persista la angina a pesar del tratamiento con fármacos antiaginosos | I |
| Recomendaciones para el tratamiento de los pacientes con IC y diabetes | |||
| Se recomienda el tratamiento con inhibidores del SGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) para pacientes con DM2 y riesgo de complicaciones CV para reducir las hospitalizaciones por IC, las complicaciones CV mayores, la disfunción renal grave y la muerte CV | I | Se debe considerar el tratamiento con empagliflozina para pacientes con DM2 para prevenir o retrasar la aparición de IC y prolongar la vida | IIa |
ACM: asistencia circulatoria mecánica; AVK: antagonistas de la vitamina K; BRI: bloqueo de rama izquierda; CHA2DS2-VASc: insuficiencia cardiaca, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer); CV: cardiovascular; DAI: desfibrilador automático implantable; DM2: diabetes mellitus tipo 2; EC: enfermedad coronaria; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICA: insuficiencia cardiaca aguda; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NACO: nuevos anticoagulantes orales no dependientes de la vitamina K; NAV: nódulo auriculoventricular; NYHA: clase funcional de la New York Heart Association; PAS: presión arterial sistólica; QRS: ondas Q, R y S del ECG; SCC: síndrome coronario crónico; SGLT2: cotransportador de sodio-glucosa tipo 2; TC: tomografía computarizada; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
La IC no es un diagnóstico patológico único, sino que se trata de un síndrome clínico caracterizado por síntomas típicos (disnea, inflamación de tobillos y fatiga) que puede acompañarse de signos como presión yugular elevada, crepitantes pulmonares y edema periférico, causados por una anomalía cardiaca estructural o funcional que producen una elevación de las presiones intracardiacas o un gasto cardiaco inadecuado en reposo o durante el ejercicio.
La identificación de la etiología de la disfunción cardiaca subyacente es fundamental para el diagnóstico de la IC, ya que la afección específica puede determinar el tratamiento. Normalmente, la IC está causada por una disfunción miocárdica, ya sea sistólica, diastólica o ambas. No obstante, las anomalías de válvulas, pericardio, endocardio, ritmo cardiaco y conducción también pueden causar o contribuir a la IC.
3.2Terminología3.2.1Insuficiencia cardiaca con fracción de eyección conservada, ligeramente reducida y reducidaTradicionalmente, la IC se ha dividido en distintos fenotipos basados en la medición de la fracción de eyección (FE) del ventrículo izquierdo (FEVI) (tabla 3). Los fundamentos de esta clasificación se basan en los primeros ensayos clínicos sobre el tratamiento de la IC que demostraron resultados significativamente mejores en los pacientes con FEVI ≤ 40%. Sin embargo, la IC abarca todo el espectro de FEVI (una variable de distribución normal), que medida mediante ecocardiografía es objeto de una gran variabilidad. Se propone la siguiente clasificación de la IC (tabla 3):
- •
La FEVI reducida se define como ≤ 40%, es decir, los pacientes tienen una reducción significativa de la función sistólica del VI, y se designa como IC-FEr.
- •
Los pacientes con FEVI del 41-49% tienen la función sistólica del VI ligeramente reducida (designada como IC-FElr). Los análisis retrospectivos de ECDA sobre la IC-FEr o la IC con FE conservada (IC-FEc) que incluyeron a pacientes con FEVI del 40-50% indican que estos pacientes podrían beneficiarse de tratamientos similares a los de los pacientes con FEVI ≤ 40%8−13. Esto justifica el cambio de denominación de «insuficiencia cardiaca con fracción de eyección en rango medio» a «insuficiencia cardiaca con fracción de eyección ligeramente reducida» (IC-FElr)14.
- •
Los pacientes con síntomas y signos de IC, evidencia de anomalías cardiacas estructurales o funcionales o altas concentraciones de péptidos natriuréticos y FEVI ≥ 50% tienen IC-FEc.
El diagnóstico de la IC-FEr, la IC-FElr y la IC-FEc se aborda con más detalle en las respectivas secciones (secciones 5, 7 y 8). Estas definiciones son compatibles con el informe sobre la Definición Universal de la Insuficiencia Cardiaca publicado recientemente15.
Los pacientes con enfermedad no cardiaca, como anemia o enfermedad pulmonar, renal, tiroidea o hepática, pueden presentar síntomas y signos muy similares a los de la IC, pero sin un diagnóstico de disfunción cardiaca no cumplen los criterios de la IC. No obstante, estas enfermedades pueden coexistir con la IC y exacerbar el síndrome de IC.
3.2.2Disfunción del ventrículo derechoLa IC también puede estar causada por disfunción del ventrículo derecho (VD). La mecánica y la función del VD aparecen alteradas en presencia de sobrecarga de presión o de volumen16. Aunque la etiología principal de la insuficiencia crónica del VD es la hipertensión pulmonar inducida por la disfunción del VI, existen también otras causas, como el infarto de miocardio, la miocardiopatía arritmogénica del VD o las valvulopatías17. El diagnóstico se establece evaluando la función global del VD, generalmente con ecocardiografía, según una de las siguientes mediciones: el cambio fraccional del área, el desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE) y la velocidad sistólica del anillo tricuspídeo derivada de Doppler tisular (S’). El diagnóstico y el tratamiento de la disfunción del VD se tratan en detalle en un reciente documento de posición de la Heart Failure Association (HFA)18.
3.2.3Otra terminología usada frecuentemente en la insuficiencia cardiacaLa IC normalmente tiene 2 presentaciones: crónica (ICC) y aguda (ICA). La ICC describe a los pacientes que tienen un diagnóstico de IC establecido o un desarrollo gradual de los síntomas. Cuando se produce un deterioro de la IC, ya sea repentina o lentamente, el episodio se puede describir como IC «descompensada», que puede requerir la hospitalización del paciente o tratamiento diurético intravenoso en consulta ambulatoria. Además, la IC puede ser de presentación más aguda. Ambas entidades se tratan en la sección 11 dedicada a la ICA.
Algunos individuos pueden tener IC por un problema que se resuelve por completo (p. ej., miocardiopatía inducida por alcohol, miocarditis viral, síndrome de tako-tsubo, miocardiopatía periparto o taquimiocardiopatía). Otros pacientes con disfunción sistólica del VI pueden recuperar sustancial o completamente la función sistólica tras recibir tratamiento farmacológico y con dispositivos.
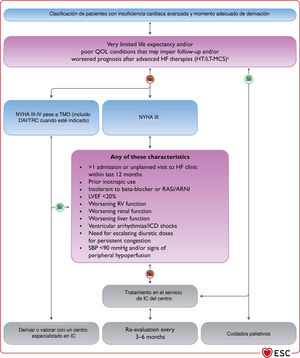
3.2.4Terminología relacionada con la gravedad de los síntomas de la insuficiencia cardiacaLa terminología más simple empleada para describir el grado de IC es la clasificación funcional de la New York Heart Association (NYHA) (tabla 4). Esta clasificación, sin embargo, se basa únicamente en los síntomas, cuando existen otros indicadores pronósticos de la IC más sensibles19. De hecho, los pacientes con síntomas leves pueden tener un riesgo alto de hospitalización y muerte20. La predicción de los resultados tiene una importancia especial en la IC avanzada para guiar la selección de la terapia con dispositivos y el trasplante. Estos aspectos se abordan con más detalle en la sección 10 dedicada a la IC avanzada.
3.3Epidemiología e historia natural de la insuficiencia cardiaca3.3.1Incidencia y prevalenciaSi bien en países desarrollados la incidencia de la IC ajustada por edad podría estar disminuyendo, lo cual reflejaría un mejor abordaje de las enfermedades cardiovasculares, la incidencia total está en aumento debido al envejecimiento de la población21−24. Actualmente, la incidencia de la IC en Europa es de aproximadamente 3/1.000 personas-años (todos los grupos de edad) o 5/1.000 personas-años en adultos25,26. La prevalencia de la IC es del 1-2% de los adultos21,27−31. Dado que los estudios clínicos suelen incluir únicamente casos de IC reconocida o diagnosticada, la prevalencia real podría ser más alta32. La prevalencia aumenta con la edad: desde alrededor del 1% en menores de 55 años a más del 10% de los mayores de 7033−36.
Según los resultados de estudios sobre pacientes hospitalizados con IC, se cree que alrededor del 50% de los pacientes tienen IC-FEr y el otro 50%, IC-FEc e IC-FElr32,35,37,38. El Long-Term Registry de la ESC realizado en el contexto ambulatorio indica que el 60% de los pacientes tienen IC-FEr, el 24% tienen IC-FElr y el 16% IC-FEc39 y que más del 50% de los pacientes con IC son mujeres21,40,41.
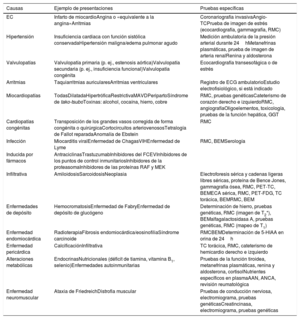
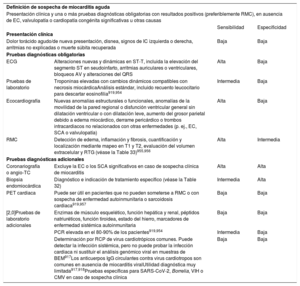
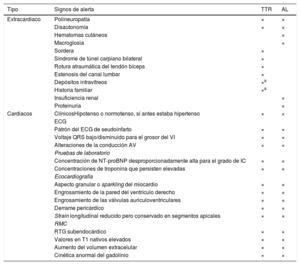
3.3.2Etiología de la insuficiencia cardiacaLas causas más frecuentes de la IC, además de las pruebas diagnósticas más relevantes, se recogen en la tabla 5. La etiología de la IC varía según la zona geográfica. En países occidentales y desarrollados, la EC y la hipertensión son los factores predominantes27.
Con respecto a la etiología isquémica, la IC-FElr se asemeja a la IC-FEr, con una mayor frecuencia de EC subyacente que en los pacientes con IC-FEc38,42,43.
3.3.3Historia natural y pronósticoEl pronóstico de los pacientes con IC ha mejorado considerablemente desde la publicación, hace algunas décadas, de los primeros estudios sobre el tratamiento. No obstante, el pronóstico de estos pacientes sigue siendo malo y su calidad de vida está muy disminuida. La mejora del pronóstico se limita únicamente a los pacientes con IC-FEr.
Las tasas de mortalidad son más altas en estudios observaciones que en ensayos clínicos44. En la cohorte del Condado de Olmsted (Minnesota, Estados Unidos), las tasas de mortalidad 1 y 5 años tras el diagnóstico de todos los tipos de pacientes con IC entre 2000 y 2010 fueron del 20 y el 53%, respectivamente45. Un estudio en el que se combinaron las cohortes del Framingham Heart Study (FHS) y el Cardiovascular Health Study (CHS) mostró una tasa de mortalidad del 67% a los 5 años del diagnóstico46. A pesar de recibir menos tratamientos basados en la evidencia, las mujeres tienen una supervivencia mejor que los varones47.
El pronóstico global es mejor en la IC-FElr que en la IC-FEr39. El cambio de la FE a lo largo del tiempo es frecuente y los pacientes que progresan de IC-FElr a IC-FEr tienen peor pronóstico que los que permanecen estables o cambian a una categoría superior de FE48−52.
Por lo general, la IC-FEc confiere una mejor supervivencia que la IC-FEr, pero la mayoría de los estudios muestran que esta diferencia es insignificante45,46. Sin embargo, el metanálisis MAGGIC concluyó que el riesgo de mortalidad ajustado de los pacientes con IC-FEc fue significativamente menor que el de los pacientes con IC-FEr53.
Numerosos estudios de varios países muestran que entre 1980 y 2000 la supervivencia de los pacientes con IC mejoró sustancialmente41,54−57. Esta tendencia positiva podría haberse estabilizado desde entonces45.
Tras el diagnóstico inicial, los pacientes con IC son hospitalizados, como media, 1 vez al año54. Entre 2000 y 2010, la tasa media de hospitalización en la cohorte del condado de Olmsted fue de 1,3 personas-años. Curiosamente, la mayoría de las hospitalizaciones (63%) fueron por causas no cardiovasculares45. Estudios de varios países europeos y Estados Unidos mostraron que las tasas de hospitalización por IC llegaron a su máximo en la década de los noventa y luego disminuyeron54,55,58−60. Sin embargo, en un estudio reciente sobre IC de nueva aparición, llevado a cabo en Reino Unido entre 1998 y 2017, las tasas de primeras hospitalizaciones, tanto por cualquier causa como por IC, ajustadas por edad aumentaron un 28% y los ingresos por enfermedades no cardiovasculares, un 42%61. Estos aumentos fueron mayores en las mujeres, quizá porque, comparadas con los varones, tienen mayores tasas de comorbilidades. El riesgo de hospitalización por IC es 1,5 veces más alto para los pacientes con diabetes que para los controles. La FA, un índice de masa corporal (IMC) elevado y las altas concentraciones de glucohemoglobina (HbA1c), además de una tasa de filtrado glomerular estimada (TFGe) baja, son potentes predictores de hospitalización por IC29.
Debido al crecimiento y el envejecimiento de la población y al aumento de la prevalencia de comorbilidades, se estima que el número absoluto de hospitalizaciones por IC aumentará considerablemente en el futuro, quizá hasta un 50% en los próximos 25 años24,62.
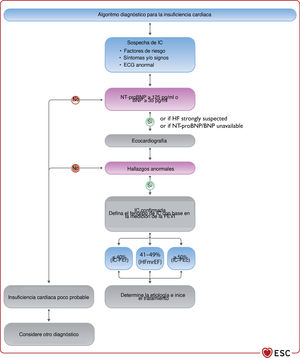
4INSUFICIENCIA CARDIACA CRÓNICA4.1Pasos clave para el diagnóstico de la insuficiencia cardiaca crónicaEl diagnóstico de la ICC requiere la presencia de síntomas y signos de IC y evidencia objetiva de disfunción cardiaca (figura 1). Entre los síntomas típicos están la disnea, la fatiga y la inflamación de tobillos (tabla 6). Los síntomas y signos por sí solos son insuficientes para establecer el diagnóstico de IC63−66.
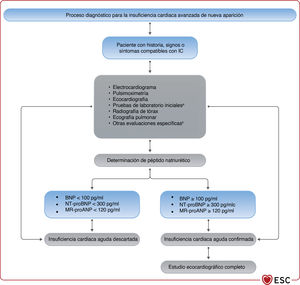
Algoritmo diagnóstico para la insuficiencia cardiaca. BNP: péptido natriurético cerebral; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral. Los hallazgos ecocardiográficos anormales se describen con más detalle en las correspondientes secciones sobre IC-FEr (sección 5), IC-FEm (sección 7) e IC-FEc (sección 8).
El diagnóstico de ICC es más probable en pacientes con antecedentes de infarto de miocardio, hipertensión arterial, EC, DM, consumo excesivo de alcohol, enfermedad renal crónica (ERC) o quimioterapia cardiotóxica y pacientes con historia familiar de miocardiopatía o muerte súbita.
Las siguientes pruebas diagnósticas están recomendadas para la evaluación de pacientes con sospecha de ICC:
- •
Electrocardiograma (ECG). Un ECG normal hace poco probable el diagnóstico de IC63. El ECG puede revelar anomalías como FA, ondas Q, hipertrofia del VI y complejo QRS prolongado (tabla 7), que aumentan la probabilidad del diagnóstico de IC y pueden guiar el tratamiento.
- •
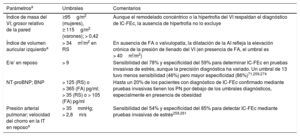
Está recomendada la determinación de péptidos natriuréticos (PN) siempre que sea posible. Concentraciones plasmáticas de péptido natriurético cerebral (BNP) < 35pg/ml, de fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) < 125pg/ml o de la región media del propéptido natriurético auricular (MR-proANP)<40pmol/l68 hacen poco probable el diagnóstico de IC. Estos biomarcadores se tratan más detalladamente en la sección 4.269,70.
- •
Se recomienda hacer pruebas básicas, como la determinación de urea y electrolitos, creatinina, recuento sanguíneo completo, pruebas de la función hepática y tiroidea, para diferenciar la IC de otras entidades, obtener información pronóstica y guiar el posible tratamiento.
- •
Se recomienda la ecocardiografía como prueba clave para la evaluación de la función cardiaca. Además de determinar la FEVI, la ecocardiografía ofrece información sobre otros parámetros, como la dimensión de las cámaras, HVI excéntrica o concéntrica, anomalías en la movilidad regional de la pared (que podrían indicar EC subyacente, síndrome de tako-tsubo o miocarditis), función del VD, hipertensión pulmonar, función valvular y marcadores de la función diastólica16,71.
- •
La radiografía de tórax está recomendada para investigar otras posibles causas de la disnea (p. ej., enfermedad pulmonar). También puede proporcionar evidencia en que apoyar el diagnóstico de IC (p. ej. congestión pulmonar o cardiomegalia).
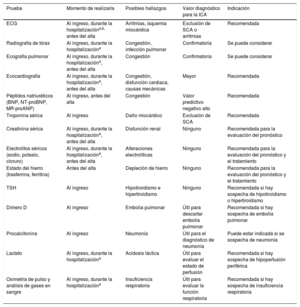
Pruebas diagnósticas recomendadas para todo paciente con sospecha de insuficiencia cardiaca crónica.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| BNP/NT-proBNPc | I | B |
| ECG de 12 derivaciones | I | C |
| Ecocardiografía transtorácica | I | C |
| Radiografía torácica | I | C |
| Análisis sanguíneos habituales para comorbilidades, incluidos el recuento sanguíneo completo, urea y electrolitos, función tiroidea, glucosa en ayunas y HbA1c, lípidos, hierro (Sat-T y ferritina) | I | C |
BNP: péptido natriurético cerebral; ECG: electrocardiograma; HbA1c: glucohemoglobina; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; Sat-T: saturación de transferrina.
aClase de recomendación.
bNivel de evidencia.
cReferencias bibliográficas en la sección 4.2.
Para descartar el diagnóstico, se recomienda determinar las concentraciones plasmáticas de PN como prueba diagnóstica inicial para los pacientes con síntomas indicativos de IC. Las concentraciones de PN elevadas respaldan el diagnóstico de IC y son útiles para el pronóstico72 y guiar la indicación de pruebas cardiacas posteriores73. Hay que señalar que las concentraciones de PN altas pueden tener diversas causas, tanto cardiovasculares como no cardiovasculares, que reducen su precisión diagnóstica (tabla 7), entre ellas la FA, la edad avanzada y la enfermedad renal aguda o crónica74. Por otra parte, las concentraciones de PN pueden estar desproporcionadamente bajas en pacientes obesos75.
Causas de las concentraciones elevadas de péptidos natriuréticos86-88.
| Cardiacas | Insuficiencia cardiacaSíndromes coronarios agudosEmbolia pulmonarMiocarditisHipertrofia ventricular izquierdaMiocardiopatía hipertrófica o restrictivaValvulopatíasEnfermedad cardiaca congénitaTaquiarritmias auriculares y ventricularesContusión cardiacaCardioversión, shock por DAIProcedimientos quirúrgicos que implican al corazónHipertensión pulmonar |
| No cardiacas | Edad avanzadaIctus isquémicoHemorragia subaracnoideaDisfunción renalDisfunción hepática (fundamentalmente cirrosis hepática con ascitis)Síndrome paraneoplásicoEnfermedad pulmonar obstructiva crónicaInfecciones graves (incluidas neumonía y sepsis)Quemaduras gravesAnemiaAlteraciones metabólicas y hormonales graves (p. ej., tirotoxicosis, cetoacidosis diabética) |
DAI: desfibrilador automático implantable.
El valor diagnóstico de los PN, además de los signos, síntomas y otras pruebas diagnósticas como el ECG, se investigó en varios estudios en atención primaria68,76−80. El objetivo de estos estudios era descartar o establecer un diagnóstico de IC. El Grupo de Trabajo revisó estudios con una calidad adecuada que incluyeron en sus algoritmos diagnósticos puntos de corte de PN por debajo de los cuales la probabilidad de IC es extremadamente baja. En el contexto no agudo, los límites superiores de lo normal son BNP 35pg/ml y NT-proBNP 125pg/ml. En estos estudios, los valores predictivos negativos de las concentraciones de PN por debajo de estos umbrales están en el intervalo 0,94-0,9876−78. En cuanto al MR-proANP, se dispone de menos datos en la ICC que para la ICA. Una concentración<40pmol/l puede servir para descartar la IC68.
4.3Pruebas para determinar la etiología subyacente a la insuficiencia cardiaca crónicaLas pruebas diagnósticas recomendadas para determinar la etiología subyacente de la insuficiencia cardiaca crónica se resumen en la tabla 5.
Con una ecocardiografía de estrés o de esfuerzo se puede evaluar la isquemia inducible en pacientes aptos para revascularización coronaria81. En pacientes con IC-FEc, valvulopatía o disnea sin causa conocida, la ecocardiografía de estrés puede ayudar a aclarar el diagnóstico82.
La resonancia magnética cardiaca (RMC) con realce tardío de gadolinio (RTG), con mapeo de T1 y volumen extracelular, permite identificar la fibrosis miocárdica y el tejido cicatricial, que son típicamente subencodárdicos en los pacientes con cardiopatía isquémica, al contrario que el tejido cicatricial en la región media de la pared, típico de la miocardiopatía dilatada. Además, la RMC permite caracterizar el tejido miocárdico de la miocarditis, la amiloidosis, la enfermedad de Chagas, la miocardiopatía de Fabry, la miocardiopatía por VI no compactado, la hemocromatosis y la miocardiopatía arritmogénica83,84.
Para descartar el diagnóstico de EC, se puede considerar la angio-TC para pacientes con una probabilidad pretest intermedia o baja de EC o con resultados no concluyentes en pruebas de estrés no invasivas5.
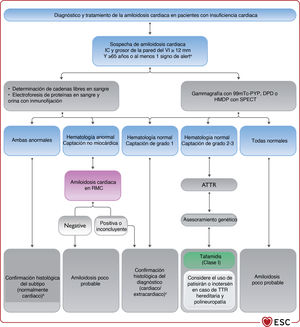
La TC por emisión monofotónica (SPECT) puede ser útil para la evaluación de la isquemia y la viabilidad miocárdica y la inflamación e infiltración miocárdica. La gammagrafía con bisfosfonatos marcados con tecnecio ha mostrado grandes sensibilidad y especificidad para la detección de la amiloidosis cardiaca por transtirretina85.
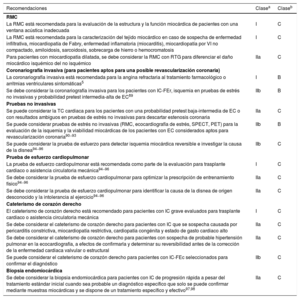
Recomendaciones sobre pruebas diagnósticas especiales para detectar causas reversibles o tratables de la insuficiencia cardiaca en pacientes con insuficiencia cardiaca crónica seleccionados.
| Recomendaciones | Clasea | Claseb |
|---|---|---|
| RMC | ||
| La RMC está recomendada para la evaluación de la estructura y la función miocárdica de pacientes con una ventana acústica inadecuada | I | C |
| La RMC está recomendada para la caracterización del tejido miocárdico en caso de sospecha de enfermedad infiltrativa, miocardiopatía de Fabry, enfermedad inflamatoria (miocarditis), miocardiopatía por VI no compactado, amiloidosis, sarcoidosis, sobrecarga de hierro o hemocromatosis | I | C |
| Para pacientes con miocardiopatía dilatada, se debe considerar la RMC con RTG para diferenciar el daño miocárdico isquémico del no isquémico | IIa | C |
| Coronariografía invasiva (para pacientes aptos para una posible revascularización coronaria) | ||
| La coronariografía invasiva está recomendada para la angina refractaria al tratamiento farmacológico o arritmias ventriculares sintomáticas5 | I | B |
| Se debe considerar la coronariografía invasiva para los pacientes con IC-FEr, isquemia en pruebas de estrés no invasivas y probabilidad pretest intermedia-alta de EC89 | IIb | B |
| Pruebas no invasivas | ||
| Se puede considerar la TC cardiaca para los pacientes con una probabilidad pretest baja-intermedia de EC o con resultados ambiguos en pruebas de estrés no invasivas para descartar estenosis coronaria | IIa | C |
| Se puede considerar pruebas de estrés no invasivas (RMC, ecocardiografía de estrés, SPECT, PET) para la evaluación de la isquemia y la viabilidad miocárdicas de los pacientes con EC considerados aptos para revascularización coronaria90−93 | IIb | B |
| Se puede considerar la prueba de esfuerzo para detectar isquemia miocárdica reversible e investigar la causa de la disnea94−96 | IIb | C |
| Prueba de esfuerzo cardiopulmonar | ||
| La prueba de esfuerzo cardiopulmonar está recomendada como parte de la evaluación para trasplante cardiaco o asistencia circulatoria mecánica94−96 | I | C |
| Se debe considerar la prueba de esfuerzo cardiopulmonar para optimizar la prescripción de entrenamiento físico94−96 | IIa | C |
| Se debe considerar la prueba de esfuerzo cardiopulmonar para identificar la causa de la disnea de origen desconocido y la intolerancia al ejercicio94−96 | IIa | C |
| Cateterismo de corazón derecho | ||
| El cateterismo de corazón derecho está recomendado para pacientes con IC grave evaluados para trasplante cardiaco o asistencia circulatoria mecánica | I | C |
| Se debe considerar el cateterismo de corazón derecho para pacientes con IC que se sospecha causada por pericarditis constrictiva, miocardiopatía restrictiva, cardiopatía congénita y estado de gasto cardiaco alto | IIa | C |
| Se debe considerar el cateterismo de corazón derecho para pacientes con sospecha de probable hipertensión pulmonar en la ecocardiografía, a efectos de confirmarla y determinar su reversibilidad antes de la corrección de la enfermedad cardiaca valvular o estructural | IIa | C |
| Se puede considerar el cateterismo de corazón derecho para pacientes con IC-FEc seleccionados para confirmar el diagnóstico | IIb | C |
| Biopsia endomiocárdica | ||
| Se debe considerar la biopsia endomiocárdica para pacientes con IC de progresión rápida a pesar del tratamiento estándar inicial cuando sea probable un diagnóstico específico que solo se puede confirmar mediante muestras miocárdicas y se dispone de un tratamiento específico y efectivo97,98 | IIa | C |
ACM: asistencia circulatoria mecánica; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; PET: tomografía por emisión de positrones; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; SPECT: tomografía por emisión monofotónica; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
Para establecer el diagnóstico de EC y su gravedad, está recomendada la coronariografía para pacientes con IC que tienen angina o «síntomas equivalentes a la angina» a pesar del tratamiento farmacológico. La coronariografía también se puede considerar para pacientes con IC-FEr que tienen una probabilidad pretest intermedia-alta de EC y podrían ser aptos para revascularización coronaria5.
5INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN REDUCIDA5.1Diagnóstico de la insuficiencia cardiaca con fracción de eyección reducidaEl diagnóstico de IC-FEr requiere que haya síntomas y signos de IC y fracción de eyección reducida (FEVI ≤ 40%), lo cual normalmente se confirma mediante ecocardiografía. Los estándares de calidad que deben cumplirse cuando se determina función sistólica del VI reducida mediante ecocardiografía se detallan en el artículo de posición de la European Association of Cardiovascular Imaging (EACVI)99. Cuando la evaluación de la fracción de eyección no es posible mediante ecocardiografía, se puede emplear la RMC o, en raras ocasiones, técnicas diagnósticas nucleares.
La figura 1 describe un algoritmo diagnóstico para la IC-FEr. Para la investigación de la etiología subyacente, consulte la tabla 5.
5.2Tratamiento farmacológico para los pacientes con insuficiencia cardiaca y fracción de eyección reducida5.2.1Objetivos del tratamiento farmacológico de los pacientes con insuficiencia cardiaca y fracción de eyección reducidaLa farmacoterapia es la piedra angular del tratamiento de la IC-FEr y se debe implementar antes de las terapias con dispositivos y al mismo tiempo que otras intervenciones no farmacológicas.
Los 3 objetivos fundamentales del tratamiento de los pacientes con IC-FEr son: a) reducir la mortalidad; b) prevenir las hospitalizaciones recurrentes por empeoramiento de la IC, y c) mejorar el estado clínico, la capacidad funcional y la calidad de vida100−102.
La evidencia científica que sirve de base a las recomendaciones de esta sección para los pacientes con IC-FEr sintomática se recogen la tabla 1 del material adicional.
Clases de recomendación.
| Definición | Expresiones propuestas | ||
|---|---|---|---|
| Clases de recomendaciones | Clase I | Evidencia y/o acuerdo general de que determinado procedimiento diagnóstico/tratamiento es beneficioso, útil y efectivo | Se recomienda/está indicado |
| Clase II | Evidencia conflictiva y/o divergencia de opinión acerca de la utilidad/eficacia del tratamiento | ||
| Clase IIa | El peso de la evidencia/opinión está a favor de la utilidad/eficacia | Se debe considerar | |
| Clase IIb | La utilidad/eficacia está menos establecida por la evidencia/opinión | Se puede recomendar | |
| Clase III | Evidencia o acuerdo general de que el tratamiento no es útil/efectivo y en algunos casos puede ser perjudicial | No se recomienda | |
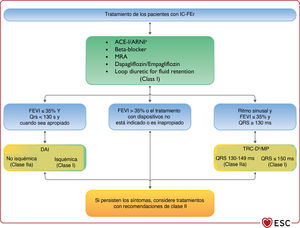
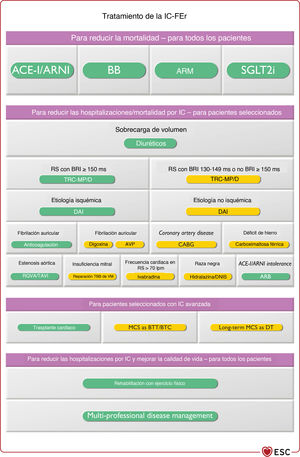
El algoritmo de tratamiento para las indicaciones de clase I, que incluye fármacos y dispositivos, para la reducción de la mortalidad por cualquier causa y cardiovascular de los pacientes con IC-FEr se encuentra en la figura 2. Las recomendaciones sobre cada tratamiento se resumen a continuación.
Algoritmo terapéutico de clase I. Indicaciones de tratamiento para pacientes con IC-FEr. Verde: clase I. Amarillo: clase IIa. ARM: antagonistas del receptor de mineralcortidoides; DAI: desfibrilador automático implantable; IECA: inhibidores de la enzima de conversión de la angiotensina; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; QRS: ondas Q, R y S del ECG; TRC-D: terapia de resincronización cardiaca con desfibrilador; TRC-MP: terapia de resincronización cardiaca con marcapasos. aComo sustituto de los IECA. bCuando sea apropiado.
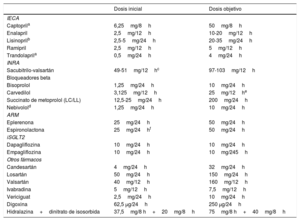
Se ha demostrado que la modulación del sistema renina-angiotensina-aldosterona (SRAA) y el sistema simpático con inhibidores de la enzima de conversión de la angiotensina (IECA) o un inhibidor de la neprilisina el receptor de la angiotensina (INRA), bloqueadores beta (BB) y antagonistas del receptor de mineralocorticoides (ARM) mejora la supervivencia y reduce el riesgo de hospitalizaciones por IC y los síntomas de los pacientes con IC-FEr. Estos fármacos son la base de la farmacoterapia para estos pacientes. La tríada compuesta por un IECA o INRA, un BB y un ARM está recomendada como la piedra angular del tratamiento de los pacientes con IC-FEr siempre que no haya contraindicaciones o intolerancia103−105. Las dosis de estos fármacos deben aumentarse hasta alcanzar las utilizadas en ensayos clínicos (o, si no fuera posible, hasta la dosis máxima tolerada). En esta guía se sigue recomendando la sustitución de un IECA por un INRA para los pacientes que continúan sintomáticos a pesar del tratamiento con IECA, BB y ARM; no obstante, el uso de un INRA se puede valorar como tratamiento de primera línea en lugar de un IECA106,107. Las dosis recomendadas de estos fármacos se encuentran en la tabla 8. Los antagonistas del receptor de la angiotensina II (ARA-II) siguen siendo útiles para los pacientes que no toleran el tratamiento con un IECA o un INRA.
Dosis de los fármacos modificadores de la enfermedad con base en la evidencia de grandes ensayos clínicos para pacientes con insuficiencia cardiaca y fracción de eyección reducida.
| Dosis inicial | Dosis objetivo | |
|---|---|---|
| IECA | ||
| Captoprila | 6,25mg/8h | 50mg/8h |
| Enalapril | 2,5mg/12h | 10-20mg/12h |
| Lisinoprilb | 2,5-5mg/24h | 20-35mg/24h |
| Ramipril | 2,5mg/12h | 5mg/12h |
| Trandolaprila | 0,5mg/24h | 4mg/24h |
| INRA | ||
| Sacubitrilo-valsartán | 49-51mg/12hc | 97-103mg/12h |
| Bloqueadores beta | ||
| Bisoprolol | 1,25mg/24h | 10mg/24h |
| Carvedilol | 3,125mg/12h | 25mg/12he |
| Succinato de metoprolol (LC/LL) | 12,5-25mg/24h | 200mg/24h |
| Nebivolold | 1,25mg/24h | 10mg/24h |
| ARM | ||
| Eplerenona | 25mg/24h | 50mg/24h |
| Espironolactona | 25mg/24hf | 50mg/24h |
| iSGLT2 | ||
| Dapagliflozina | 10mg/24h | 10mg/24h |
| Empagliflozina | 10mg/24h | 10mg/245h |
| Otros fármacos | ||
| Candesartán | 4mg/24h | 32mg/24h |
| Losartán | 50mg/24h | 150mg/24h |
| Valsartán | 40mg/12h | 160mg/12h |
| Ivabradina | 5mg/12h | 7,5mg/12h |
| Vericiguat | 2,5mg/24h | 10mg/24h |
| Digoxina | 62,5 μg/24h | 250 μg/24h |
| Hidralazina+dinitrato de isosorbida | 37,5mg/8 h+20mg/8h | 75mg/8 h+40mg/8h |
ARM: antagonistas del receptor de mineralocorticoides; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; LC: liberación controlada; LL: liberación lenta.
aIndica un IECA cuando la dosis objetivo se deriva de estudios tras infarto de miocardio.
bIndica fármacos cuyas dosis más altas han reducido la morbimortalidad comparadas con dosis más bajas del mismo fármaco, pero sin suficientes estudios aleatorizados y controlados, por lo que se desconoce la dosis óptima.
cSe puede optar por dosis iniciales de sacubitrilo-valsartán más bajas (24+26mg/12 h) para pacientes con antecedentes de hipotensión sintomática.
dIndica un tratamiento del que no se ha demostrado que reduzca la mortalidad cardiovascular o por cualquier causa de los pacientes con insuficiencia cardiaca (o se ha demostrado no inferior a un tratamiento que sí la reduce).
eSe puede administrar una dosis máxima de 50mg 2 veces al día a pacientes con peso > 85kg.
fCon la espironolactona se puede optar por una dosis inicial de 12,5 mg para pacientes cuyo estado renal o hiperpotasemia requieran precaución.
Los inhibidores del cotransportador de sodio-glucosa tipo 2 (iSGLT2), dapagliflozina y empagliflozina, añadidos al tratamiento con IECA/INRA, BB y ARM redujeron el riesgo de mortalidad cardiovascular y el empeoramiento de la IC en pacientes con IC-FEr108,109. Salvo contraindicaciones o intolerancia, la dapagliflozina o la empagliflozina están recomendadas para todos los pacientes con IC-FEr en tratamiento con un IECA/INRA, un BB y un ARM, sean diabéticos o no. La sección 5.4 está dedicada a otros fármacos que pueden servir para pacientes con IC-FEr seleccionados.
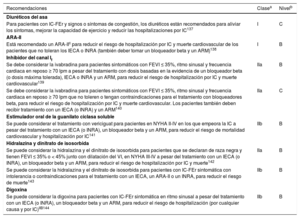
5.3Fármacos recomendados para todo paciente con insuficiencia cardiaca y fracción de eyección reducidaTratamientos farmacológicos indicados para pacientes con insuficiencia cardiaca (NYHA II-IV) y fracción de eyección reducida (FEVI ≤ 40%).
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con IC-FEr, se recomienda un IECA para reducir el riesgo de hospitalización por IC y muerte110−113 | I | A |
| Para los pacientes con IC-FEr estable, se recomienda un bloqueador beta para reducir el riesgo de hospitalización por IC y muerte114−120 | I | A |
| Para los pacientes con IC-FEr, se recomienda un ARM para reducir el riesgo de hospitalización por IC y muerte121,122 | I | A |
| Para los pacientes con IC-FEr, se recomiendan la dapagliflozina o la empagliflozina para reducir el riesgo de hospitalización por IC y muerte108,109 | I | A |
| Para los pacientes con IC-FEr, el sacubitrilo-valsartán está recomendado como sustituto de los IECA para reducir el riesgo de hospitalización por IC y muerte105 | I | B |
ARM: antagonistas del receptor de mineralcortidoides; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
Los IECA son la primera clase de fármacos de los que se ha demostrado que reducen la morbimortalidad de los pacientes con IC-FEr110−113. También se ha demostrado que reducen los síntomas111. Están recomendados para todos los pacientes siempre que no haya contraindicaciones o intolerancia. La dosis de IECA debe aumentarse hasta alcanzar la dosis máxima tolerada.
En tabla 2 del material adicional se encuentra una guía práctica para la prescripción de IECA.
Niveles de evidencia.
| Nivel de evidencia A | Datos procedentes de múltiples ensayos clínicos aleatorizados o metanálisis |
| Nivel de evidencia B | Datos procedentes de un único ensayo clínico aleatorizado o grandes estudios no aleatorizados |
| Nivel de evidencia C | Consenso de opinión de expertos y/o pequeños estudios, estudios retrospectivos, registros |
Los BB reducen la morbimortalidad de los pacientes con IC-FEr, además del tratamiento con IECA y diuréticos114−120. También mejoran los síntomas123. Hay consenso sobre la instauración de tratamiento con IECA y BB en cuanto se confirme el diagnóstico de IC-FEr sintomática. No hay consenso sobre el inicio del tratamiento con un BB antes que con un IECA, y viceversa124. Para los pacientes clínicamente estables y euvolémicos, el tratamiento con BB debe instaurarse a dosis bajas y aumentarlas gradualmente hasta llegar a la dosis máxima tolerada. Para pacientes ingresados por IC aguda, la administración de BB debe iniciarse con precaución en el hospital una vez que el paciente esté hemodinámicamente estable.
Un metanálisis de datos de pacientes individuales incluidos en los estudios más importantes sobre BB en pacientes con IC-FEr no ha demostrado beneficio alguno en cuanto a hospitalizaciones y mortalidad de pacientes con IC-FEr que están en FA125. Sin embargo, dado que se trata de un análisis retrospectivo de subgrupos y que los BB no aumentaron el riesgo, el comité para la elaboración de esta guía no ha establecido una recomendación separada basada en el ritmo cardiaco.
En tabla 3 del material adicional se encuentra una guía práctica para la prescripción de BB.
Definiciones de la insuficiencia cardiaca con fracción de eyección reducida, ligeramente reducida y conservada.
| Tipo de IC | IC-FEr | IC-FElr | IC-FEc | |
|---|---|---|---|---|
| Criterios | 1 | Síntomas±signosa | Síntomas±signosa | Síntomas±signosa |
| 2 | FEVI ≤ 40% | FEVI 41-49% | FEVI ≥ 50% | |
| 3 | – | – | Evidencia objetiva de anomalías cardiacas estructurales o funcionales compatibles con disfunción diastólica o altas presiones de llenado del VI, incluidas las concentraciones elevadas de péptidos natriuréticosc | |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; VI: ventrículo izquierdo.
aLos signos pueden estar ausentes en las fases tempranas de la IC (especialmente en la IC-FEc) y en pacientes que reciben tratamiento óptimo.
bPara el diagnóstico de la IC-FElr, la evidencia de otra cardiopatía estructural (p. ej., aumento del tamaño de la aurícula izquierda, hipertrofia del VI o reducción del llenado del VI medido por ecocardiografía) hace que el diagnóstico sea más probable.
cPara el diagnóstico de la IC-FEc, cuanto mayor sea el número de anomalías, mayor es la probabilidad de IC-FEc.
Para todo paciente con IC-FEr, se recomiendan los ARM (espironolactona y eplerenona) además de un IECA y un BB para reducir la mortalidad y el riesgo de hospitalización por IC121,122. También mejoran los síntomas121. Los ARM bloquean los receptores que fijan la aldosterona y, con diferente grado de afinidad, otros receptores de hormonas esteroides (p. ej., corticoides y andrógenos). La eplerenona es un bloqueador más específico de la aldosterona y, por ello, causa menos ginecomastia.
Deben tomarse precauciones al administrar ARM a pacientes con la función renal afectada o con concentraciones séricas de potasio ≥ 5,0mmol/l.
La guía práctica sobre la prescripción de ARM se muestra en la tabla 4 del material adicional.
Clasificación funcional de la New York Heart Association basada en la gravedad de los síntomas y la actividad física.
| Clase I | Sin limitación de la actividad física. La actividad física ordinaria no causa problemas indebidos de disnea, fatiga o palpitaciones |
| Clase II | Leve limitación de la actividad física. Se siente cómodo en reposo, pero una actividad física ordinaria produce disnea, fatiga o palpitaciones |
| Clase III | Marcada limitación de la actividad física. Ausencia de malestar en reposo, pero cualquier actividad física produce disnea, fatiga o palpitaciones |
| Clase IV | Incapacidad para llevar a cabo cualquier actividad física sin malestar. Puede haber síntomas en reposo. Si se lleva a cabo cualquier actividad física, aumenta la sensación de malestar |
En el estudio PARADIGM-HF se demostró la superioridad del sacubitrilo-valsartán (un INRA) sobre el enalapril (un IECA) para la reducción de las hospitalizaciones por empeoramiento de la IC, la mortalidad cardiovascular y por cualquier causa en pacientes ambulatorios con IC-FEr (FEVI ≤ 40%, que se cambió a ≤ 35% durante el estudio), valores plasmáticos de PN aumentados y una TFGe ≥ 30ml/min/1,73 m2 que pudieran tolerar periodos consecutivos de tratamiento con enalapril y después sacubitrilo-valsartán durante un periodo de rodaje105. Los beneficios adicionales del sacubitrilo-valsartán fueron una mejoría de los síntomas y de la calidad de vida105, una reducción de la incidencia de diabetes que requiere tratamiento con insulina126 y una menor disminución de la TFGe127, además de una tasa reducida de hiperpotasemia128. El sacubitrilo-valsartán podría reducir también la necesidad de diuréticos del asa129. La hipotensión sintomática fue más frecuente en los pacientes tratados con sacubitrilo-valsartán que con enalapril, pero a pesar de ello estos pacientes también obtuvieron beneficios clínicos128,130.
Por lo tanto, se recomienda sustituir un IECA o ARA-II por sacubitrilo-valsartán para los pacientes ambulatorios que permanecen sintomáticos a pesar del TMO con dichos fármacos. En 2 estudios se examinó el tratamiento con INRA de pacientes hospitalizados, algunos de los cuales no habían recibido tratamiento con IECA. La instauración del tratamiento en este contexto parece segura y reduce la muerte cardiovascular o las hospitalizaciones por IC en un 42% comparado con enalapril106,107,131. Por tanto, puede considerarse la instauración de sacubitrilo-valsartán para pacientes con IC-FEr no tratados previamente con un IECA (clase de recomendación IIb, nivel de evidencia B). Los pacientes que empiezan el tratamiento con sacubitrilo-valsartán deben tener una presión arterial adecuada y una TFGe ≥ 30ml/min/1,73 m2. Es necesario un periodo de aclarado de al menos 36 h tras la última toma de un IECA para minimizar el riesgo de angioedema.
La guía práctica para la prescripción de INRA se muestra en la tabla 5 del material adicional.
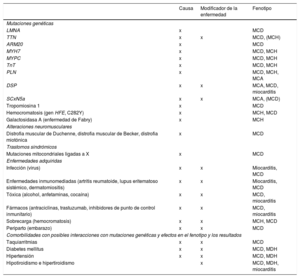
Causas de la insuficiencia cardiaca, formas comunes de presentación y pruebas específicas.
| Causas | Ejemplo de presentaciones | Pruebas específicas |
|---|---|---|
| EC | Infarto de miocardioAngina o «equivalente a la angina»Arritmias | Coronariografía invasivaAngio-TCPrueba de imagen de estrés (ecocardiografía, gammagrafía, RMC) |
| Hipertensión | Insuficiencia cardiaca con función sistólica conservadaHipertensión maligna/edema pulmonar agudo | Medición ambulatoria de la presión arterial durante 24hMetanefrinas plasmáticas, prueba de imagen de arteria renalRenina y aldosterona |
| Valvulopatías | Valvulopatía primaria (p. ej., estenosis aórtica)Valvulopatía secundaria (p. ej., insuficiencia funcional)Valvulopatía congénita | Ecocardiografía transesofágica o de estrés |
| Arritmias | Taquiarritmias auricularesArritmias ventriculares | Registro de ECG ambulatorioEstudio electrofisiológico, si está indicado |
| Miocardiopatías | TodasDilatadaHipertróficaRestrictivaMAVDPeripartoSíndrome de tako-tsuboToxinas: alcohol, cocaína, hierro, cobre | RMC, pruebas genéticasCateterismo de corazón derecho e izquierdoRMC, angiografíaOligoelementos, toxicología, pruebas de la función hepática, GGT |
| Cardiopatías congénitas | Transposición de los grandes vasos corregida de forma congénita o quirúrgicaCortocircuitos arteriovenososTetralogía de Fallot reparadaAnomalía de Ebstein | RMC |
| Infección | Miocarditis viralEnfermedad de ChagasVIHEnfermedad de Lyme | RMC, BEMSerología |
| Inducida por fármacos | AntraciclinasTrastuzumabInhibidores del FCEVInhibidores de los puntos de control inmunitariosInhibidores de la proteasomaInhibidores de las proteínas RAF y MEK | |
| Infiltrativa | AmiloidosisSarcoidosisNeoplasia | Electroforesis sérica y cadenas ligeras libres séricas, proteína de Bence Jones, gammagrafía ósea, RMC, PET-TC, BEMECA sérica, RMC, PET-FDG, TC torácica, BEMRMC, BEM |
| Enfermedades de depósito | HemocromatosisEnfermedad de FabryEnfermedad de depósito de glucógeno | Determinación de hierro, pruebas genéticas, RMC (imagen de T2*), BEMalfagalactosidasa A, pruebas genéticas, RMC (mapeo de T1) |
| Enfermedad endomiocárdica | RadioterapiaFibrosis endomiocárdica/eosinofiliaSíndrome carcinoide | RMCBEMDeterminación de 5-HIAA en orina de 24h |
| Enfermedad pericárdica | CalcificaciónInfiltrativa | TC torácica, RMC, cateterismo de hemicardio derecho e izquierdo |
| Alteraciones metabólicas | EndocrinasNutricionales (déficit de tiamina, vitamina B1, selenio)Enfermedades autoinmunitarias | Pruebas de la función tiroidea, metanefrinas plasmáticas, renina y aldosterona, cortisolNutrientes específicos en plasmaAAN, ANCA, revisión reumatológica |
| Enfermedad neuromuscular | Ataxia de FriedreichDistrofia muscular | Pruebas de conducción nerviosa, electromiograma, pruebas genéticasCreatincinasa, electromiograma, pruebas genéticas |
5-HIAA: ácido 5-hidroxindolacético; N: anticuerpos antinucleares; ANCA: anticuerpos anticitoplasma de neutrófilos; BEM: biopsia endomiocárdica; CK: creatincinasa; EC: enfermedad coronaria; ECA: enzima de conversión de la angiotensina; ECG: electrocardiograma; FCEV: factor de crecimiento endotelial vascular; FDG: fluorodesoxiglucosa; GGT: gamma glutamil transferasa; MAVD: miocardiopatía arritmogénica del ventrículo derecho; MEK: proteincinasa activada por mitógenos; PA: presión arterial; PET: tomografía por emisión de positrones; RMC: resonancia magnética cardiaca; TC: tomografía computarizada; VIH: virus de la inmunodeficiencia humana.
El estudio DAPA-HF investigó los efectos a largo plazo de la dapagliflozina (un iSGLT2) comparada con placebo, además del TMO, en la morbimortalidad de los pacientes ambulatorios con IC-FEr108. Los pacientes incluidos en el estudio estaban en NYHA II-IV y tenían una FEVI ≤ 40% a pesar del TMO, una TFGe ≥ 30ml/min/1,73 m2 y valores altos de NT-proBNP108. El tratamiento con dapagliflozina redujo en un 26% el objetivo primario, una variable compuesta por empeoramiento de la IC (hospitalización o consulta urgente que requiere tratamiento intravenoso para la IC) o muerte cardiovascular. Se observó una reducción significativa de ambas variables. Además, la dapagliflozina redujo la mortalidad por cualquier causa108 y mejoró los síntomas de IC, la capacidad funcional y la calidad de vida de los pacientes con IC-FEr sintomática132. Tras el inicio del tratamiento, se observaron muy pronto los beneficios de la dapagliflozina y la reducción del riesgo absoluto fue significativa. En cuanto a la supervivencia, los beneficios fueron similares en pacientes con IC-FEr diabéticos y no diabéticos y en todo el espectro de la HbA1c108.
Posteriormente, el estudio EMPEROR-Reduced demostró que la empagliflozina redujo en un 25% el objetivo primario compuesto por mortalidad cardiovascular u hospitalización por IC en pacientes con síntomas de NYHA II-IV y FEVI ≤ 40% a pesar del TMO109. El estudio incluyó a pacientes con TFGe > 20ml/min/1,73 m2 y demostró una reducción de la disminución de la TFGe en los pacientes tratados con empagliflozina y una mejoría de la calidad de vida133. Aunque en este estudio no se observó una reducción significativa de la mortalidad cardiovascular, un reciente metanálisis de los estudios DAPA-HF y EMPEROR-Reduced mostró la no heterogeneidad en la mortalidad cardiovascular134.
Por lo tanto, se recomienda el tratamiento con dapagliflozina o empagliflozina, además del TMO con un IECA/INRA, un BB y un ARM, para los pacientes con IC-FEr cualquiera sea su estado diabético. Las propiedades diuréticas y natriuréticas de los iSGLT2 pueden ofrecer beneficios adicionales para reducir la congestión y la toma de diuréticos del asa135.
La sotagliflozina, un inhibidor combinado del SGLT 1 y 2, se ha investigado en pacientes con diabetes hospitalizados por IC. Este fármaco redujo la mortalidad cardiovascular y la hospitalización por IC136. Este tratamiento se aborda con más detalle en las secciones dedicadas a la IC aguda y comorbilidades.
El tratamiento con iSGLT2 puede aumentar el riesgo de infecciones fúngicas genitales recurrentes. Tras la instauración del tratamiento, se puede esperar una pequeña reducción de la TFGe, que es reversible y no debe llevar a la suspensión prematura del fármaco.
La guía práctica para la prescripción de los iSGLT2 (dapagliflozina y empagliflozina) se encuentra en la tabla 6 del material adicional.
Síntomas y signos típicos de la insuficiencia cardiaca.
| Síntomas | Signos |
|---|---|
| Típicos | Más específicos |
| DisneaOrtopneaDisnea paroxística nocturnaTolerancia disminuida al ejercicioFatiga, cansancio, más tiempo para recuperarse del ejercicioInflamación de tobillos | Presión venosa yugular elevadaReflujo hepatoyugularTercer sonido cardiaco (ritmo galopante)Impulso apical desplazado lateralmente |
| Menos típicos | Menos específicos |
| Tos nocturnaSibilanciasSensación de hinchazónPérdida de apetitoConfusión (especialmente en ancianos)DepresiónPalpitacionesMareoSíncopeBendopneaa | Aumento de peso (> 2kg/semana)Pérdida de peso (IC avanzada)Pérdida de tejido (caquexia)Soplo cardiacoEdema periférico (tobillos, sacro, escroto)Crepitantes pulmonaresDerrame pleuralTaquicardiaPulso irregularTaquipneaRespiración de Cheyne-StokesHepatomegaliaAscitisExtremidades fríasOliguriaPresión de pulso estrecha |
IC: insuficiencia cardiaca.
aEste síntoma de IC avanzada corresponde a la falta de aire cuando el cuerpo se inclina hacia adelante67.
Otros tratamientos farmacológicos indicados para pacientes con insuficiencia cardiaca (NYHA II-IV) y fracción de eyección reducida (FEVI ≤ 40%) seleccionados.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Diuréticos del asa | ||
| Para pacientes con IC-FEr y signos o síntomas de congestión, los diuréticos están recomendados para aliviar los síntomas, mejorar la capacidad de ejercicio y reducir las hospitalizaciones por IC137 | I | C |
| ARA-II | ||
| Está recomendado un ARA-IIc para reducir el riesgo de hospitalización por IC y muerte cardiovascular de los pacientes que no toleran los IECA o INRA (también deber tomar un bloqueador beta y un ARM)138 | I | B |
| Inhibidor del canal If | ||
| Se debe considerar la ivabradina para pacientes sintomáticos con FEVI ≤ 35%, ritmo sinusal y frecuencia cardiaca en reposo ≥ 70 lpm a pesar del tratamiento con dosis basadas en la evidencia de un bloqueador beta (o dosis máxima tolerada), IECA o INRA y un ARM, para reducir el riesgo de hospitalización por IC y muerte cardiovascular139 | IIa | B |
| Se debe considerar la ivabradina para pacientes sintomáticos con FEVI ≤ 35%, ritmo sinusal y frecuencia cardiaca en reposo ≥ 70 lpm que no toleren o tengan contraindicaciones para el tratamiento con bloqueadores beta, para reducir el riesgo de hospitalización por IC y muerte cardiovascular. Los pacientes también deben recibir tratamiento con un IECA (o INRA) y un ARM140 | IIa | C |
| Estimulador oral de la guanilato ciclasa soluble | ||
| Se puede considerar el tratamiento con vericiguat para pacientes en NYHA II-IV en los que empeora la IC a pesar del tratamiento con un IECA (o INRA), un bloqueador beta y un ARM, para reducir el riesgo de mortalidad cardiovascular y hospitalización por IC141 | IIb | B |
| Hidralazina y dinitrato de isosorbida | ||
| Se puede considerar la hidralazina y el dinitrato de isosorbida para pacientes que se declaran de raza negra y tienen FEVI ≤ 35% o < 45% junto con dilatación del VI, en NYHA III-IV a pesar del tratamiento con un IECA (o INRA), un bloqueador beta y un ARM, para reducir el riesgo de hospitalización por IC y muerte142 | IIa | B |
| Se puede considerar la hidralazina y el dinitrato de isosorbida para pacientes con IC-FEr sintomática con intolerancia o contraindicaciones para el tratamiento con un IECA, un ARA-II o un INRA, para reducir el riesgo de muerte143 | IIb | B |
| Digoxina | ||
| Se puede considerar la digoxina para pacientes con IC-FEr sintomática en ritmo sinusal a pesar del tratamiento con un IECA (o INRA), un bloqueador beta y un ARM, para reducir el riesgo de hospitalización (por cualquier causa y por IC)IIB144 | IIb | B |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
cLos ARA-II con evidencia en la IC-FEr son candesartán, losartán y valsartán.
Los diuréticos del asa están recomendados para reducir los signos y síntomas de congestión de los pacientes con IC-FEr. La calidad de la evidencia relativa al tratamiento diurético no es buena y no se ha estudiado su efecto en la morbimortalidad en ECDA, pero hay que recordar que, en los estudios más importantes sobre tratamientos modificadores de la IC-FEr, se incluyó a un gran número de pacientes con tratamiento diurético de base. Un metanálisis mostró que, en pacientes con IC-FEr, los diuréticos del asa y las tiacidas pueden reducir el riesgo de muerte y empeoramiento de la IC comparados con placebo y, en la comparación con un grupo de control activo, parece que mejoran la capacidad de ejercicio137.
Los diuréticos del asa producen una diuresis más intensa y corta que las tiacidas, aunque actúan de manera sinérgica (bloqueo secuencial de la nefrona) y la combinación de ambos puede emplearse para tratar la resistencia a los diuréticos. Sin embargo, los efectos adversos son más probables y esta combinación solo debe prescribirse con precaución. Hay que recordar también que los INRA, ARM e iSGLT2 también tienen propiedades diuréticas129,145.
El objetivo del tratamiento diurético es alcanzar y mantener la euvolemia con la dosis más baja posible. Para pacientes euvolémicos o hipovolémicos seleccionados, se puede reducir o suspender el tratamiento diurético146. Se debe instruir a los pacientes para que ellos mismos ajusten la dosis de diuréticos con base en la monitorización de los signos y síntomas de congestión y el peso diario.
La guía práctica sobre la prescripción de diuréticos se encuentra en la tabla 7 del material adicional.
5.4.2Antagonistas del receptor tipo 1 de la angiotensina IIEl papel de los ARA-II en el tratamiento de la IC-FEr ha cambiado en los últimos años. Hoy en día solo se recomiendan como tratamiento alternativo para pacientes que no toleran los IECA o INRA debido a efectos secundarios adversos. En el estudio CHARM-Alternative, el candesartán redujo la muerte cardiovascular y las hospitalizaciones por IC en pacientes no tratados con IECA por intolerancia previa138. El valsartán, añadido al tratamiento habitual que incluía un IECA, redujo las hospitalizaciones por IC en el estudio Val-HeFT trial147. Sin embargo, con ningún ARA-II se ha demostrado reducción de la mortalidad por cualquier causa en estudio alguno.
5.4.3Inhibidor del canal IfLa ivabradina ralentiza la frecuencia cardiaca inhibiendo el canal If en el nódulo sinusal, por lo que solo es efectiva en los pacientes en ritmo sinusal. La ivabradina redujo la variable compuesta de mortalidad cardiovascular y hospitalización por IC en pacientes con IC-FEr sintomática y FEVI ≤ 35% hospitalizados por IC en los 12 meses previos, con ritmo sinusal y frecuencia cardiaca ≥ 70 lpm en tratamiento basado en la evidencia con un IECA (o ARA-II), un BB y un ARM139,140. La recomendación de esta guía está basada en una frecuencia cardiaca ≥ 70 lpm, similar a la considerada en el estudio SHIFT. Sin embargo, la Agencia Europea del Medicamento aprobó la ivabradina para pacientes con IC-FEr, FEVI ≤ 35%, ritmo sinusal y frecuencia cardiaca en reposo ≥ 75 lpm debido a que, según los resultados de un análisis retrospectivo de subgrupos, la ivabradina confiere un beneficio en supervivencia148. Deben hacerse todos los esfuerzos para iniciar y aumentar el tratamiento con BB hasta las dosis recomendadas o las dosis máximas toleradas antes de considerar la ivabradina.
La guía práctica para la prescripción de la ivabradina se encuentra en la tabla 8 del material adicional.
5.4.4Combinación de hidralazina y dinitratato de isosorbidaNo existen pruebas claras que respalden el tratamiento combinado a dosis fijas para todos los pacientes con IC-FEr. Un pequeño ECDA llevado a cabo en pacientes de raza negra mostró que la combinación de hidralazina y dinitratato de isosorbida añadida al tratamiento convencional (un IECA, un BB y un ARM) redujo la mortalidad y las hospitalizaciones por IC de los pacientes con IC-FEr en NYHA III-IV142. Los resultados de este estudio son difíciles de trasladar a pacientes de otro origen racial o étnico.
Para reducir la mortalidad, se puede considerar la combinación de hidralazina y dinitratato de isosorbida para los pacientes con IC-FEr sintomáticos que no toleren los IECA, INRA o ARA-II (o los tengan contraindicados). No obstante, esta recomendación se basa en el estudio Veterans Administration Cooperative, en el que solo se reclutó a pacientes varones con IC-FEr sintomáticos tratados solo con digoxina y diuréticos143.
5.4.5DigoxinaSe puede considerar la administración de digoxina para pacientes con IC-FEr en ritmo sinusal para reducir el riesgo de hospitalización144, aunque su efecto adicional al del tratamiento con BB no se ha probado. En el estudio DIG el efecto de la digoxina en la mortalidad fue neutro.
Los efectos de la digoxina en pacientes con IC-FEr y FA no se han estudiado en ECDA. En algunos estudios se observó una posible relación entre la digoxina y un riesgo más alto de eventos en pacientes con FA149,150, mientras que otro metanálisis sobre datos de estudios sin distribución aleatoria mostró que la digoxina no tiene efectos perjudiciales en la mortalidad de los pacientes con FA e IC, que en su mayoría tenían IC-FEr151. Por lo tanto, para los pacientes con IC sintomática y FA, la digoxina puede servir para tratar la IC-FEr y FA con frecuencia ventricular rápida cuando no se pueda aplicar otras opciones terapéuticas150,152−155.
Dado que la digoxina tiene un intervalo terapéutico muy estrecho, debe controlarse su concentración en sangre para mantener la concentración < 1,2ng/ml156,157. La administración de digoxina requiere precauciones especiales en mujeres, ancianos y pacientes con fragilidad, hipopotasemia o desnutrición. Para los pacientes con la función renal disminuida, se puede considerar la digitoxina; para los pacientes con IC en ritmo sinusal, está actualmente en estudio158.
5.4.6Avances recientes en ensayos clínicos sobre insuficiencia cardiaca con fracción de eyección reducidaEstimulador de la guanilato ciclasa soluble
El estudio VICTORIA evaluó la eficacia y la seguridad del estimulador oral de la guanilato ciclasa soluble (vericiguat) en pacientes con FEr e IC crónica recientemente descompensada. La incidencia de la variable combinada de muerte por causas cardiovasculares u hospitalización por IC fue menor en los pacientes tratados con vericiguat que con placebo141. No hubo una reducción de la mortalidad por cualquier causa o la mortalidad cardiovascular. Por lo tanto, se puede considerar el vericiguat, añadido al tratamiento estándar de la IC-FEr, para reducir el riesgo de mortalidad cardiovascular y hospitalizaciones por IC.
Activador de la miosina cardiaca
El estudio GALACTIC-HF evaluó la eficacia y la seguridad del activador de la miosina cardiaca omecamtiv mecarbilo en pacientes con IC-FEr en el contexto ambulatorio y hospitalario. La variable combinada de primer evento de IC o muerte cardiovascular se redujo en un 8%. No hubo una reducción significativa de la mortalidad cardiovascular. Actualmente, este fármaco no está aprobado para el tratamiento de la IC, pero en el futuro se podría considerar añadido al tratamiento estándar de la IC-FEr para reducir el riesgo de mortalidad cardiovascular y hospitalizaciones por IC159.
5.5Estrategias basadas en fenotipos para el tratamiento de la insuficiencia cardiaca con fracción de eyección reducidaAdemás de los tratamientos generales expuestos en esta sección, se puede considerar otras opciones para pacientes seleccionados, que se tratan en otras secciones de la guía. Las más relevantes (p. ej., las indicaciones de clase I-IIa relativas a la mortalidad y la hospitalización) se recogen en la figura 3. El efecto de algunas intervenciones en los síntomas y la calidad de vida se resumen en la tabla 9 del material adicional.
Ilustración central. Perspectiva general de estrategias basadas en el fenotipo para el tratamiento de la IC-FEr. Código de colores para las clases de recomendación: verde para clase I; amarillo para clase IIa (véase la Table 1 para más detalles sobre las clases de recomendación). La Figure muestra las opciones de tratamiento con recomendaciones de clases I y IIa. Véase las Tables específicas para las recomendaciones de clase IIb. ACM: asistencia circulatoria mecánica; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; AVP: aislamiento de venas pulmonares; BB: bloqueadores beta; BRI: bloqueo de rama izquierda; CABG: cirugía de revascularización coronaria; DAI: desfibrilador automático implantable; DNIS: dinitrato de isosorbida; IECA: inhibidores de la enzima de conversión de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; INRA: inhibidores de la neprilisina y los receptores de la angiotensina; RQVA: reemplazo quirúrgico de válvula aórtica; RS: ritmo sinusal; TAVI: implante percutáneo de válvula aórtica; TBB: reparación transcatéter borde con borde; TD: terapia de destino; TPC: terapia puente a ser candidato; TPT: terapia puente al trasplante; TRC-D: terapia de resincronización cardiaca con desfibrilador; TRC-MP: terapia de resincronización cardiaca con marcapasos; VM: válvula mitral.
Evidencia objetiva de alteraciones cardiacas estructurales, funcionales y serológicas compatibles con disfunción diastólica del ventrículo izquierdo con presiones de llenado elevadas.
| Parámetrosa | Umbrales | Comentarios |
|---|---|---|
| Índice de masa del VI; grosor relativo de la pared | ≥95g/m2 (mujeres), ≥ 115g/m2 (varones); > 0,42 | Aunque el remodelado concéntrico o la hipertrofia del VI respaldan el diagnóstico de IC-FEc, la ausencia de hipertrofia no lo excluye |
| Índice de volumen auricular izquierdoa | > 34ml/m2 en RS | En ausencia de FA o valvulopatía, la dilatación de la AI refleja la elevación crónica de la presión de llenado del VI (en presencia de FA, el umbral es > 40ml/m2) |
| E/e’ en reposo | > 9 | Sensibilidad del 78% y especificidad del 59% para determinar IC-FEc en pruebas invasivas de estrés, aunque la precisión diagnóstica ha variado. Un umbral de 13 tuvo menos sensibilidad (46%) pero mayor especificidad (86%)71,259,274 |
| NT-proBNP; BNP | > 125 (RS) o > 365 (FA) pg/ml; > 35 (RS) o > 105 (FA) pg/ml | Hasta un 20% de los pacientes con diagnóstico de IC-FEc confirmado mediante pruebas invasivas tienen los PN por debajo de los umbrales diagnósticos, especialmente en presencia de obesidad |
| Presión arterial pulmonar; velocidad del chorro en la IT en reposoa | > 35mmHg; > 2,8m/s | Sensibilidad del 54% y especificidad del 85% para detectar IC-FEc mediante pruebas invasivas de estrés259,261 |
BNP: péptido natriurético de tipo B; E/e’: velocidad temprana de llenado en Doppler transmitral/velocidad temprana de relajación en Doppler tisular; FA: fibrilación auricular; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IT: insuficiencia tricuspídea; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; PN: péptido natriurético; RS: ritmo sinusal; VI: ventrículo izquierdo.
A mayor número de alteraciones, mayor es la probabilidad de IC-FEc.aLa Table solo recoge los índices más utilizados; para los menos habituales, se refiere al lector al documento de consenso de la ESC/HFA259.
En esta sección se encuentran recomendaciones sobre el tratamiento con desfibrilador automático implantable (DAI) y terapia de resincronización cardiaca (TRC). Otros dispositivos implantables se tratan al final de esta sección.
6.1Desfibrilador automático implantableGran parte de las muertes de pacientes con IC, especialmente aquellos con síntomas leves, ocurren de modo súbito e inesperado. Muchas de ellas se deben a alteraciones eléctricas, como arritmias ventriculares, bradicardia y asistolia, aunque otras se deben a complicaciones vasculares agudas. Los tratamientos que mejoran o retrasan la progresión de la enfermedad cardiovascular reducen la tasa anual de muerte súbita105,160, pero no sirven para tratar las complicaciones arrítmicas cuando ocurren. El DAI es efectivo para la corrección de arritmias ventriculares potencialmente mortales y el uso de sistemas transvenosos previene la bradicardia. Algunos fármacos antiarrítmicos pueden reducir la tasa de taquiarritmias y muerte súbita, pero no reducen la mortalidad total161 e incluso pueden aumentarla.
Recomendaciones sobre el desfibrilador automático implantable para pacientes con insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Prevención secundaria | ||
| Se recomienda implantar un DAI para reducir el riesgo de muerte súbita y mortalidad por cualquier causa de los pacientes que se han recuperado de una arritmia ventricular causante de inestabilidad hemodinámica y tienen una esperanza de vida > 1 año en buen estado funcional si no haya una causa reversible o cuando la arritmia se produzca < 48 h después de un IM162−164 | I | A |
| Prevención primaria | ||
| Se recomienda implantar un DAI para reducir el riesgo de muerte súbita y mortalidad por cualquier causa de pacientes con IC sintomática (NYHA II-III) de etiología isquémica (excepto si han sufrido un IM durante los últimos 40 días; véase a continuación) y FEVI ≤ 35% pese al TMO ≥ 3 meses siempre que su esperanza de vida sea significativamente > 1 año en buen estado funcional161,165 | I | A |
| Se debe considerar el implante de un DAI para reducir el riesgo de muerte súbita y mortalidad por cualquier causa de los pacientes con IC sintomática (NYHA II-III) de etiología no isquémica y FEVI ≤ 35% pese al TMO ≥ 3 meses siempre que su esperanza de vida sea significativamente > 1 año en buen estado funcional161,166,167 | IIa | A |
| Antes de la sustitución del generador, los pacientes deben ser evaluados cuidadosamente por un cardiólogo con experiencia, ya que los objetivos del tratamiento, las necesidades del paciente y su estado clínico podrían haber cambiado168−172 | IIa | B |
| Se puede considerar un chaleco desfibrilador externo durante un tiempo corto o como tratamiento puente hasta el implante de un dispositivo para pacientes con riesgo de muerte súbita173−176 | IIb | B |
| No se recomienda implantar un DAI durante los primeros 40 días tras el IM, ya que durante este periodo esta intervención no mejora el pronóstico177,178 | III | A |
| No se recomienda el implante de un DAI para pacientes en NYHA IV con síntomas graves y refractarios a tratamiento farmacológico, excepto si son candidatos a TRC, DAV o trasplante cardiaco179−183 | III | C |
DAI: desfibrilador automático implantable; DAV: dispositivo de asistencia ventricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IM: infarto de miocardio; NYHA: clase funcional de la New York Heart Association; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca.
aClase de recomendación.
bNivel de evidencia.
Comparado con el tratamiento con amiodarona, el DAI reduce la mortalidad de los supervivientes a una parada cardiaca o que han sufrido arritmias ventriculares sintomáticas persistentes. Para estos pacientes, se recomienda implantar un DAI si se pretende aumentar la supervivencia; la decisión sobre el implante debe tener en cuenta la voluntad del paciente y su calidad de vida, la FEVI (el beneficio en supervivencia es incierto cuando la FEVI es > 35%) y la ausencia de otras enfermedades que puedan causar la muerte en un plazo de 1 año162−164,184.
6.1.2Prevención primaria de la muerte súbita cardiacaEn un análisis de los datos de más de 40.000 pacientes incluidos en 12 importantes estudios sobre IC, las tasas de muerte súbita disminuyeron en un 44% en un periodo de 20 años (desde mediados de la década de los noventa hasta 2015)160. Esto se debe, con casi toda seguridad, a los avances en el tratamiento de la IC, ya que las recomendaciones basadas en las guías, que incluyen BB, ARM, sacubitrilo-valsartán y TRC con marcapasos, reducen el riesgo de muerte súbita. Mientras que se ha demostrado que estos tratamientos reducen la mortalidad de los pacientes con IC-FEr, no ha ocurrido lo mismo con la amiodarona161. Si fuera preciso emplear amiodarona, hay que tomar precauciones debido a sus efectos adversos. La dronedarona185 y los antiarrítmicos de clase I disopiramida, encainida y flecainida186 no deben emplearse para la prevención de arritmias debido al aumento de mortalidad observado en ensayos clínicos.
Aunque el DAI reduce la tasa de muerte súbita por arritmias de los pacientes con IC-FEr187, se estima que el beneficio adicional de este dispositivo es menor en los pacientes que reciben tratamiento óptimo. En el estudio DANISH, las tasas de muerte súbita fueron más bajas en los pacientes con miocardiopatía no isquémica; solo 70 de 1.116 pacientes seguidos durante más de 5 años sufrieron muerte súbita166. Pese a la discreta reducción absoluta de muerte súbita con el dispositivo que incorpora un desfibrilador, esto no mejoró significativamente el riesgo total de mortalidad. Sin embargo, un análisis de subgrupos mostró que los pacientes de edad ≤ 70 años se beneficiaban de este tratamiento188. En un reciente metanálisis de estudios sobre el efecto del DAI en la miocardiopatía no isquémica, se observó un beneficio en supervivencia que disminuyó significativamente al incluirse los resultados del estudio DANISH167.
En general, los pacientes con cardiopatía isquémica tienen más riesgo de muerte súbita que los pacientes con cardiopatía no isquémica, de modo que, aunque los beneficios relativos son similares, el beneficio absoluto es mayor para los pacientes con cardiopatía isquémica187. En 2 ECDA no se observaron beneficios en pacientes a los que implantó un DAI en los primeros 40 días tras un IM177,178. Aunque se redujo el número de muertes súbitas por arritmias, este beneficio se contrarrestó por el aumento de muertes no arrítmicas. En consecuencia, el implante de DAI para la prevención primaria está contraindicado en ese periodo. El implante de DAI solo se recomienda si, tras un periodo de 3 meses, el TMO no logra aumentar la FEVI a>35%. El TMO incluye fármacos con recomendación de clase I para la IC-FEr. No obstante, los estudios sobre DAI citados en esta guía son anteriores a los INRA y los iSGLT2. Se desconoce si el implante de DAI reduce la mortalidad de los pacientes con FEVI > 35%. Está en curso un estudio sobre los DAI en este tipo de pacientes que además tienen tejido cicatricial detectado mediante RMC189.
6.1.3Selección de pacientes para terapia con desfibrilador automático implantableSe debe valorar a los pacientes con IC-FEr y QRS ≥ 130ms para tratamiento mediante TRC con desfibrilador (TRC-D) más que con DAI. En la sección 6.2 se encuentra más información sobre la TRC.
En pacientes con IC moderada o grave, la reducción de la tasa de muerte súbita podría resultar parcial o totalmente contrarrestada por el aumento de muertes debido al empeoramiento de la IC161. Por ello, no se recomienda el tratamiento con DAI para los pacientes en NYHA IV con síntomas graves refractarios a tratamiento farmacológico que no sean candidatos a TRC, DAV o trasplante cardiaco, dado que tienen una esperanza de vida corta y muchas probabilidades de morir por fallo de bomba. Del mismo modo, los pacientes con comorbilidades graves que tienen pocas probabilidades de vivir más de 1 año con una buena calidad de vida probablemente no obtengan un beneficio importante de un DAI179−183.
Aunque en el estudio DANISH los pacientes con miocardiopatía no isquémica no obtuvieron un beneficio significativo con el DAI, esta entidad es heterogénea y algunos subgrupos de pacientes (p. ej., con laminopatías o sarcoidosis) tienen un riesgo más alto de muerte súbita, por lo que requieren una valoración detenida del tratamiento con DAI. Para ello, pueden ser útiles algunas medidas para la estratificación del riesgo (p. ej., extensión del tejido cicatricial mediante RMC)190−192.
Los pacientes deben recibir información y asesoramiento sobre el tratamiento con DAI, las posibles complicaciones relativas al implante, las implicaciones para la conducción de vehículos y el riesgo de descargas inapropiadas, y participar en el proceso de toma de decisiones. Además, los pacientes deben saber en qué circunstancias se debe desactivar el DAI o el componente desfibrilador de la TRC-D (p. ej., enfermedad terminal) o explantar (infección, recuperación de la función del VI)193. Después se debe tratar con el paciente y sus cuidadores la desactivación del desfibrilador.
Cuando el generador del DAI alcance el final de su vida útil o requiera explante, no se debe reemplazar automáticamente; esta decisión debe ser compartida168−172. Un cardiólogo con experiencia debe someter a los pacientes a una evaluación minuciosa, ya que los objetivos del tratamiento pueden haber cambiado desde el implante (el riesgo de arritmia mortal podría ser menor o mayor que el de muerte no arrítmica). Existe controversia en cuanto a si se debe someter al implante de otro dispositivo a los pacientes cuya FEVI haya mejorado sustancialmente y no hayan requerido tratamiento del dispositivo durante la vida media del DAI168−172.
6.1.4Programación del desfibrilador automático implantableActualmente, tras el implante de un DAI o TRC-D, no se hacen pruebas periódicas de los umbrales de desfibrilación, ya que estas no mejoran la eficacia de las descargas ni reducen las muertes arrítmicas194. La programación conservadora con intervalos largos195 entre la detección y la aplicación de la descarga del DAI reduce sustancialmente el riesgo de descargas inapropiadas o apropiadas pero innecesarias194,196,197. Por lo general, en prevención primaria, los desfibriladores se programan para minimizar la estimulación eléctrica (p. ej., estimulación ventricular a demanda en modo VVI con una frecuencia mínima de 40 lpm) y con una zona de tratamiento de la taquicardia > 200 lpm194,198. Por último, y especialmente en prevención secundaria, la programación del desfibrilador se debe adaptar a las necesidades específicas de los pacientes.
6.1.5Desfibrilador automático subcutáneo o sin electrodosLos desfibriladores subcutáneos pueden ser tan efectivos como el DAI convencional y tienen una tasa de complicaciones similar. Aunque inicialmente el riesgo de descargas inapropiadas era más alto, se ha demostrado que, con una selección adecuada de los pacientes, los desfibriladores subcutáneos son no inferiores a los DAI transvenosos199−202. Este dispositivo puede ser la opción preferida para los pacientes con un acceso venoso difícil o que requieran el explante del DAI debido a infección. Se debe seleccionar cuidadosamente a los pacientes, ya que estos desfibriladores no pueden tratar bradiarritmias (excepto estimulación tras un shock) y no puede aplicar estimulación eléctrica antitaquicárdica ni TRC. Se esperan nuevos ECDA sobre estos dispositivos y datos a largo plazo sobre su seguridad y su eficacia.
Se puede considerar el uso por un tiempo breve de un desfibrilador externo con capacidad para reconocer e interrumpir las arritmias ventriculares para pacientes seleccionados con IC y riesgo alto de muerte súbita pero que no son candidatos a implante de un DAI162,175,176,203. Sin embargo, el estudio VEST no logró demostrar una reducción de las muertes arrítmicas con el desfibrilador externo en pacientes con FEVI ≤ 35% que habían sufrido recientemente un IAM204.
Para consultar las recomendaciones sobre prescripción e indicaciones del DAI, se refiere al lector a la guía de la ESC/EHRA sobre taquiarritmias ventriculares y muerte súbita201.
6.2Terapia de resincronización cardiacaRecomendaciones sobre la terapia de resincronización cardiaca para pacientes con insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| La TRC está recomendada para pacientes sintomáticos con IC, ritmo sinusal, QRS ≥ 150 ms y con morfología de BRI, FEVI ≤ 35% a pesar del TMO, a efectos de mejorar los síntomas y reducir la morbimortalidad205−215 | I | A |
| Para pacientes con IC-FEr que tienen una indicación para marcapasos ventricular y BAV de alto grado, se recomienda la TRC en lugar de marcapasos del VD independientemente de la clase funcional de la NYHA o la amplitud del QRS, a efectos de reducir la morbilidad. Esto incluye a los pacientes con FA216−219 | I | A |
| Se debe considerar la TRC para pacientes sintomáticos con IC, en ritmo sinusal con QRS ≥ 150 ms y de morfología sin BRI, con FEVI ≤ 35% a pesar del TMO, a efectos de mejorar los síntomas y reducir la morbimortalidad205−215 | IIa | B |
| Se recomienda la TRC para pacientes sintomáticos con IC, en ritmo sinusal con QRS de 130-149 ms y morfología de BRI, con FEVI ≤ 35% a pesar del TMO, a efectos de mejorar los síntomas y reducir la morbimortalidad211,220 | IIa | B |
| Se debe considerar la TRC para los pacientes con IC-FEr que tienen un marcapasos convencional o un DAI y después sufren un empeoramiento de la IC pese al TMO y tienen un porcentaje alto de estimulación del VD221 | IIa | B |
| Se puede considerar la TRC para pacientes sintomáticos con IC, en ritmo sinusal con QRS de 130-149 ms y morfología sin BRI, con FEVI ≤ 35% pese al TMO, para mejorar los síntomas y reducir la morbimortalidad208,213 | IIb | B |
| No se recomienda la TRC para pacientes con QRS < 130 ms que no tengan una indicación de marcapasos debido a BAV de grado alto222−224 | III | A |
BAV: bloqueo auriculoventricular; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NYHA: clase funcional de la New York Heart Association; TMO: tratamiento médico óptimo (tratamientos médicos con recomendación de clase I durante al menos 3 meses); TRC: terapia de resincronización cardiaca; VD: ventrículo derecho.
aClase de recomendación.
bNivel de evidencia.
La TRC reduce la morbimortalidad de pacientes seleccionados211 y mejora la función cardiaca y la calidad de vida209,225.
Mientras que los estudios CARE-HF206,208 y COMPANION210 compararon la TRC con el tratamiento médico (TM), la mayoría de los estudios compararon TRC-D y DAI y un pequeño número comparó la TRC-D con el MP de apoyo. La prevención de bradicardias mortales puede ser un mecanismo importante del beneficio de compartido por todos los dispositivos de estimulación eléctrica. En la fase inicial del estudio CARE-HF, el 25% de los pacientes tenían una frecuencia cardiaca en reposo ≤ 60 lpm206,208,209. Si la prevención de la bradicardia es importante, el efecto de la TRC parecerá mayor en los estudios cuyos grupos de control no emplean ningún dispositivo. No obstante, en el 35% de los pacientes del estudio MADIT-II fallecidos con un DAI, la muerte fue súbita pese a estar protegidos contra bradicardias y taquiarritmias226.
En la mayoría de los estudios sobre TRC se especificó que la FEVI debía ser ≤ 35%, pero los estudios RAFT212 y MADIT-CRT213,214 especificaron una FEVI ≤ 30%; el estudio REVERSE207,215,227, ≤ 40% y el BLOCK-HF216, ≤ 50%. Los pacientes con FEVI del 35-40% aleatorizados son relativamente pocos, pero un metanálisis de datos de pacientes individuales mostró que el efecto de la TRC no es menor en este grupo211.
La evaluación de la «respuesta» a la TRC es compleja. Muchos pacientes que no parecen responder favorablemente a la TRC en cuanto a los síntomas y la función del VI podrían tener beneficios en la mortalidad. Varias características predicen la reducción de la morbimortalidad, y el grado de remodelado inverso es uno de los más importantes mecanismos de acción de la TRC. Los pacientes con IC-FEr de etiología isquémica tienen menos mejoría de la función del VI por el tejido cicatricial miocárdico, donde es menos probable un remodelado favorable228. Sin embargo, las mujeres tienen más probabilidades que los varones de responder al tratamiento, posiblemente debido al menor tamaño del cuerpo y el corazón220,224,229. La amplitud del complejo QRS predice la respuesta a la TRC y fue uno de los criterios de inclusión de todos los estudios aleatorizados211, pero la morfología del QRS también se ha relacionado con una respuesta positiva a la TRC. Varios estudios han mostrado que los pacientes con morfología de bloqueo de rama izquierda (BRI) son más propensos a responder favorablemente a la TRC, mientras que hay más incertidumbre respecto a los pacientes con morfologías diferentes del BRI230. Este último grupo no está suficientemente representado en los grandes estudios sobre TRC206,210,213. Sin embargo, los pacientes con morfología de BRI suelen tener mayor duración del QRS, y actualmente se debate si la duración o la morfología del QRS son el predictor principal de una respuesta favorable a la TRC. Los resultados de 2 metanálisis de datos de pacientes individuales indican que, después de tener en cuenta la duración del QRS, quedan pocas pruebas de que la morfología del QRS o la etiología de la enfermedad puedan influir en el efecto de la TRC en la morbimortalidad211,220. Además, ninguno de los estudios más importantes seleccionó a pacientes según la morfología del QRS, el sexo o la etiología isquémica ni tenía suficiente potencia estadística para el análisis de subgrupos.
El Echo-CRT trial222,223 y un metanálisis de datos de pacientes individuales213 indican que la TRC podría ser perjudicial si el QRS es > 130ms, por lo que no se recomienda la TRC en estos casos. Si un paciente programado para implante de DAI se encuentra en ritmo sinusal con BRI, se debe considerar la TRC-D con QRS 130-149ms y está recomendada si el QRS es ≥ 150ms. Sin embargo, la práctica clínica en distintos países es muy variada y, si la razón principal de la TRC es el alivio de los síntomas, el médico debe decidir si implanta TRC-MP o TRC-D, lo que considere más adecuado. El único estudio aleatorizado que comparó la TRC-MP con la TRC-D210 no logró demostrar diferencia alguna en la morbimortalidad entre ambas técnicas (aunque el estudio no tenía suficiente potencia para detectar esta diferencia). Un análisis de subgrupos del estudio DANISH, que incluyó a pacientes con miocardiopatía no isquémica —el 58% tratados con TRC— no demostró la inferioridad de la TRC-MP frente a la TRC-D166,167.
Cuando la FEVI está reducida, la estimulación eléctrica del VD puede exacerbar la disincronía cardiaca. Esto se puede prevenir mediante TRC, que mejora los resultados de los pacientes216−218,231. Sin embargo, no se observó ninguna diferencia entre la TRC y la estimulación eléctrica del VD en un análisis de subgrupos del estudio RAFT212. En suma, se recomienda la TRC, más que la estimulación eléctrica del VD, para los pacientes con IC-FEr en cualquier clase funcional (NYHA) que tengan indicada la estimulación eléctrica ventricular para reducir la morbilidad, aunque no se ha observado un efecto claro en la mortalidad. Se debe considerar la TRC para los pacientes con IC-FEr a los que se ha implantado un marcapasos convencional o un DAI y después sufren un deterioro de la IC con un porcentaje alto de estimulación eléctrica pese al TMO.
Solo 2 estudios pequeños compararon el tratamiento farmacológico con la TRC en pacientes con FA, pero los resultados son conflictivos. Varios estudios indican que la TRC es superior a la estimulación eléctrica del VD en pacientes sometidos a ablación del nódulo auriculoventricular (NAV)217,218,231. Sin embargo, la FA no es una indicación para llevar a cabo la ablación en pacientes tratados con TRC, a excepción de algunos casos raros en los que persiste una frecuencia ventricular excesivamente alta pese al intento de controlar la frecuencia mediante tratamiento farmacológico. Un análisis de subgrupos del estudio RAFT no mostró beneficio de la TRC-D comparada con el DAI, aunque menos de la mitad de los pacientes tenían una captura biventricular > 90%219. Dada la falta de evidencia de la eficacia de la TRC en pacientes con FA, sería razonable tratar con estimulación biventricular a determinados pacientes, especialmente aquellos con QRS ≥ 150ms, siempre que sea posible.
Los datos de estudios observacionales indican que, cuando la captura biventricular es < 98%, el pronóstico de los pacientes sometidos a TRC es menos favorable218,232. No está claro si esta asociación refleja una pérdida de resincronización (que se puede remediar con la programación del dispositivo), una inadecuada posición del electrodo del VI o una mayor dificultad para la estimulación eléctrica del miocardio enfermo. Esta observación no se ha confirmado en ningún estudio aleatorizado.
En estudios más antiguos no se demostró la utilidad de las pruebas de imagen de disincronía para la selección de pacientes para TRC233. Un estudio reciente indica que 2 nuevos marcadores (balanceo apical y destello septal) se asocian con la respuesta a la TRC, aunque estos marcadores no se han probado como criterios de selección o subgrupo preespecificado en ensayos aleatorizados234. Los pacientes con cicatrices extensas en el tejido miocárdico tienen menos probabilidades de que la TRC mejore la función del VI, pero esto se puede aplicar a cualquier tratamiento para la IC-FEr y no permite predecir de manera fiable un menor beneficio clínico. Los umbrales de estimulación eléctrica son más altos en el miocardio cicatricial y, siempre que sea posible, se debe evitar esa región para la colocación del electrodo235,236. Aunque los pacientes con cicatrices extensas tienen intrínsecamente un peor pronóstico, hay pocas pruebas de que obtengan menos beneficio pronóstico de la TRC211.
No está claro si es útil intentar optimizar los intervalos AV o VV tras el implante aplicando criterios ecocardiográficos o electrocardiográficos, o la respuesta de la PA, pero se puede considerar para pacientes que no hayan respondido adecuadamente a la TRC237,238. Otras opciones que se pueden considerar para optimizar la respuesta a la TRC se describen en un artículo recientemente publicado239.
Después del implante de TRC, se recomienda revisar el tratamiento diurético, ya que podría ser necesario reducir la dosis o interrumpir el tratamiento. Además, la TRC podría brindar la oportunidad de mejorar el tratamiento farmacológico de la IC-FEr240.
Se remite al lector a la guía sobre marcapasos y TRC donde se encuentran las recomendaciones sobre los procedimiento de implante de dispositivos240a.
6.3Otros dispositivos en investigaciónLa modulación de la contractilidad cardiaca, que se ha probado en pacientes con IC y NYHA III-IV, FEVI ≤ 25-45% y QRS < 130ms, se asoció con una pequeña mejora de la tolerancia al ejercicio y la calidad de vida241,242.
Los dispositivos que modifican la actividad del sistema nervioso autónomo, como la activación barorrefleja243,244, también mostraron alguna mejora en la tolerancia al esfuerzo y la calidad de vida. Sin embargo, la evidencia disponible se considera insuficiente para establecer recomendaciones específicas sobre estos y otros dispositivos eléctricos implantables para reducir la mortalidad o las hospitalizaciones (véase la sección 16. Lagunas en la evidencia).
7INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN LIGERAMENTE REDUCIDA7.1Diagnóstico de la insuficiencia cardiaca con fracción de eyección ligeramente reducidaEl diagnóstico de la IC-FElr requiere que haya síntomas y signos de IC y una FEVI ligeramente reducida (41-49%). Las altas concentraciones de PN (BNP ≥ 35pg/ml o NT-proBNP ≥ 125pg/ml) y otra evidencia de enfermedad estructural (tamaño aumentado de la AI, hipertrofia del VI o mediciones ecocardiográficas del llenado del VI) hacen que el diagnóstico sea más probable, pero no son imprescindibles si hay certeza sobre la medición de la FEVI.
En la figura 1 se encuentra un algoritmo para el diagnóstico de la IC-FElr. Las pruebas para determinar la etiología subyacente se recogen en la tabla 5 (pruebas diagnósticas independientemente de la FEVI).
7.2Características clínicas de los pacientes con insuficiencia cardiaca y fracción de eyección ligeramente reducidaEn la IC, las distintas categorías de FEVI comparten características clínicas, factores de riesgo, patrones de remodelado cardiaco y resultados. Como promedio, los pacientes con IC-FElr presentan características más similares a la IC-FEr que a la IC-FEc, en cuanto a que más frecuentemente son varones, jóvenes y con más probabilidades de EC (50-60%)38,42,43, y tienen menos probabilidades de FA y comorbilidades no cardiacas (tabla 10 del material adicional). Sin embargo, los pacientes ambulatorios con IC-FElr tienen menos mortalidad, al igual que los pacientes con IC-FEc.
Factores de riesgo de insuficiencia cardiaca y posibles acciones para corregirlos.
| Factores de riesgo de insuficiencia cardiaca | Estrategias preventivas |
|---|---|
| Sedentarismo | Actividad física regular |
| Tabaquismo | Dejar de fumar |
| Obesidad | Actividad física y dieta saludable |
| Consumo excesivo de alcohol286 | Población general: la abstinencia o el consumo muy moderado son beneficiosos. Los pacientes con miocardiopatía inducida por el alcohol deben abstenerse |
| Influenza | Vacunación |
| Microbios (Trypanosoma cruzi, estreptococos) | Diagnóstico precoz y tratamiento específico |
| Fármacos cardiotóxicos (p. ej., antraciclinas) | Monitorización de la función cardiaca y los efectos secundarios, adaptación de la dosis, cambio de quimioterapia |
| Radiación torácica | Monitorización de la función cardiaca y los efectos secundarios, adaptación de la dosis |
| Hipertensión | Cambios en el estilo de vida, tratamiento antihipertensivo |
| Dislipemia | Dieta saludable, estatinas |
| Diabetes mellitus | Actividad física, dieta saludable, iSGLT2 |
| Enfermedad coronaria | Cambios en el estilo de vida, estatinas |
iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
Entre los pacientes con IC-FElr se puede incluir a aquellos cuya FEVI ha mejorado desde ≤ 40% o ha disminuido desde ≥ 50%50.
7.3Tratamiento de los pacientes con insuficiencia cardiaca y fracción de eyección ligeramente reducidaComo en otras formas de la IC, se debe administrar diuréticos para controlar la congestión. No hay ECDA prospectivos exclusivamente con pacientes con IC-FElr (tabla 11 del material adicional). Se puede extraer algunos datos de análisis de subgrupos de estudios sobre IC-FEc, pero ninguno de ellos logró el objetivo principal. Aunque actualmente no pueden establecerse recomendaciones firmes sobre tratamientos específicos, la guía incluye algunas recomendaciones para guiar el tratamiento de este grupo de pacientes.
Tratamientos farmacológicos que tener en consideración para pacientes con insuficiencia cardiaca (NYHA II-IV) y fracción de eyección ligeramente reducida.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Para los pacientes con IC-FElr y congestión, se recomienda el tratamiento diurético para aliviar síntomas y signos137 | I | C |
| Para los pacientes con IC-FElr, se puede considerar un IECA a efectos de reducir el riesgo de hospitalización por IC y muerte11 | IIb | C |
| Para los pacientes con IC-FElr, se puede considerar un ARA-II a efectos de reducir el riesgo de hospitalización por IC y muerte245 | IIb | C |
| Para los pacientes con IC-FElr, se puede considerar un bloqueador beta a efectos de reducir el riesgo de hospitalización por IC y muerte12,119 | IIb | C |
| Para los pacientes con IC-FElr, se puede considerar un ARM a efectos de reducir el riesgo de hospitalización por IC y muerte246 | IIb | C |
| Para los pacientes con IC-FElr, se puede considerar el sacubitrilo-valsartán a efectos de reducir el riesgo de hospitalización por IC y muerte13,247 | IIb | C |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; IC: insuficiencia cardiaca; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; NYHA: clase funcional de la New York Heart Association.
aClase de recomendación.
bNivel de evidencia.
Características y componentes más relevantes de los programas de atención de la insuficiencia cardiaca.
| Características |
|---|
| Centrados en los pacientes y las personasMultidisciplinarioEl objetivo del programa debe ser flexible e incluir:• Prevención de la progresión de la enfermedad• Control de los síntomas• Que los pacientes permanezcan en su lugar de elección durante la fase terminal de la insuficiencia cardiaca• Personal competente y con adecuada preparación profesional• Promover la participación de los pacientes y cuidadores para que conozcan la enfermedad y colaboren en el tratamiento |
| ComponentesTratamiento optimizado; estilo de vida y opciones de tratamiento con fármacos y dispositivosFormación para el paciente, en la que destacan especialmente el autocuidado y el control de los síntomasProvisión de apoyo psicosocial a los pacientes y cuidadores familiaresSeguimiento después del alta (en consulta, atención domiciliaria, contacto telefónico o telemonitorización)Fácil acceso a los servicios de salud, sobre todo para prevenir o tratar los episodios de descompensaciónEvaluación de cambios inexplicables en peso, estado nutricional y funcional, calidad de vida, alteraciones del sueño, problemas psicosociales u otros hallazgos, como resultados de pruebas de laboratorio (e intervención adecuada si es necesaria)Acceso a opciones de tratamiento avanzadas; cuidados paliativos y de apoyo |
No hay estudios específicos sobre los IECA en pacientes con IC-FElr. Aunque el estudio PEP-CHF incluyó a pacientes con IC-FEc y FEVI > 40%, no reportó resultados según la FEVI11.
No obstante, muchos de los pacientes con IC-FElr también sufren EC, hipertensión o disfunción sistólica del VI, por lo que están en tratamiento con un IECA.
En consecuencia, se puede considerar los IECA para los pacientes con IC-FElr.
7.3.2Antagonistas del receptor tipo 1 de la angiotensina IINo hay estudios específicos sobre los ARA-II para pacientes con IC-FElr. El estudio CHARM-Preserved no obtuvo resultados significativos en la variable principal de muerte cardiovascular u hospitalizaciones245, pero un análisis retrospectivo mostró una reducción del número de pacientes con IC-FElr hospitalizados por IC que recibieron tratamiento con candesartán (con tendencias similares para la mortalidad cardiovascular y por cualquier causa)8. Además, en un análisis de las complicaciones recurrentes, se observó una reducción de las hospitalizaciones por IC en toda la cohorte del estudio CHARM-Preserved, incluidos los pacientes con IC-FElr248.
Al igual que en el caso de los IECA, muchos pacientes con IC-FElr reciben tratamiento con un ARA-II para otras indicaciones cardiovasculares, de modo que se puede considerar estos fármacos para los pacientes con IC-FElr.
7.3.3Bloqueadores betaNo hay estudios específicos sobre los BB para pacientes con IC-FElr. Un metanálisis de datos de pacientes individuales de los estudios más importantes sobre BB mostró reducciones similares de muerte cardiovascular y por cualquier causa (del 50%) entre los pacientes en ritmo sinusal con IC-FEr o IC-FElr12. Este metanálisis incluyó el estudio SENIORS, en el que el nebivolol redujo la variable combinada de muerte por cualquier causa o ingresos por causas cardiovasculares en toda la población del estudio. No se observó ninguna interacción entre la FEVI (el 35% de los pacientes tenían la FEVI en un 35-50%) y el efecto del nebivolol en la variable principal119,249. Numerosos pacientes con IC-FElr pueden tener otra indicación cardiovascular para el tratamiento con un BB, como FA o angina. Por lo tanto, se puede considerar estos fármacos para los pacientes con IC-FElr.
7.3.4Antagonistas del receptor de mineralcorticoidesNo se han hecho estudios específicos sobre los ARM en la IC-FElr. En un análisis retrospectivo del estudio TOPCAT, que incluyó a pacientes con FEVI ≥ 45%9, la espironolactona redujo las hospitalizaciones por IC de los pacientes con FEVI < 55%. Se observó una tendencia similar en la mortalidad cardiovascular, pero no por cualquier causa.
Se puede considerar el tratamiento con un ARM para los pacientes con IC-FElr.
7.3.5Inhibidor de la neprilisina y el receptor de la angiotensinaNo se ha hecho ningún estudio específico sobre los INRA en la IC-FElr. En el estudio PARAGON-HF, que incluyó a pacientes con FEVI ≥ 45%, se observó una interacción significativa del efecto del tratamiento en la FE, aunque el estudio no obtuvo resultados significativos en la variable principal de valoración. Comparado con valsartán, el sacubitrilo-valsartán redujo en un 22% la variable primaria compuesta de muerte cardiovascular y el total de las hospitalizaciones por IC de los pacientes con una FE inferior o igual a la media del 57%13. Los datos de un análisis combinado de los estudios PARADIGM-HF y PARAGON-HF muestran que el sacubitrilo-valsartán, comparado con otros inhibidores del SRAA, tiene un efecto beneficioso, especialmente en hospitalización por IC de los pacientes con IC-FElr247.
Se puede considerar el tratamiento con un INRA para los pacientes con IC-FElr.
7.3.6Otros fármacosEn el estudio DIG10 se observó una tendencia a menos hospitalizaciones por IC en los pacientes con IC-FElr en ritmo sinusal asignados a tratamiento con digoxina, pero no se observó una reducción de la mortalidad y hubo un exceso de muertes cardiovasculares. No hay suficientes datos para recomendarla.
Tampoco hay datos suficientes sobre la ivabradina en la IC-FElr que permitan extraer conclusiones.
7.3.7DispositivosMientras que análisis retrospectivos de los estudios más importantes sobre la TRC indican que este tratamiento puede ser beneficioso para los pacientes con FEVI > 35%, los estudios sobre TRC para pacientes con IC-FElr se abandonaron prematuramente por el insuficiente número de pacientes reclutados250. No hay estudios relevantes sobre DAI en prevención primaria de arritmias ventriculares en la IC-FElr, y los estudios llevados a cabo hace más de 20 años no mostraron beneficio alguno del implante de DAI para la prevención secundaria de las arritmias ventriculares en la IC-FElr.
No hay datos suficientes para recomendar el tratamiento con TRC o DAI para los pacientes con IC-FElr.
El implante de un dispositivo de descompresión interauricular (shunt) se demostró seguro en pacientes con FEVI ≥ 40%. Se esperan los resultados de un estudio de mayor tamaño para establecer recomendaciones sobre este dispositivo en la IC-FEc o la IC-FEr251.
8INSUFICIENCIA CARDIACA CON FRACCIÓN DE EYECCIÓN CONSERVADA8.1Antecedentes de la insuficiencia cardiaca con fracción de eyección conservadaEn esta guía se abordan los cambios históricos de la nomenclatura y la falta de consenso sobre los valores de corte óptimos de la FEVI para definir al grupo de pacientes con IC y sin una FEVI claramente reducida. El término «conservada» se propuso originalmente en el estudio CHARM sobre el tratamiento de la IC con candesartán para referirse a los pacientes con una FE que no era claramente «reducida» ni completamente «normal» (> 40%)252. Aunque en la guía vigente la FEVI del 41-49% sirve para designar a los pacientes con IC-FElr, sigue abierto el debate sobre qué constituye una FE «ligeramente reducida», qué valores de corte se debería aplicar y si estos son diferentes para varones y mujeres14,253. Según la EACVI, la disfunción sistólica se define como una FE < 52% en varones y < 54% en mujeres16.
Se ha considerado también si la IC con una FE más alta se debe designar como IC con FE «normal»14,254. Sin embargo, dada la variabilidad de las mediciones ecocardiográficas de la FEVI, las dificultades para interpretar la FEVI determinada mediante distintas modalidades de imagen y la controversia sobre el valor de corte para definir una FEVI «normal» —que puede variar no solo con el sexo, sino también con otros factores como la edad y el origen étnico255—, esta guía mantiene la denominación IC-FEc con un valor de corte de FEVI del 50%. Además, hay que recordar que la FEVI es una variable continua con una distribución normal en la población general, de modo que los valores de corte empleados en las definiciones son arbitrarios. Asimismo, mientras que el valor de corte para definir una FEVI «normal» suele ser > 50%, en caso de ser muy alta (> 65-70%), se debe investigar posibles afecciones como amiloidosis cardiaca o miocardiopatía hipertrófica, en las que una FE muy superior a lo normal puede producirse por una disminución del volumen telediastólico del VI (denominador de la FE)256,257.
8.2Características clínicas de los pacientes con insuficiencia cardiaca y fracción de eyección conservadaLa IC-FEc se diferencia de la IC-FEr y la IC-FElr en que los pacientes son más mayores y más frecuentemente mujeres. La FA, la ERC y las comorbilidades no cardiovasculares suelen ser más comunes en los pacientes con IC-FEc que con IC-FEr258.
Numerosas causas pueden producir IC-FEc (tabla 5). La fisiopatología de los síndromes de IC-FEc es diferente y requiere distintas terapias. Los signos de alarma de la presencia de amiloidosis cardiaca son una PA más baja de lo normal en pacientes con antecedentes de hipertensión, intolerancia al tratamiento con BB o IECA, antecedente de síndrome del túnel carpiano bilateral, bajo voltaje en el ECG y ciertas características ecocardiográficas como el engrosamiento del septo, la pared posterior o el VD, aurículas dilatadas, derrame pericárdico pequeño o engrosamiento valvular (para más información, consulte la sección 14.2 sobre miocardiopatías). Además, es importante descartar otras entidades que pueden semejar la IC-FEc, como neumopatías, anemia, obesidad y deterioro físico. La declaración de posición de la ESC/HFA proporciona más información sobre la IC-FEc259.
8.3Diagnóstico de la insuficiencia cardiaca con fracción de eyección conservadaEl diagnóstico de la IC-FEc sigue siendo complejo. Varias sociedades científicas y ensayos clínicos han propuesto criterios diagnósticos260 cuyas sensibilidad y especificidad para el diagnóstico de la IC-FEc varían ampliamente. Recientemente se han propuesto 2 algoritmos diagnósticos basados en escalas (H2FPEF y HFA-PEFF)259,261, y aunque se han probado en varios estudios y cohortes observacionales, su utilidad diagnóstica es variable262−269.
Ambas escalas confieren una probabilidad intermedia de IC-FEc a una proporción alta de pacientes que, por lo tanto, requieren pruebas diagnósticas adicionales. Dependiendo de la escala que se use, diferentes pacientes son referidos para pruebas diagnósticas adicionales o se les diagnostica IC-FEc. Además, las pruebas especializadas que se recomiendan en algunos algoritmos diagnósticos no están disponibles en todos los centros, lo cual limita la aplicación clínica de las escalas y confirma la dificultad del diagnóstico de la IC-FEc267.
Para facilitar una aplicación clínica generalizada, esta guía recomienda una estrategia pragmática simplificada que recoge los componentes principales de los criterios diagnósticos anteriores y destaca las variables más empleadas y disponibles en la práctica clínica. Se ha demostrado que los valores de corte de algunas de estas variables, particularmente la dimensión de la AI (índice del volumen auricular izquierdo>32ml/m2), la velocidad mitral E>90cm/s, la velocidad septal e’<9cm/s y el cociente E/e’ > 9, son puntos de corte fundamentales a partir de los cuales aumenta el riesgo de mortalidad, lo que destaca su valor270. Esta recomendación concuerda con el documento de consenso de la HFA que propone una estrategia diagnóstica simplificada, y no un nuevo algoritmo o escala diagnóstica. Los profesionales con acceso a técnicas avanzadas pueden encontrar información adicional en el esquema diagnóstico completo recomendado por la HFA259.
La estrategia diagnóstica simplificada comienza con la evaluación de la probabilidad pretest (véase las características clínicas expuestas anteriormente). El diagnóstico debe incluir los siguientes componentes:
- •
Síntomas y signos de IC.
- •
FEVI ≥ 50%*.
- •
Datos objetivos de alteraciones cardiacas estructurales o funcionales, compatibles con disfunción diastólica del VI o presiones de llenado del VI elevadas, como las altas concentraciones de PN (tabla 9).
*A los pacientes con antecedentes de FEVI manifiestamente reducida (≤ 40%) que después presentan una FEVI ≥ 50% se les debe considerar con IC-FEr recuperada o «IC con FEVI mejorada», más que IC-FEc. Se recomienda continuar el tratamiento de la IC-FEr271 para estos pacientes. Se desconoce si es beneficioso iniciar el tratamiento de la IC para pacientes con una FEVI recuperada. Los pacientes con IC-FEc suelen tener una FEVI que se mantiene estable272. Sin embargo, alrededor de un tercio de los pacientes que tienen indicado repetir la ecocardiografía durante el seguimiento tienen una disminución de la FEVI273.
En caso de FA, el umbral del índice de volumen auricular izquierdo es>40ml/m2. Los umbrales para la prueba de estrés son un E/e’ ≥ 15 o una velocidad de regurgitación tricuspídea > 3,4m/s durante estrés máximo275. Un strain longitudinal global del VI<16% tiene una sensibilidad del 62% y una especificidad del 56% para el diagnóstico de la IC-FEc mediante pruebas invasivas261.
En los casos de diagnóstico incierto, la estrategia diagnóstica debe incluir pruebas confirmatorias adicionales, como la prueba de esfuerzo cardiopulmonar (para confirmar una reducción de la capacidad de esfuerzo e identificar la causa de la disnea), pruebas de estrés y pruebas hemodinámicas invasivas259.
Si los resultados de la ecocardiografía en reposo y los marcadores de laboratorio no son concluyentes, se recomienda hacer una prueba de estrés diastólico259,274. El diagnóstico de IC-FEc se puede confirmar mediante técnicas invasivas para determinar parámetros hemodinámicos durante el ejercicio. La determinación invasiva de una presión de enclavamiento pulmonar (PCWP) ≥ 15mmHg en reposo o ≥ 25mmHg durante el ejercicio o una presión telediastólica del VI ≥ 16mmHg en reposo se consideran diagnósticas266. En lugar de un valor de corte para la PCWP durante el ejercicio, algunos han usado un índice de PCWP y gasto cardiaco para el diagnóstico invasivo de la IC-FEc260,276. Dado que las pruebas hemodinámicas invasivas no están disponibles en muchos centros en todo el mundo y que estas se asocian con riesgos, se limitan al ámbito de la investigación. Debido a que no hay tratamientos modificadores de la enfermedad, esta guía no recomienda pruebas diagnósticas estándar para todos los pacientes, sino que hace hincapié en que, cuanto mayor sea el número de marcadores no invasivos de presiones elevadas de llenado del VI (tabla 9), mayor es la probabilidad de diagnóstico de IC-FEc.
8.4Tratamiento de la insuficiencia cardiaca con fracción de eyección conservadaHasta la fecha, no se ha demostrado de manera convincente una reducción de la morbimortalidad de los pacientes con IC-FEc con ningún tratamiento, aunque se han observado mejorías para algunos fenotipos de pacientes incluidos en la categoría general de la IC-FEc. Ningún estudio importante sobre la IC-FEc ha alcanzado su variable principal de valoración, entre ellos los estudios PEP-CHF (perindoprilo)277, CHARM-Preserved (candesartán)245, I-PRESERVE (irbesartán)278, TOPCAT (espironolactona)246, DIG-Preserved (digoxina)279 y PARAGON-HF (sacubitrilo-valsartán)13 (véase la tabla 12 del material adicional para más información sobre estos y otros estudios). El candesartán y la espironolactona redujeron las hospitalizaciones por IC y se observó una tendencia a menos hospitalizaciones con sacubitrilo-valsartán pero, dado que en estos estudios los resultados de las variables principales no fueron significativos, estos hallazgos solo son generadores de hipótesis. Aunque el nebivolol redujo significativamente la variable combinada de mortalidad por cualquier causa o ingreso por causas cardiovasculares en el estudio SENIORS, solo incluyó a un 15% de pacientes con FEVI > 50%119,249. Los estudios sobre la vía del óxido nítrico y el monofosfato de guanosina cíclico no han logrado demostrar una mejoría de la capacidad de ejercicio o de la calidad de vida en la IC-FEc, entre ellos los estudios NEAT-HFpEF280, INDIE-HFpEF281, VITALITY-HFpEF282 y CAPACITY-HFpEF (praliciguat)283.
Formación de los pacientes y autocuidado.
| Contenido formativo | Objetivo para pacientes y cuidadores | Comportamiento profesional y herramientas educacionales |
|---|---|---|
| Explicación sobre la IC | Comprender la causa de la IC, los síntomas y las opciones de tratamiento | Proporcione información adaptada al paciente |
| Curso de la IC | Comprender el pronóstico y las diferentes fases del curso de la ICTomar decisiones conjuntas, teniendo en cuenta las preferencias del paciente en el curso de la IC | Comunique con delicadeza la información sobre el pronóstico en el momento del diagnóstico, durante la toma de decisiones sobre las opciones de tratamiento, cuando se produzcan cambios en el estado clínico y siempre que el paciente lo solicite |
| Tratamiento médico | ||
| Medicación | Tomar decisiones conjuntas sobre la medicaciónComprender las indicaciones, los beneficios y la necesidad de adherencia a largo plazo a ciertos fármacos, y las dosis y efectos secundarios de la medicaciónReconocer los efectos secundarios más frecuentes de la medicación y saber cómo actuar | Proporcione información oral y escrita sobre las indicaciones, los beneficios, las dosis, los efectos terapéuticos y secundariosDialogue sobre aspectos prácticos, como el momento óptimo de las tomas, qué hacer en caso de omisión de una dosis, etc.Identifique posibles dificultades para tomar la medicaciónAconseje emplear dosificadores, alarmas electrónicas, etc., si es necesario320 |
| Dispositivos implantables | Tomar decisiones conjuntas sobre el implante de dispositivosComprender las indicaciones, la importancia, las expectativas y las revisiones rutinarias de los dispositivos implantables, y la gestión de excepcionesPoder reconocer las complicaciones comunes (incluido el riesgo de descargas inapropiadas del desfibrilador) y saber cómo actuar | Proporcione información oral y escrita sobre la importancia y las expectativas del implante de dispositivos, y distintas modalidades de seguimiento (monitorización remota)Dialogue sobre las expectativas del tratamiento y el posible impacto en la conducción de vehículosIdentifique claramente las situaciones en las que el dispositivo puede ser desactivado o explantadoImplique a pacientes y cuidadores en la toma de decisiones |
| Aspectos del autocuidado | ||
| Actividad y ejercicio | Ejercitarse regularmente y mantenerse físicamente activosAdaptar la actividad física al estado sintomático y las circunstancias personales | Asesore sobre el ejercicio teniendo en cuenta las limitaciones físicas y funcionales, como la fragilidad y comorbilidadesRefiera al paciente a un programa de ejercicio u otros modos de actividadDialogue sobre los posibles impedimentos, efectos secundarios y oportunidades |
| Sueño y respiración | Reconocer la importancia del sueño y el descanso para la salud cardiovascularReconocer alteraciones del sueño y saber cómo optimizar el sueño | Revise la historia del sueñoAsesore e informe sobre la importancia de la calidad del sueño y proporcione consejos sobre el reposo saludable (incluido el horario de toma de diuréticos)Valore con el paciente los beneficios y efectos perjudiciales de la medicación para dormir |
| Fluidos | Evitar la ingesta excesiva de fluidos. Se puede considerar una restricción de fluidos de 1,5-2 l/día para pacientes con IC grave o hiponatremia para aliviar los síntomas y la congestiónPara evitar la deshidratación de pacientes con restricción de fluidos, aumente la ingesta en caso de temperaturas o humedad altas, náuseas o vómitos | Informe sobre las ventajas y desventajas de la restricción de fluidosAconseje adaptar la ingesta de fluidos al peso, temperaturas y humedad altas, náuseas o vómitosAdapte las recomendaciones durante los periodos de descompensación aguda y hacia el final de la vida |
| Dieta saludable | Prevenir la desnutrición, mantener una dieta y un peso saludables y evitar la ingesta excesiva de sal (> 5g/día) | Trate la ingesta actual de alimentos y el papel de la sal y los micronutrientesInforme sobre la necesidad de suplementos en caso de deficiencias nutricionales, aunque no está claro el papel de su uso sistemático321Informe sobre la importancia de mantener un peso saludable |
| Alcohol | Ser capaz de abstenerse o evitar la ingesta excesiva de alcohol, especialmente en los casos de miocardiopatíaRestringir el consumo de alcohol según la guía de prevención de enfermedades cardiovasculares | Adapte los consejos sobre el consumo de alcohol a la etiología de la IC; p. ej., recomiende la abstinencia en caso de miocardiopatía inducida por alcoholInforme y asesore sobre la ingesta de alcohol según la guía de prevención de enfermedades cardiovasculares (2 unidades/día los varones y 1 unidad/día las mujeres)a |
| Inmunización | Ser consciente de la necesidad de inmunización contra la gripe y la enfermedad neumocócica | Informe sobre los beneficios y las posibles desventajasAsesore sobre la práctica local |
| Tabaco y drogas recreativas | Ser consciente de las consecuencias del tabaco y las drogas recreativas para la saludDejar de fumar (incluidos cigarrillos electrónicos) y consumir drogas recreativas | Informe, asesore y ayude a tomar decisionesDerive al paciente al servicio especializado en abandono del tabaquismo, drogas y terapia de sustituciónConsidere referir al paciente al servicio de apoyo psicológico y terapia cognitiva-conductual si el paciente desea dejar de fumar o tomar drogas |
| Viajes, ocio y conducción | Preparar viajes y actividades de ocio según la capacidad físicaTomar una decisión informada sobre la conducción de vehículos | Informe y trate sobre aspectos prácticos relativos a los viajes de larga distancia, estancias en el extranjero, exposición solar, humedad o temperaturas altas (deshidratación) y efectos de la altitud (oxigenación)Proporcione consejos prácticos para viajar con medicación/dispositivos (llevar los medicamentos en el equipaje de cabina y una lista de la medicación, nombre del dispositivo y centros hospitalarios)Referir a la legislación local, nacional e internacional sobre el permiso de conducir |
| Actividad sexual | Reanudar y adaptar la actividad sexual a la capacidad físicaReconocer problemas relativos a la actividad sexual y su relación con la IC o su tratamiento | Informe sobre la seguridad de la actividad sexual para los pacientes con IC estableAsesore sobre cómo eliminar factores que predisponen a la disfunción sexualAsesore sobre tratamientos farmacológicos para la disfunción sexualRefiera al paciente a un especialista para asesoramiento sexual cuando sea necesario |
| Monitorización de los síntomas y autocuidado | Monitorizar y reconocer cambios en los signos y síntomasSaber reaccionar adecuadamente a los cambios de los signos y los síntomasSaber cómo y cuándo contactar con un profesional sanitario | Proporcione información individualizada para promover el autocuidado. Por ejemplo: en caso de disnea o edema creciente o un aumento de peso repentino e inesperado (> 2kg en 3 días), los pacientes deben aumentar la dosis de diuréticos y comunicarlo al equipo médico |
| Vivir con IC | ||
| Aspectos psicológicos | Tener calidad de vida con la ICPedir ayuda en caso de problemas psicológicos, como síntomas depresivos, ansiedad o trastornos del ánimo, que pueden aparecen durante el curso de la ICReconocer que la familia o cuidadores pueden estar muy afectados y necesitar ayuda | Comunique regularmente información sobre la enfermedad, las opciones de tratamiento y el autocuidadoValore regularmente la necesidad de apoyoTrate o refiera al paciente a un especialista para apoyo psicológico cuando sea necesario |
| Familia y cuidadores informales | Pedir ayuda cuando la necesiten | Valore la preferencia del paciente sobre la implicación de cuidadores o familiaImplique a pacientes y cuidadores de forma respetuosa |
IC: insuficiencia cardiaca.
aSe entiende por 1 unidad 10 ml de alcohol puro (p. ej., una copa de vino, media pinta de cerveza, una medida de licor).
Pese a la falta de evidencia sobre tratamientos específicos modificadores de la IC-FEc y dado que la gran mayoría de los pacientes con IC-FEc tienen también hipertensión o EC subyacentes, muchos de estos pacientes reciben tratamiento con IECA o ARA-II, BB o ARM. En la fase inicial del estudio PARAGON-HF, más del 86% de los pacientes estaban tratados con un IECA o ARA-II, el 80% con un BB y más del 24% con un ARM13.
El Grupo de Trabajo reconoce que en el momento de publicación de esta guía las opciones de tratamiento para la IC-FEc están en revisión. La FDA ha aprobado el sacubitrilo-valsartán y la espironolactona para pacientes con una FEVI «inferior a lo normal», lo cual incluye a pacientes con IC-FElr o IC-FEc. En cuanto al sacubitrilo-valsartán, esta decisión está basada en el análisis de subgrupos del estudio PARAGON-HF, que mostró una reducción de las hospitalizaciones por IC de los pacientes con FEVI < 57%, y en un metanálisis de los estudios PARADIGM-HF y PARAGON-HF, en los que se observó una reducción de la muerte cardiovascular y las hospitalizaciones por IC entre los pacientes con FEVI en la franja inferior a la normal247. En relación con la espironolactona, el subgrupo de pacientes del estudio TOPCAT reclutados en América tuvo una reducción significativa de la variable principal de muerte cardiovascular y hospitalización por IC, y en un análisis posterior basado en la FE se observó una reducción significativa de la variable principal en los pacientes con FEVI < 55%9,247. Actualmente están en curso estudios sobre los iSGLT2 que podrían llevar en el futuro a una redefinición de la IC-FEc que tendría implicaciones terapéuticas.
Dado que no se puede establecer recomendaciones sobre tratamientos modificadores de la enfermedad, el tratamiento debe estar dirigido a reducir los síntomas de congestión mediante diuréticos. Son preferibles los diuréticos del asa, pero las tiacidas pueden ser útiles para el tratamiento de la hipertensión. Para los pacientes obesos, la pérdida de peso y el ejercicio pueden ayudar a mejorar los síntomas y la capacidad funcional, por lo que se deben considerar para algunos pacientes284,285.
En la IC-FEc es importante identificar y tratar los factores de riesgo subyacentes, la etiología y las comorbilidades como la hipertensión (sección 12.4), la EC (sección 12.2), la amiloidosis (sección 14.6), la FA (sección 12.1.1) y las valvulopatías (sección 12.3). Sin duda, el tratamiento de los fenotipos subyacentes del síndrome de IC-FEc mejora los resultados.
Recomendaciones sobre el tratamiento de los pacientes con insuficiencia cardiaca y fracción de eyección conservada.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el cribado y el tratamiento de etiologías y comorbilidades cardiovasculares y no cardiovasculares de los pacientes con IC-FEc (véase las correspondientes secciones en la guía) | I | C |
| Se recomienda el tratamiento diurético de los pacientes con congestión para aliviar los síntomas y signos de IC-FEc137 | I | C |
IC-FEc: insuficiencia cardiaca con fracción de eyección conservada.
aClase de recomendación.
bNivel de evidencia.
Recomendaciones sobre la prevención primaria de la insuficiencia cardiaca para pacientes con factores de riesgo.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el tratamiento de la hipertensión para prevenir o retrasar el desarrollo de IC y prevenir las hospitalizaciones por IC287−290 | I | A |
| Se recomienda el tratamiento con estatinas para pacientes con riesgo alto o enfermedad cardiovascular confirmada para prevenir o retrasar el desarrollo de IC y prevenir las hospitalizaciones por IC291,292 | I | A |
| Los inhibidores del SGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) están recomendados para los pacientes con diabetes y riesgo alto o enfermedad cardiovascular confirmada para prevenir las hospitalizaciones por IC293−297 | I | A |
| Se recomienda asesorar a los pacientes sobre los efectos nocivos del sedentarismo, la obesidad, el tabaquismo y la ingesta excesiva de alcohol a efectos de prevenir o retrasar el desarrollo de IC298−302 | I | C |
IC: insuficiencia cardiaca; SGLT2: cotransportador de sodio-glucosa tipo 2.
aClase de recomendación.
bNivel de evidencia.
La tabla 10 resume consejos de carácter general sobre los factores de riesgo de IC (véase la figura 1 del material adicional) y estrategias para prevenir la IC en las fases iniciales de la enfermedad cardiovascular.
Se sabe que, además de optimizar el tratamiento con fármacos y dispositivos, se debe prestar atención al modo en que se proporcionan cuidados médicos a los pacientes con IC. La Heart Failure Association de la ESC ha publicado varias declaraciones de posición sobre intervenciones no farmacológicas, planificación del alta y estándares de atención de los pacientes con IC303−305, y destaca también la necesidad de cardiólogos y personal de enfermería especializados en IC para proporcionar dichos cuidados. Los componentes específicos del currículo para el entrenamiento de estos profesionales están disponibles y se pueden adaptar para su implementación en cada país306,307. Esta sección se centra en áreas en las que se pueden establecer recomendaciones basadas en la evidencia: equipo multidisciplinario para el tratamiento de la IC, recomendaciones sobre el estilo de vida, entrenamiento físico, seguimiento y monitorización.
9.2Equipo multidisciplinario para el tratamiento de la insuficiencia cardiaca crónica9.2.1Modelos de atención médicaCon el objetivo de reducir las hospitalizaciones y la mortalidad, en la edición anterior de la guía1 se recomendaban los programas de atención multidisciplinaria para proporcionar a los pacientes las pruebas diagnósticas necesarias, un diagnóstico preciso, tratamientos basados en la evidencia y la formación y el seguimiento adecuados. La implementación óptima de estos programas requiere un equipo multidisciplinario que participe en todo el curso de la IC, desde su presentación, en los episodios críticos y los periodos de aparente estabilidad hasta las fases terminales303. Desde la edición de 2016, se han publicado nuevos estudios que subrayan la necesidad de un abordaje multidisciplinario y aportan información sobre cómo proporcionar cuidados médicos.
Un metanálisis en red de 53 estudios aleatorizados publicado en 2017 mostró que, frente a la atención convencional, tanto el abordaje de la enfermedad en consulta clínica como la atención domiciliaria por personal de enfermería redujeron la mortalidad por cualquier causa, y la atención domiciliaria es la más efectiva308. En un metanálisis de datos de pacientes individuales de 20 estudios que incluyeron a 5.624 pacientes, se observó que las intervenciones sobre autocuidados para pacientes con IC mejoraron los resultados, pese a la heterogeneidad de intensidades, contenidos y personal que llevó a cabo dichas intervenciones309.
Los componentes del abordaje multidisciplinario varían y pueden aplicarse distintos modelos de servicio, como un servicio basado en consulta clínica (atención primaria, secundaria o terciaria), programas de atención domiciliaria, gestión de casos o modelos híbridos. Los componentes de los servicios varían; p. ej., algunos programas utilizan la telemonitorización a escala local, regional o nacional. No se ha demostrado de forma consistente la superioridad de un modelo de servicio frente a otros310. Mientras que las consultas domiciliarias y ambulatorias reducen los ingresos y la mortalidad por cualquier causa, los programas formativos por sí solos no308,309. El abordaje multidisciplinario debe estar centrado en el paciente y seguir un enfoque holístico, más que dirigirse exclusivamente al tratamiento de la IC; el tratamiento de comorbilidades, como arritmias, hipertensión, diabetes, disfunción renal y depresión, mejora el bienestar y los autocuidados del paciente y conlleva mejores resultados309,311. La organización de un programa de atención multidisciplinaria debe adaptarse al sistema de salud, los recursos disponibles (infraestructura, servicios, personal y financiación), las políticas administrativas y las necesidades de los pacientes.
Numerosos pacientes con IC pueden beneficiarse de la atención paliativa y de apoyo integradas precozmente en los cuidados proporcionados por los miembros del equipo multidisciplinario de IC312,313. Se debe planificar este tipo de cuidados para todo paciente con IC, cualquiera sea la fase de la enfermedad en que se encuentre. Los pacientes en fases avanzadas de IC y aquellos para quienes se considere la asistencia circulatoria mecánica o el trasplante cardiaco deben tener por protocolo una consulta de atención paliativa antes de tales intervenciones (véase la sección 10.2.4).
9.2.2Características y componentes de los programas para el diagnóstico y el tratamiento de la insuficiencia cardiacaLos estudios clínicos han incluido intervenciones complejas o combinadas que dificultan la determinación de la eficiencia y la eficacia de cada componente específico. La tabla 11 presenta una perspectiva general de las características y componentes más importantes que hay que tener en cuenta en los programas de atención multidisciplinaria.
Intervenciones multidisciplinarias recomendadas para el tratamiento de la insuficiencia cardiaca crónica.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda incluir a los pacientes con IC en un programa de atención multidisciplinaria para reducir el riesgo de hospitalización por IC y la mortalidad309,314,315,316 | I | A |
| Se recomiendan las estrategias de autocuidados para reducir el riesgo de hospitalización por IC y la mortalidad309 | I | A |
| Se recomiendan los programas de atención domiciliaria y ambulatoria para reducir el riesgo de hospitalización por IC y la mortalidad310,317 | I | A |
| Se debe considerar la inmunización contra la gripe y la enfermedad neumocócica para prevenir las hospitalizaciones por IC315,316 | IIa | B |
IC: insuficiencia cardiaca.
aClase de recomendación.
bNivel de evidencia.
El autocuidado es muy importante para que el tratamiento de la IC sea efectivo, los pacientes entiendan qué es beneficioso para ellos y colaboren en las estrategias de automonitorización y tratamiento319. Los pacientes con IC que reportan un autocuidado más efectivo tienen mejor calidad de vida y tasas más bajas de reingresos y mortalidad309.
Las equivocaciones, los conceptos erróneos y la falta de conocimiento contribuyen a que los autocuidados sean insuficientes, por lo que es esencial instruir al paciente. Mejorar el conocimiento de los pacientes sobre su enfermedad es fundamental para que desarrollen habilidades de autocuidado304.
La formación para mejorar el autocuidado debe adaptarse a cada paciente y debe estar basada, siempre que sea posible, en evidencia científica o la opinión de expertos. No se ha demostrado que un asesoramiento específico sobre el estilo de vida mejore la calidad de vida o el pronóstico, pero proporcionar este asesoramiento se ha convertido en un componente clave de los programas de educación sobre autocuidado.
- •
Entre los componentes de los programas formativos se incluyen: Proporcionar información en distintos formatos teniendo en cuenta el nivel cultural y los conocimientos sobre salud. Considere enfoques en que los pacientes y cuidadores tengan un papel activo, como la comunicación colaborativa y actividades demostrativas o entrevistas de motivación. Refuerce los mensajes a intervalos regulares.
- •
Reconocer barreras de comunicación (lenguaje, habilidades sociales, aspectos cognitivos, ansiedad, depresión, limitaciones auditivas o visuales).
- •
Recomendar la página web HFmatters.org, ofrecer ayuda para usarla y discutir las preguntas que puedan suscitarse.
- •
Invitar a los pacientes a asistir acompañados por un familiar o un amigo.
En la tabla 12 se resumen los aspectos clave que se deben incluir.
9.4Rehabilitación basada en el ejercicio físicoHay numerosas pruebas de que la preparación física mediante ejercicio mejora la tolerancia al ejercicio y la calidad de vida relacionada con la salud de los pacientes con IC. Varios ensayos clínicos y metanálisis de datos de pacientes con IC-FEr muestran que el ejercicio de rehabilitación mejora la capacidad de ejercicio y la calidad de vida. Varios metanálisis también muestran que reduce las hospitalizaciones por IC y por cualquier causa, aunque no está claro su efecto en la mortalidad322−328. El efecto en las hospitalizaciones se observó en los pacientes que siguieron estrictamente el programa de ejercicio329. El entrenamiento con intervalos de intensidad alta de los pacientes que pueden y desean hacerlo puede mejorar el consumo pico de oxígeno (VO2)330,331. Se debe considerar la rehabilitación basada en el ejercicio supervisado para los pacientes frágiles, con enfermedad más avanzada o comorbilidades95. La preparación física también mejora la capacidad de ejercicio y la calidad de vida332−335. No hay datos sobre los pacientes con IC-FElr, pero este grupo debería beneficiarse de los efectos observados en otros grupos de IC.
Recomendaciones sobre la rehabilitación basada en el ejercicio físico para pacientes con insuficiencia cardiaca crónica.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el entrenamiento físico para todos los pacientes que puedan realizarlo a efectos de mejorar la capacidad de ejercicio y la calidad de vida y reducir las hospitalizaciones por ICc,324−328,335−337 | I | A |
| Se debe considerar un programa de rehabilitación cardiaca basada en el ejercicio supervisado para los pacientes con enfermedad más avanzada, fragilidad o comorbilidades95,324−327,338 | IIa | C |
IC: insuficiencia cardiaca.
aClase de recomendación.
bNivel de evidencia.
cPara los pacientes que pueden cumplir con un programa de ejercicio.
Esta es un área poco estudiada. Los pacientes con IC, incluso cuando los síntomas están controlados y estables, requieren seguimiento para comprobar si el tratamiento sigue siendo óptimo, detectar la progresión asintomática de la IC y sus comorbilidades y valorar nuevos avances en el tratamiento. Esta guía recomienda el seguimiento a intervalos no superiores a 6 meses para evaluar los síntomas, la frecuencia y el ritmo cardiacos, la presión arterial, el recuento sanguíneo completo, los electrolitos y la función renal. El seguimiento debe ser más frecuente para los pacientes con alta reciente o aumento de la dosis de medicación. No está claro si un cardiólogo debe hacer el seguimiento de los pacientes estables. Algunos estudios indican que el seguimiento en atención primaria puede ser adecuado303,339. Sin embargo, no hay datos suficientes sobre intervenciones basadas en la evidencia en distintos contextos340,104 y varios estudios indican que la atención y el seguimiento proporcionado por especialistas en IC, además de los registros de mejora de la calidad, pueden llevar a tasas más altas de tratamiento óptimo y mejorar los resultados341−343.
Se debe hacer anualmente un ECG para detectar la prolongación del complejo QRS344, ya que estos pacientes pueden ser candidatos a TRC. Además, el ECG puede identificar alteraciones de la conducción y FA.
Normalmente no es necesaria la ecocardiografía seriada, aunque se debe repetir el ecocardiograma en caso de deterioro del estado clínico. También se recomienda a los 3-6 meses de la optimización del tratamiento estándar de la IC-FEr para determinar si es necesario añadir nuevos fármacos o dispositivos implantables.
9.5.2Monitorización por biomarcadoresLos estudios que investigaron el uso de biomarcadores (especialmente BNP y NT-proBNP) para guiar el tratamiento farmacológico de la IC-FEr obtuvieron resultados contradictorios345−352, mientras que se ha demostrado la utilidad de marcadores pronósticos72,353,354. Conceptualmente, no está claro qué puede aportar una estrategia basada en la determinación de biomarcadores a los tratamientos recomendados por las guías de práctica clínica, ya que la evidencia disponible no apoya la determinación sistemática de BNP o NT-proBNP para guiar el tratamiento óptimo.
9.6TelemonitorizaciónLa telemonitorización permite a los pacientes enviar vía telemática sus datos de salud para optimizar el tratamiento y la atención. Los pacientes pueden usar los datos sobre síntomas, peso, frecuencia cardiaca y presión arterial almacenados en dispositivos electrónicos para ajustar el tratamiento (directamente o a través de un profesional sanitario) o pedir consejo médico. La telemonitorización domiciliaria puede ayudar a mantener la calidad de la atención, facilitar el rápido acceso a la atención médica cuando sea necesario, reducir los gastos de desplazamiento de los pacientes y minimizar la frecuencia de las consultas355. La interrupción forzosa de consultas presenciales en numerosos países debido a la reciente pandemia de COVID-19ha destacado las ventajas potenciales de la telemonitorización domiciliaria356.
Los estudios sobre telemonitorización domiciliaria son diversos. Normalmente se requiere que los pacientes realicen mediciones de varios parámetros y, al igual que ocurre con otros aspectos del tratamiento de la IC, la adherencia no suele ser completa. Se puede proporcionar un servicio de telemonitorización local, regional o nacional. Los sistemas dirigidos a mantener el tratamiento óptimo, más que a la detección y atención de emergencias médicas, solo necesitan estar dotados de personal durante la jornada laboral estándar. Otros sistemas están diseñados para ofrecer ayuda en cualquier momento que el paciente la necesite. No está clara la eficacia comparativa ni la relación coste-eficacia de cada una de estas estrategias. Los sistemas centrados en la optimización continua de la atención (enfoque de mantenimiento de la salud) parecen ser más efectivos que los sistemas que intentan anticiparse y tratar episodios de descompensación (estrategia plagada de falsos positivos)357. La telemonitorización domiciliaria, además de ser un instrumento de ayuda de la atención médica, es un método eficiente para formar y motivar al paciente, pero se debe adaptar al trabajo en sinergia con los servicios de salud existentes358.
Una revisión Cochrane de 2017, en la que se identificaron 39 estudios importantes sobre telemonitorización domiciliaria basados en la evaluación de los síntomas, el peso, la frecuencia y el ritmo cardiacos y la presión arterial, mostró que la telemonitorización se asoció con una reducción del 20% de la mortalidad por cualquier causa y del 37% de la hospitalización por IC359. Desde entonces, se han publicado varios estudios que no obtuvieron resultados significativos y al menos uno con resultados positivos357,360−364. No es probable que estos estudios afecten a los resultados positivos de la revisión sistemática. Además, si la distancia social y la «agenda verde» siguen siendo importantes, la telemonitorización domiciliaria solo tendría que demostrar que es no inferior a métodos contemporáneos de provisión de atención sanitaria para que se la considere un medio apropiado de apoyo356.
No está claro si los dispositivos portátiles para la monitorización de la frecuencia y ritmo cardiacos o la congestión pulmonar (bioimpedancia o radar pulmonar) proporcionan beneficios adicionales a la telemonitorización convencional descrita antes365−367.
Numerosos dispositivos terapéuticos implantables proporcionan, mediante conexión inalámbrica a distancia, información sobre el propio dispositivo (generador y funcionamiento de los electrodos), arritmias o datos fisiológicos del paciente (frecuencia cardiaca, actividad, ruidos cardiacos, bioimpedancia). La evidencia indica que la telemonitorización puede detectar antes el mal funcionamiento del dispositivo que la monitorización convencional, y que puede ser útil para detectar arritmias como la FA. Sin embargo, no hay datos que demuestren que la monitorización del dispositivo se asocie con una reducción de los ingresos por IC o la mortalidad368−370,371.
También están disponibles dispositivos cuya única función es la monitorización. Entre ellos, las grabadoras en bucle subcutáneas que monitorizan la frecuencia y el ritmo cardiacos, la actividad y la bioimpedancia. Algunos dispositivos de monitorización se pueden implantar en la arteria pulmonar para monitorizar a distancia la presión, aunque el lector externo que detecta la señal del dispositivo es bastante voluminoso y requiere la cooperación del paciente. El aumento de la presión diastólica de la arteria pulmonar puede ser uno de los primeros signos de congestión. Un estudio preliminar, pero relevante, mostró una reducción del riesgo de hospitalizaciones por IC recurrentes372. Se acaba de completar el reclutamiento de pacientes de un estudio más grande (GUIDE-HF)373.
Por lo tanto, se puede considerar la telemonitorización no invasiva para los pacientes con IC a efectos de reducir el riesgo de hospitalizaciones recurrentes por IC y causas cardiovasculares y la mortalidad cardiovascular. Se esperan nuevos datos sobre el tratamiento guiado por dispositivos implantados374.
Recomendaciones sobre telemonitorización.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se puede considerar la telemonitorización no invasiva para los pacientes con IC a efectos de reducir el riesgo de hospitalizaciones recurrentes por IC y causas cardiovasculares y la mortalidad cardiovascular374 | IIb | B |
| Se puede considerar la monitorización de la presión arterial pulmonar mediante un sistema hemodinámico inalámbrico para los pacientes con IC a efectos de mejorar los resultados clínicos372 | IIb | B |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca.
aClase de recomendación.
bNivel de evidencia.
En muchos pacientes la IC progresa a fases avanzadas que se caracterizan por síntomas persistentes pese a la administración de tratamiento máximo375−377. La prevalencia de la IC avanzada está aumentando debido al número creciente de pacientes con IC, el envejecimiento de la población y los mejores tratamientos y supervivencia. El pronóstico sigue siendo desfavorable, con una mortalidad a 1 año del 25-75%378−380.
Los criterios de la HFA/ESC actualizados en 2018 para la definición de la IC avanzada se recogen en la tabla 13376. El diagnóstico de IC avanzada no requiere una disminución marcada de la FEVI, ya que, aunque es frecuente, también puede aparecer en pacientes con IC-FEc. Además de los criterios establecidos, también se puede hallar disfunción orgánica extracardiaca (p. ej., caquexia cardiaca, disfunción hepática o renal) o hipertensión pulmonar de tipo II, aunque no son necesarias para la definición de IC avanzada376.
Criterios para la definición de la insuficiencia cardiaca avanzada.
| Todos los siguientes criterios deben estar presentes pese al tratamiento médico óptimo:• Síntomas graves y persistentes de insuficiencia cardiaca: NYHA III (avanzada) o IV• Disfunción cardiaca grave definida por al menos uno de los siguientes:–FEVI ≤ 30%–Insuficiencia solo del ventrículo derecho (p. ej., miocardiopatía arritmogénica del ventrículo derecho)–Alteraciones valvulares graves no operables–Alteraciones congénitas graves no operables–Concentraciones de BNP o NT-proBNP elevadas o en aumento y disfunción diastólica grave del ventrículo izquierdo o alteraciones estructurales (según la definición de la IC-FEr)• Episodios de congestión pulmonar o sistémica que requieran altas dosis de diuréticos i.v. (o una combinación de diuréticos) o episodios de bajo gasto cardiaco que requieran inotrópicos o vasopresores o arritmias malignas que requieran más de 1 consulta no planificada u hospitalización en los últimos 12 meses• Deterioro grave de la capacidad de ejercicio, de posible origen cardiaco, con incapacidad para el ejercicio o una distancia corta (< 300m) en la prueba de 6 min de marcha o pVO2 < 12ml/kg/min o<50% del valor esperado |
BNP: péptido natriurético cerebral; FEVI: fracción de eyección del ventrículo izquierdo; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; pVO2: consumo máximo de oxígeno durante el ejercicio Adaptada de Crespo-Leiro et al376.
Los perfiles del registro INTERMACS, desarrollados para clasificar a los pacientes con una indicación potencial de tratamiento con dispositivos permanentes de asistencia circulatoria mecánica (ACM), describen los parámetros y características clínicas de los pacientes que requieren tratamientos avanzados (tabla 14)381. Esta clasificación también es útil para estimar el pronóstico de los pacientes sometidos a trasplante cardiaco urgente382 o implante de un dispositivo de asistencia ventricular izquierda (DAVI)383 y para evaluar el riesgo de los pacientes ambulatorios con IC avanzada384.
Descripciones del perfil de los pacientes con insuficiencia cardiaca avanzada según el Interagency Registry for Mechanically Assisted Circulatory Support.
| Perfil | Marco temporal para la intervención |
|---|---|
| Perfil 1.Shockcardiogénico críticoHipotensión con peligro para la vida y escalamiento rápido de inotrópicos, con hipoperfusión de órganos cruciales confirmada a menudo por un empeoramiento de la acidosis y la concentración de lactato | Intervención estrictamente necesaria en las siguientes horas |
| Perfil 2. Deterioro progresivoPaciente con un deterioro de la función orgánica a pesar del soporte con inotrópicos i.v., que puede manifestarse por un empeoramiento de la función renal, pérdida de nutrientes e incapacidad para restablecer el equilibrio de volumen. Describe también un deterioro progresivo en los pacientes que no toleran el tratamiento inotrópico | Intervención estrictamente necesaria en los siguientes días |
| Perfil 3. Estable pero con dependencia de inotrópicosPacientes con estabilidad de la presión arterial, función orgánica, nutrición y síntomas en soporte continuo con inotrópicos i.v. (o con un dispositivo de asistencia circulatoria temporal o ambas), pero con fracaso repetido de los intentos de desconexión de la asistencia debido a hipotensión sintomática recurrente o disfunción renal | Intervención electiva estrictamente necesaria en las siguientes semanas o meses |
| Perfil 4. Síntomas en reposo con tratamiento oral domiciliario (reingresos frecuentes)El paciente se puede estabilizar con un volumen cercano al normal, pero presenta síntomas diarios de congestión en reposo o durante actividades cotidianas. Las dosis de diuréticos suelen fluctuar en valores muy altos. Se debe considerar estrategias de tratamiento y vigilancia más intensivas, que en algunos casos revelan una mala adherencia que compromete la evolución del paciente, más allá del tratamiento que reciba. Algunos pacientes pueden oscilar entre los perfiles 4 y 5 | Intervención electiva estrictamente necesaria en las siguientes semanas o meses |
| Perfil 5. No tolera el ejercicio (confinado en casa)Paciente que se encuentra cómodo en reposo y puede llevar a cabo algunas actividades diarias pero no de otro tipo y vive predominantemente en casa. En reposo no hay síntomas de congestión, pero puede haber un aumento de volumen refractario a tratamiento, a menudo con disfunción renal. Si el estado nutricional y la función orgánica son marginales, los pacientes podrían tener un riesgo más alto y requerir una intervención definitiva | Urgencia variable, dependiendo del estado nutricional, la función orgánica y la actividad |
| Perfil 6. Capacidad de ejercicio limitadaPaciente sin signos de sobrecarga de fluidos, cómodo en reposo y capaz de llevar a cabo actividades cotidianas y actividades ligeras fuera del hogar, pero se fatiga a los pocos minutos o con cualquier ejercicio físico más intenso. Es necesario medir el consumo pico de oxígeno, en algunos casos con monitorización hemodinámica, para establecer la relación y confirmar el grado de disfunción cardiaca | Urgencia variable, dependiendo del estado nutricional, la función orgánica y la actividad |
| Perfil 7. Clase funcional NHYA III avanzadaPaciente sin episodios recientes de inestabilidad de fluidos, con un nivel de actividad cómoda limitada a ejercicio de intensidad leve | No está indicado el trasplante cardiaco ni la ACM |
| Modificadores de los perfiles | Perfiles susceptibles de modificación |
| La ACM temporal puede modificar únicamente el perfil de los pacientes hospitalizados. Estos modificadores incluyen BCIA, ECMO, TandemHeart, DAVI, Impella | 1, 2, 3 |
| Las arritmias pueden modificar cualquier perfil. Entre ellas se incluyen las taquiarritmias ventriculares recurrentes junto con deterioro clínico, descargas frecuentes del DAI o necesidad de desfibrilador externo, normalmente más de 2 veces a la semana | 1-7 |
| Los episodios frecuentes de descompensación de la IC caracterizan a los pacientes que requieren frecuentes consultas o ingresos urgentes para recibir tratamiento diurético, ultrafiltración o fármacos vasoactivos intravenosos. Se suele definir episodio frecuente como al menos 2 consultas/ingresos urgentes en los últimos 3 meses o 3 en los últimos 6 meses | 3 si es en el domicilio, 4, 5, 6. Rara vez el perfil 7 |
ACM: asistencia circulatoria mecánica; BCIA: balón de contrapulsación intraaórtico; DAI: desfibrilador automático implantable; DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenador extracorpóreo de membrana; IC: insuficiencia cardiaca; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; NYHA: New York Heart Association. Adaptada de Stevenson381.
La estratificación del pronóstico es importante para identificar el mejor momento para derivar al paciente a un centro adecuado (capaz de ofrecer tratamientos avanzados), transmitir adecuadamente las expectativas a pacientes y familias y planificar las estrategias de tratamiento y seguimiento (figura 4)376. Se debe valorar la derivación de los pacientes con contraindicaciones para ACM o trasplante cardiaco a cuidados paliativos (véase la sección 10.2.4).
Algoritmo de tratamiento para pacientes con insuficiencia cardiaca avanzada. Código de colores para las clases de recomendación: verde para clase I; amarillo para clase IIa (véase la Table 1 para más detalles sobre las clases de recomendación). ACM: asistencia circulatoria mecánica; CA: amiloidosis cardiaca; DAVI: dispositivo de asistencia ventricular izquierda; ESC: Sociedad Europea de Cardiología; HFA: Heart Failure Association; IC: insuficiencia cardiaca; INTERMACS: Interagency Registry for Mechanically Assisted Circulatory Support; MCH: miocardiopatía hipertrófica; TD: terapia de destino; TPC: terapia puente a ser candidato; TPD: terapia puente a la decisión; TPP: terapia puente a puente; TPR: terapia puente a la recuperación; TPT: terapia puente al trasplante. aEste algoritmo se puede aplicar a todos los pacientes con IC avanzada, definida según los criterios de la ESC/HFA376, a excepción de los pacientes con MCH, CA, tormenta arrítmica, cardiopatía congénita del adulto y angina refractaria. bHospitalización recurrente, fallo orgánico progresivo, congestión refractaria, incapacidad de realizar una prueba de esfuerzo cardiopulmonar o consumo de oxígeno pico < 12ml/min/kg o < 50% del valor esperado385.
Aunque se han identificado numerosos marcadores pronósticos (tabla 13 del material adicional), la predicción de la evolución de la IC sigue siendo un reto y se suele derivar demasiado tarde a los pacientes a centros especializados en terapias avanzadas. Identificar los signos de alarma en los pacientes sin síntomas avanzados permitiría su derivación más temprana para poder ofrecerles AMC o trasplante cardiaco antes de que se produzca un deterioro orgánico mayor (figura 5; tabla 14 del material adicional)376,386. La clave del tratamiento óptimo de los pacientes es la aplicación de un modelo organizativo en el que participen centros con diferentes niveles de atención sanitaria conectados mediante redes de sistemas radiales376.
Clasificación de pacientes con insuficiencia cardiaca avanzada y momento adecuado de derivación376. ACM-LG: asistencia circulatoria mecánica a largo plazo; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSRAA: inhibidores del sistema renina-angiotensina-aldosterona; NYHA: clase funcional de la New York Heart Association; PAS: presión arterial sistólica; TC: trasplante cardiaco; TRC: terapia de resincronización cardiaca; VD: ventrículo derecho. aLa esperanza de vida corta puede deberse a comorbilidades importantes, como cáncer, demencia o disfunción orgánica terminal; otras entidades que pueden dificultar o empeorar el pronóstico tras el tratamiento son la fragilidad, la disfunción cognitiva irreversible, los trastornos psiquiátricos o aspectos psicosociales.
El tratamiento farmacológico o con ACM temporal puede ser necesario para los pacientes con IC avanzada, mientras se espera a que se pueda llevar a cabo el implante permanente de la ACM o el trasplante cardiaco.
10.2.1Tratamiento farmacológico y terapia de sustitución renalEl tratamiento inotrópico mejora el estado hemodinámico al reducir la congestión, aumentar el gasto cardiaco y contribuir a la perfusión periférica. Aunque no se ha probado, este tratamiento puede ayudar a prevenir el deterioro de la función orgánica. Sin embargo, los inotrópicos tradicionales podrían favorecer la isquemia miocárdica, las taquiarritmias y el empeoramiento del curso clínico387,388. Pueden servir como tratamiento paliativo para aliviar los síntomas de los pacientes que no tienen otras opciones de tratamiento. Se puede considerar la administración intermitente de inotrópicos a largo plazo para mejorar la capacidad funcional y la calidad de vida de los pacientes ambulatorios389,390.
La disfunción renal y la resistencia a los diuréticos del asa suelen caracterizar el curso clínico de los pacientes con IC avanzada. Como primera medida, se propone doblar la dosis de diuréticos y la administración concomitante de tiacidas o metolazona (véase a la sección 11.3.3)145. Para los pacientes que no responden al tratamiento diurético, se debe considerar las terapias de sustitución renal. La ultrafiltración es una de las terapias más utilizadas. Se puede considerar para los pacientes con resistencia al tratamiento diurético, aunque los datos sobre su efecto en los resultados no son concluyentes391,392.
10.2.2Asistencia circulatoria mecánicaLa ACM puede mejorar la supervivencia y los síntomas de los pacientes con IC avanzada376,393. Se debe considerar la ACM en los distintos contextos descritos en la tabla 15. Las indicaciones para ACM temporal o permanente deben estar basadas en los perfiles del registro INTERMACS (tabla 14, figura 4).
Asistencia circulatoria mecánica temporal
Los dispositivos de ACM temporal están indicados para revertir la hipoperfusión y la hipoxia de órganos vitales en el contexto del shock cardiogénico. Estos dispositivos pueden usarse durante un tiempo corto y limitado (unos días o semanas). El objetivo es mantener las funciones del sistema nervioso central y la perfusión orgánica para revertir la acidosis y el fracaso multiorgánico hasta que se aclare el estado del paciente, ya sea porque recupera la función cardiaca o se considere candidato a ACM permanente o trasplante cardiaco y, en algunos casos, para tratamiento más paliativo. El cuidado de los pacientes con ACM temporal es complejo y requiere experiencia y dedicación, además de estrategias específicas para los casos en que el paciente no se recupera del daño cardiaco o cerebral. La ACM temporal debe destinarse a pacientes con un perfil INTERMACS 1 o 2 como puente a la decisión, puente a la recuperación y puente a puente tanto a la ACM permanente como al trasplante cardiaco urgente (figura 4)394. En la sección 11.4 del anexo se encuentra más información sobre la ACM temporal.
Asistencia circulatoria mecánica permanente
Cuando la ACM temporal no ha llevado a la recuperación de la función cardiaca o la mejoría del estado clínico, la ACM a largo plazo está indicada para pacientes seleccionados a efectos de prolongar la vida del paciente y mejorar su calidad de vida o para ganar tiempo hasta el trasplante (puente a trasplante) o revertir contraindicaciones al trasplante cardiaco (puente a ser candidato) o como terapia de destino (tabla 15).
Términos que describen varias indicaciones para la asistencia circulatoria mecánica.
| Puente a la decisión/puente a puente | ACM (ECMO o Impella) a corto plazo para pacientes en shock cardiogénico hasta que se estabilice el estado hemodinámico y la perfusión de órganos vitales; se excluyen las contraindicaciones de la ACM a largo plazo (daño cerebral tras reanimación) y se puede evaluar otras opciones terapéuticas, como el DAV a largo plazo o el trasplante cardiaco |
| Puente a ser candidato | ACM (normalmente DAVI) para mejorar la función de órganos vitales y conseguir que un paciente no apto para trasplante cardiaco sea candidato a esta opción de tratamiento |
| Puente al trasplante | ACM (DAVI, DABV o corazón artificial) para mantener con vida al paciente en alto riesgo de muerte antes del trasplante hasta que se disponga de un donante de órganos |
| Puente a la recuperación | ACM a corto o largo plazo para mantener con vida al paciente hasta que la función cardiaca se recupere lo suficiente para retirarla |
| Terapia de destino | ACM a largo plazo (DAVI) como alternativa al trasplante para pacientes con IC terminal que no son candidatos para trasplante |
ACM: asistencia circulatoria mecánica; DABV: dispositivo de asistencia biventricular; DAV: dispositivo de asistencia ventricular; DAVI: dispositivo de asistencia ventricular izquierda; ECMO: oxigenador extracorpóreo de membrana; IC: insuficiencia cardiaca.
Se debe considerar la ACM a largo plazo para pacientes con perfil INTERMACS 2-4 o también para los perfiles 5 y 6 si el paciente tiene características de riesgo alto.
Los pacientes con fallo irreversible de órganos vitales no cardiacos, que se recuperan del nivel 1 de la clasificación INTERMACS con la ACM temporal, pueden ser candidatos a ACM permanente (figura 4)376,378,383,395−402. Las características de los pacientes que pueden ser candidatos al implante de un DAVI se describen en la tabla 16.
Potenciales candidatos para el implante de un dispositivo de asistencia ventricular izquierda.
| Pacientes con síntomas graves persistentes pese al tratamiento óptimo con fármacos y dispositivos, sin disfunción ventricular izquierda o insuficiencia triscuspídea graves, con un entorno psicosocial estable y en ausencia de contraindicaciones mayores*, que presentan además uno de los siguientes: |
| • FEVI<25% e incapacidad para el ejercicio por la IC o, si es posible realizar una prueba de esfuerzo cardiopulmonar, con un VO2 pico<12ml/kg/min o < 50% del valor esperado |
| • Al menos 3 hospitalizaciones por IC en los últimos 12 meses sin una causa precipitante obvia |
| • Dependencia del tratamiento inotrópico intravenoso o ACM temporal |
| Disfunción progresiva de órganos vitales (deterioro de la función renal o hepática, hipertensión pulmonar de tipo II, caquexia cardiaca) debido a la reducción de la perfusión y no a presiones excesivamente bajas de llenado ventricular (PEP ≥ 20mmHg y PAS ≤ 90mmHg o índice cardiaco ≤ 2 l/min/m2) |
ACM: asistencia circulatoria mecánica; DAVI: dispositivo de asistencia ventricular izquierda; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; PAS: presión arterial sistólica; PCWP: presión de enclavamiento capilar; VO2: consumo de oxígeno.
*Un entorno psicosocial estable incluye que se entienda la tecnología y que el paciente viva acompañado de un cuidador que le ayude (vivir solo o un entorno psicosocial inadecuado son contraindicaciones para el DAVI). Las contraindicaciones mayores son una contraindicación para anticoagulación oral por tiempo indefinido, infección, disfunción renal grave o arritmias ventriculares.
La información sobre dispositivos y estudios sobre ACM permanente se resumen en la tabla 15 del material adicional.
Las tasas actuales de supervivencia a los 2 años de los pacientes receptores de un DAVI de flujo continuo son comparables a las de los pacientes trasplantados, aunque los eventos adversos afectan negativamente a la calidad de vida. Entre los pacientes con DAVI de flujo continuo, la supervivencia actuarial fue del 80% a 1 año y el 70% a los 2 años403,404. En el estudio MOMENTUM 3, la supervivencia a los 2 años fue del 84,5% y la supervivencia libre de ictus discapacitante o necesidad de reintervención por mal funcionamiento del DAVI de flujo centrífugo, del 76,9%405. El DAVI de flujo centrífugo con levitación magnética completa redujo significativamente la trombosis de la bomba. En el estudio MOMENTUM 3, la necesidad de reintervención por mal funcionamiento del dispositivo fue del 2,3% a los 24 meses, con solo un 0,6% de riesgo de reemplazo de la bomba por trombosis de la bomba a los 24 meses. Las tasas de ictus (discapacitante), sangrado mayor y hemorragia gastrointestinal también fueron más bajas en el grupo asignado a una bomba de flujo centrífugo que en el asignado a bomba de flujo axial. Sin embargo, la incidencia de todos los sangrados, tromboembolia y transmisión de infección fue similar a la observada con otros dispositivos402.
Los resultados a los 2 años de los estudios desarrollados en la práctica clínica sobre el uso de DAVI de flujo centrífugo con levitación magnética completa que se incluyeron en el registro ELEVATE mostraron tasas de supervivencia total del 74,5%, de sangrado gastrointestinal del 9,7%, de ictus del 10,2% y de trombosis de la bomba del 1,5%406. Para ayudar a la toma de decisiones, se ha propuesto una nueva variable, más allá de la supervivencia, que incluya la calidad de vida y los eventos adversos según la clasificación del registro IMACS. En este sentido, «vivir bien al año» —definido como ausencia de muerte, ictus, hemorragia que requiere operación, dispositivo de asistencia ventricular derecha, reemplazo de la bomba o infección relacionada con el dispositivo— fue del 56,8% tras el implante aislado de DAVI de flujo centrífugo383.
Aunque ahora ya se encuentra desfasado, el estudio REMATCH fue el único ECDA que comparó el DAVI como tratamiento definitivo frente al TMO en pacientes con IC avanzada, NYHA-IV y una contraindicación para el trasplante. El estudio mostró tasas más bajas de mortalidad por todas las causas con los DAVI que con el tratamiento farmacológico (variable principal). No obstante, se observaron tasas altas de mortalidad a los 2 años en ambos grupos del estudio378. Otros estudios no tenían distribución aleatoria (INTrEPID, ROADMAP)396,407,408 o compararon distintos dispositivos (ADVANCE, ENDURANCE, MOMENTUM 3)399,402,409. Actualmente el estudio prospectivo Early-VAD (identificador: NCT02387112) compara una estrategia de implante temprano de DAVI frente a tratamiento farmacológico con implante de DAVI solo cuando se produce un deterioro grave del estado del paciente. Además, el estudio sueco SweVAD compara la supervivencia de pacientes con IC avanzada no candidatos a trasplante cardiaco asignados prospectiva y aleatoriamente a DAVI como tratamiento definitivo frente a tratamiento farmacológico (identificador: NCT02592499)410.
10.2.3Trasplante cardiacoEl trasplante cardiaco sigue siendo el tratamiento más efectivo para la IC avanzada si no hay contraindicaciones. La supervivencia al año tras el trasplante está entorno al 90%, con una supervivencia media de 12,5 años385,411,412. El trasplante cardiaco mejora la calidad de vida y el estado funcional, aunque, por razones inciertas, el porcentaje de pacientes que retornan al trabajo es menor de lo esperado412. Aparte de la disfunción primaria del injerto, los retos más importantes tras el trasplante cardiaco se relacionan con la eficacia o los efectos secundarios del tratamiento inmunosupresor (rechazo, infección, vasculopatía o disfunción tardía del injerto, malignidad, insuficiencia renal, hipertensión, diabetes mellitus).
La escasez de donantes de corazón sigue siendo la limitación principal del trasplante cardiaco. Por ello, se han ampliado los criterios para los donantes y se ha aumentado el límite superior de la edad de los donantes, especialmente en Europa. Es muy importante seleccionar cuidadosamente a los receptores con base en la esperanza de vida antes y después del trasplante (en la que influye el estado preoperatorio y las comorbilidades).
Las principales indicaciones y contraindicaciones del trasplante cardiaco se listan en la tabla 17376,385.
Trasplante cardiaco: indicaciones y contraindicaciones.
| Indicaciones |
| IC avanzada376 |
| Sin otra opción terapéutica, excepto DAVI como puente al trasplante |
| Contraindicaciones |
| Infección activa* |
| Enfermedad arterial periférica o cerebral grave |
| Hipertensión pulmonar irreversible con tratamiento farmacológico (se valorará implantar un DAVI para revertir la resistencia vascular pulmonar elevada y se revaluará al paciente para determinar si es candidato) |
| Malignidad con pronóstico desfavorable (en colaboración con los oncólogos, se evaluará a cada paciente según el riesgo de progresión o recurrencia del tumor, que aumenta con el uso de inmunosupresores) |
| Enfermedad hepática (cirrosis) o renal irreversibles (aclaramiento de creatinina < 30ml/min/1,73 m2). Se puede considerar el trasplante combinado de corazón-hígado o corazón-riñón |
| Enfermedad sistémica multiorgánica |
| Otras comorbilidades con mal pronóstico |
| IMC > 35 antes del trasplante (se recomienda la pérdida de peso hasta alcanzar un IMC < 35) |
| Consumo excesivo de alcohol o drogas en curso |
| Inestabilidad psicológica que comprometa el seguimiento y el régimen terapéutico intensivo en atención ambulatoria |
DAVI: dispositivo de asistencia ventricular izquierda; IC: insuficiencia cardiaca; IMC: índice de masa corporal Adaptada de Crespo-Leiro et al.376.
*La infección activa es una contraindicación relativa para el trasplante, aunque en algunos casos de DAVI infectado podría ser una indicación.
Pacientes con insuficiencia cardiaca para los que se debe considerar los cuidados de fase terminal.
| Deterioro progresivo de funciones (física y mental) y dependencia para la mayoría de las actividades cotidianas |
| Síntomas graves de insuficiencia cardiaca con mala calidad de vida pese al tratamiento óptimo farmacológico y no farmacológico |
| Ingresos frecuentes o episodios de descompensación pese al tratamiento óptimo |
| Se descarta la indicación de trasplante cardiaco o ACM |
| Caquexia cardiaca |
| Se considera que está cerca el final de la vida |
AMC: asistencia mecánica circulatoria.
Componentes clave de los cuidados paliativos para pacientes con insuficiencia cardiaca avanzada.
| Dirigidos a mejorar o mantener en la medida de lo posible la calidad de vida del paciente y su familia hasta el fallecimiento |
| Evaluación frecuente de los síntomas causados por la insuficiencia cardiaca avanzada (incluidos la disnea y el dolor) y otras comorbilidades, con el objetivo de aliviar los síntomas |
| Acceso del paciente y su familia a apoyo psicosocial y espiritual cuando sea necesario |
| Planificación anticipada de la atención médica, teniendo en cuenta las preferencias sobre el lugar de fallecimiento y reanimación (retirada de dispositivos, como DAI o ACM, que podría requerir la decisión del equipo multidisciplinario) |
ACM: asistencia circulatoria mecánica; DAI: desfibrilador automático implantable.
La infección activa es una contraindicación relativa para el trasplante, aunque en algunos casos de DAVI infectado podría ser una indicación. La edad avanzada no es una contraindicación absoluta. Si bien los pacientes menores de 65 años pueden ser candidatos más adecuados por su esperanza de vida total, la mayoría de los programas de trasplante aceptan a pacientes de hasta 70 años y además también debe considerarse tanto la edad biológica como la edad cronológica. Se debe valorar, además, la complejidad quirúrgica (esternotomías previas, radiación de la mediastina, cardiopatías congénitas del adulto).
El proceso de toma de decisiones sobre el trasplante o DAVI es complejo y único para cada paciente. Las opciones de tratamiento dependen de las condiciones particulares de cada paciente y estas, además, pueden cambiar con el tiempo. Otros factores no relacionados con el paciente, como el tiempo en lista de espera para el trasplante, la experiencia quirúrgica y los recursos del centro, también influyen en la toma de decisiones413.
Recomendaciones para el tratamiento de los pacientes con insuficiencia cardiaca avanzada.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Los pacientes evaluados para ACM a largo plazo deben tener una buena adherencia, capacidad para manejar el dispositivo y apoyo psicosocial414−416 | I | C |
| Se debe considerar el trasplante cardiaco para los pacientes con IC avanzada refractaria a tratamiento con fármacos y dispositivos que no tengan contraindicaciones absolutas | I | C |
| Se debe considerar la ACM a largo plazo para los pacientes con IC-FEr avanzada pese al tratamiento óptimo con fármacos y dispositivos que no son candidatos a trasplante cardiaco u otras opciones quirúrgicas y no tienen disfunción ventricular derecha grave, a efectos de reducir el riesgo de muerte y mejorar los síntomas378,396,397,401,402,404,417 | IIa | A |
| Se debe considerar la ACM a largo plazo para los pacientes con IC-FEr avanzada refractaria a tratamiento óptimo con fármacos y dispositivos como tratamiento puente al trasplante cardiaco, a efectos de mejorar los síntomas y reducir los riesgos de hospitalización por IC y muerte prematura398−400,402,404 | IIa | B |
| Se debe considerar la terapia de sustitución renal para los pacientes con sobrecarga de volumen refractaria e insuficiencia renal en fase terminal | IIa | C |
| Se puede considerar el tratamiento continuo con inotrópicos o vasopresores para los pacientes con gasto cardiaco bajo y evidencia de hipoperfusión orgánica como puente a la ACM o el trasplante cardiaco389,390 | IIb | C |
| Se puede considerar la ultrafiltración para los pacientes con sobrecarga de volumen refractaria al tratamiento diurético391,392 | IIb | C |
ACM: asistencia circulatoria mecánica; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida.
aClase de recomendación.
bNivel de evidencia.
Si bien el curso de la enfermedad es singular en cada paciente con IC, en general se produce un patrón de deterioro gradual acompañado de episodios de deterioro agudo que llevan a la muerte súbita o muerte por IC progresiva. Se debe informar al paciente sobre la trayectoria de la enfermedad y planificar con antelación qué pautas seguir cuando se establece el diagnóstico de IC avanzada. Las indicaciones y los componentes clave del servicio de cuidados paliativos se resumen en las tablas 18 y 19312,418.
Se ha propuesto un enfoque multidisciplinario para los cuidados paliativos y la atención al final de la vida de los pacientes con IC419. También se han reportado modelos de cuidados paliativos para pacientes con IC avanzada. Estas estrategias reducen las hospitalizaciones, sin un efecto claro en la supervivencia, y tienen algunos efectos en la calidad de vida y la carga sintomática420,421.
Los síntomas deben evaluarse regularmente. Además de la evaluación clínica, se pueden emplear distintas escalas de evaluación, como la Numeric Rating Scale, la Edmonton Symptom Assessment Scale (ESAS) o ESAS-HF o la Integrated Palliative Care Outcome Scale.
Se debe considerar el tratamiento de los síntomas, incluso con intervenciones adicionales además del TMO:
- •
Disnea: se puede considerar la administración de dosis repetidas de opiáceos para aliviar la disnea, aunque no se ha demostrado su eficacia422,423. Se debe informar al paciente sobre los posibles efectos secundarios de este tratamiento, como estreñimiento y náusea, retención de orina y cambios del estado mental. Se puede considerar las benzodiacepinas como segunda o tercera línea de tratamiento cuando los opiáceos y las intervenciones no farmacológicas no logren controlar la disnea. El aumento de la concentración de oxígeno inspirado puede aliviar la disnea.
- •
Dolor: las intervenciones no farmacológicas pueden ser útiles. Además, los opiáceos oxicodona, hidromorfona y fentanilo se consideran generalmente opciones seguras y se pueden administrar por vía oral, transdérmica o intravenosa, especialmente en el hospital, en cuidados intensivos o en residencias de la tercera edad424.
- •
Ansiedad y depresión: se debe ofrecer tratamiento convencional adecuado.
Las decisiones proactivas y la planificación anticipada relativas a los cuidados paliativos y la atención al final de la vida se deben documentar, revisar y comunicar sistemáticamente a todas las personas implicadas en la atención del paciente. Los proveedores de asistencia sanitaria deben aplicarse en seguir las preferencias de los pacientes y cuidadores siempre que sea posible y asumiendo que no siempre los pacientes desean o pueden expresar sus preferencias (p. ej., debido a depresión o deterioro cognitivo).
11INSUFICIENCIA CARDIACA AGUDA11.1Epidemiología, diagnóstico y pronósticoLa ICA se define como la aparición rápida o gradual de signos o síntomas de IC, lo bastante graves para que el paciente necesite atención médica urgente que lleva al ingreso hospitalario no planificado o a la atención en el servicio de urgencias. Los pacientes con ICA requieren evaluación urgente y el inicio o la intensificación del tratamiento, incluidos fármacos intravenosos y procedimientos. La ICA es la mayor causa de hospitalizaciones de personas de más de 65 años y se asocia con tasas elevadas de muerte y reingreso. La mortalidad hospitalaria varía entre el 4 y el 10%425−428. La mortalidad al año después del alta puede ser del 25-30%, con tasas de muerte y reingresos > 45%104,426,427,429,430.
La ICA se puede presentar como una primera manifestación de la IC (de novo) o, más frecuentemente, como consecuencia de una descompensación aguda de la IC crónica. Comparados con los pacientes con descompensación aguda de la IC crónica, los pacientes con IC de nueva aparición pueden tener una tasa más alta de mortalidad hospitalaria425, pero las tasas de mortalidad y reingresos después del alta son más bajas425,428,431,432. Factores extrínsecos pueden precipitar, pero no causar, la ICA en pacientes con disfunción cardiaca preexistente (tabla 16 del material adicional). La gravedad clínica y la evolución en el hospital están determinadas por la compleja interacción entre los factores precipitantes, el sustrato cardiaco y las comorbilidades del paciente.
El proceso diagnóstico de la ICA comienza en el momento del primer contacto médico y continúa durante las fases iniciales, a efectos de identificar la presentación clínica, diagnosticar y tratar en el momento oportuno las posibles causas, los factores desencadenantes y las comorbilidades que pudieran suponer riesgo para la vida (figura 6). Las pruebas diagnósticas se resumen en la tabla 20. Además de los signos y síntomas clínicos, el proceso diagnóstico incluye el ECGA y la ecocardiografía, siempre que sea posible. Pueden hacerse pruebas adicionales como radiografía de tórax y ecografía pulmonar para confirmar el diagnóstico de ICA, especialmente cuando no esté disponible la determinación de PN. Se debe medir las concentraciones plasmáticas de PN (BNP, NT-proBNP o MR-proANP) cuando el diagnóstico sea incierto y esta prueba esté en el punto de atención. Las concentraciones normales de PN hacen poco probable el diagnóstico de ICA. Los valores de corte para la ICA son: BNP<100pg/ml, NT-proBNP<300pg/ml y MR-proANP<120pg/ml74,433−435. No obstante, los PN aumentados se asocian con un amplio espectro de enfermedades cardiacas y no cardiacas (tabla 6). En algunos pacientes con descompensación de la IC en fase terminal, obesidad, edema pulmonar de tipo flash o ICA de lado derecho, pueden detectarse concentraciones bajas, mientras que en los pacientes con FA o disfunción renal pueden ser más altas74.
Proceso diagnóstico para la insuficiencia cardiaca avanzada de nueva aparición. BNP: péptido natriurético cerebral; IC: insuficiencia cardiaca; MR-proANP: región media del propéptido natriurético auricular; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; SCA: síndrome coronario agudo; TC: tomografía computarizada; TSH: tirotropina. aLas pruebas de laboratorio iniciales incluyen troponina, creatinina sérica, electrolitos, nitrógeno ureico o urea en sangre, TSH y función hepática, además de dímero D y procalcitonina cuando se sospeche embolia o infección pulmonar, análisis de gases en sangre en caso de trastorno respiratorio y lactato en caso de hipoperfusión. bLas evaluaciones específicas incluyen coronariografía en caso de sospecha de SCA y TC en caso de sospecha de embolia pulmonar. cLos valores para confirmar el diagnóstico de IC aguda son: > 450pg/ml para menores de 55 años, > 900pg/ml para los de 55-75 años y > 1.800pg/ml para los mayores de 75 años433,434.
Pruebas diagnósticas para pacientes con insuficiencia cardiaca aguda.
| Prueba | Momento de realizarla | Posibles hallazgos | Valor diagnóstico para la ICA | Indicación |
|---|---|---|---|---|
| ECG | Al ingreso, durante la hospitalizacióna,b, antes del alta | Arritmias, isquemia miocárdica | Exclusión de SCA o arritmias | Recomendada |
| Radiografía de tórax | Al ingreso, durante la hospitalizacióna | Congestión, infección pulmonar | Confirmatoria | Se puede considerar |
| Ecografía pulmonar | Al ingreso, durante la hospitalizacióna, antes del alta | Congestión | Confirmatoria | Se puede considerar |
| Ecocardiografía | Al ingreso, durante la hospitalizacióna, antes del alta | Congestión, disfunción cardiaca, causas mecánicas | Mayor | Recomendada |
| Péptidos natriuréticos (BNP, NT-proBNP, MR-proANP) | Al ingreso, antes del alta | Congestión | Valor predictivo negativo alto | Recomendada |
| Troponina sérica | Al ingreso | Daño miocárdico | Exclusión de SCA | Recomendada |
| Creatinina sérica | Al ingreso, durante la hospitalizacióna, antes del alta | Disfunción renal | Ninguno | Recomendada para la evaluación del pronóstico |
| Electrolitos séricos (sodio, potasio, cloruro) | Al ingreso, durante la hospitalizacióna, antes del alta | Alteraciones electrolíticas | Ninguno | Recomendada para la evaluación del pronóstico y el tratamiento |
| Estado del hierro (trasferrina, ferritina) | Antes del alta | Depleción de hierro | Ninguno | Recomendada para la evaluación del pronóstico y el tratamiento |
| TSH | Al ingreso | Hipotiroidismo e hipertiroidismo | Ninguno | Recomendada si hay sospecha de hipotiroidismo o hipertiroidismo |
| Dímero D | Al ingreso | Embolia pulmonar | Útil para descartar embolia pulmonar | Recomendada si hay sospecha de embolia pulmonar |
| Procalcitonina | Al ingreso | Neumonía | Útil para el diagnóstico de neumonía | Puede estar indicada si se sospecha de neumonía |
| Lactato | Al ingreso, durante la hospitalizacióna | Acidosis láctica | Útil para evaluar el estado de perfusión | Recomendada si hay sospecha de hipoperfusión periférica |
| Oximetría de pulso y análisis de gases en sangre | Al ingreso, durante la hospitalizacióna | Insuficiencia respiratoria | Útil para evaluar la función respiratoria | Recomendada si hay sospecha de insuficiencia respiratoria |
BNP: péptido natriurético cerebral; ECG: electrocardiograma; ICA: insuficiencia cardiaca aguda; MR-proANP: región media del propéptido natriurético auricular; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; SCA: síndrome coronario agudo; TSH: tirotropina.
aSegún las condiciones clínicas.
bSe puede considerar la monitorización continua con ECG según las condiciones clínicas.
Entre otras determinaciones de laboratorio, la troponina es útil para la detección de los síndromes coronarios agudos (SCA), aunque en la gran mayoría de los pacientes con ICA se detectan también valores altos436−438. El nitrógeno ureico en sangre o la urea, la creatinina sérica, los electrolitos (sodio, potasio, cloruro) y el antígeno carbohidrato 125 pueden ayudar a personalizar el tratamiento439,440. La detección de una función hepática anormal identifica a los pacientes con un mal pronóstico441.
Dado que tanto el hipotiroidismo como el hipertiroidismo pueden precipitar la ICA, se debe determinar la TSH en los pacientes con ICA de nuevo diagnóstico. El análisis de gases arteriales se debe hacer cuando sea necesario medir con precisión la presión parcial de O2 y CO2 (pacientes con alteraciones respiratorias). La concentración de lactato y el pH deben determinarse en los pacientes en shock cardiogénico. Se debe determinar el dímero D cuando haya sospecha de embolia pulmonar. La procalcitonina puede servir para el diagnóstico de neumonía y el tratamiento antibiótico puede tener una indicación si los valores plasmáticos son > 0,2μg/l. Sin embargo, en un estudio prospectivo y aleatorizado, no se observó impacto alguno en los resultados de la estrategia basada en la medición sistemática de procalcitonina442. La oximetría de pulso se debe tomar sistemáticamente en el momento de la primera presentación de los pacientes con ICA y podría ser necesaria la monitorización continua durante las primeras horas o días443,444.
11.2Presentaciones clínicasSe puede describir 4 presentaciones clínicas importantes, con algún posible solapamiento entre ellas (tabla 11)1,425,445. Las presentaciones clínicas se basan en la presencia de signos de congestión o hipoperfusión periférica y requieren distintos tratamientos (tabla 21)1,425−427,432,446,447.
Presentación clínica de la insuficiencia cardiaca aguda.
| Descompensación aguda de la IC | Edema pulmonar agudo | Insuficiencia ventricular derecha aislada | Shock cardiogénico | |
|---|---|---|---|---|
| Mecanismos más importantes | Disfunción del VIRetención renal de sodio y agua | Poscarga aumentada y disfunción diastólica del VI predominanteValvulopatías | Disfunción del VD e hipertensión pulmonar precapilar | Disfunción cardiaca grave |
| Causa principal de los síntomas | Acumulación de fluidos, presión intraventricular aumentada | Redistribución de fluidos a los pulmones e insuficiencia respiratoria aguda | Presión venosa central aumentada y, a menudo, hipoperfusión | Hipoperfusión sistémica |
| Presentación | Gradual (días) | Rápida (horas) | Gradual o rápida | Gradual o rápida |
| Alteraciones hemodinámicas más importantes | Presión telediastólica del VI y PCWP aumentadasaGasto cardiaco bajo o normalPAS normal o baja | Presión telediastólica del VI y PCWP aumentadasaGasto cardiaco normalPAS normal-alta | Presión telediastólica del VD aumentadaGasto cardiaco bajoPAS baja | Presión telediastólica del VI y PCWP aumentadasaGasto cardiaco bajoPAS baja |
| Presentaciones clínicas principales1,446 | Paciente «húmedo y caliente» o «seco y frío» | «Húmedo y caliente»b | «Seco y frío» o «húmedo y frío | «Húmedo y frío» |
| Tratamientos principales | DiuréticosInotrópicos/vasopresores (en caso de hipoperfusión periférica o hipotensión) | DiuréticosVasodilatadoresb | Diuréticos para la congestión periféricaInotrópicos/vasopresores (en caso de hipoperfusión periférica o hipotensión)ACM temporal o tratamiento de sustitución renal si es necesario | Inotrópicos/vasopresoresACM temporal o tratamiento de sustitución renal |
AMC: asistencia circulatoria mecánica; PAS: presión arterial sistólica; PCWP: presión de enclavamiento capilar; VD: ventrículo derecho; VI: ventrículo izquierdo.
aPuede ser normal con gasto cardiaco bajo.
bEl perfil de paciente «húmedo y frío» que requiere inotrópicos o vasopresores se presenta muy raras veces.
La insuficiencia cardiaca en descompensación aguda es la manifestación más frecuente de la ICA, el 50-70% de las presentaciones426,427,432.
Normalmente ocurre en pacientes con antecedente de IC y disfunción cardiaca, en todo el espectro de FEVI, y puede incluir disfunción ventricular derecha. A diferencia del fenotipo caracterizado por edema de pulmón agudo, esta forma tiene una presentación más gradual, y su mayor alteración es la progresiva retención de fluidos que causan congestión. En ocasiones, la congestión se asocia con hipoperfusión426. Los objetivos del tratamiento son la identificación de los factores precipitantes, la descongestión y, en pocos casos, la corrección de la hipoperfusión (figura 7).
Tratamiento de la insuficiencia cardiaca aguda descompensada. ACM: asistencia circulatoria mecánica. aSe recomienda administrar dosis adecuadas de diuréticos para aliviar la congestión y la vigilancia estrecha de la diuresis (véase la Figure 13), independientemente del estado de perfusión.
El edema pulmonar agudo se relaciona con la congestión pulmonar. Los criterios clínicos para el diagnóstico de edema pulmonar agudo incluyen la disnea con ortopnea, insuficiencia respiratoria (hipoxemia, hipercapnia), taquipnea, > 25 respiraciones/min y un mayor esfuerzo para respirar448.
Deben iniciarse 3 tratamientos cuando esté indicado. En primer lugar, se inicia la administración de oxígeno como presión positiva continua en la vía aérea, la ventilación no invasiva con presión positiva o cánula nasal con flujo alto. En segundo lugar, se administra tratamiento diurético intravenoso y, en tercer lugar, vasodilatadores si la PAS es alta para reducir la poscarga del VI (figura 8). En pocos casos de IC avanzada, el edema pulmonar agudo se asocia con un gasto cardiaco bajo, y en estos casos está indicada la administración de inotrópicos, vasopresores o ACM para restaurar la perfusión de órganos.
11.2.3Insuficiencia ventricular derecha aisladaLa insuficiencia del VD se asocia con un aumento de las presiones auricular y ventricular derechas y con congestión sistémica. La insuficiencia del VD puede afectar al llenado del VI y, en última instancia, reducir el gasto cardiaco sistémico por la interdependencia de los ventrículos449.
Los diuréticos suelen ser la primera opción de tratamiento para la congestión venosa. La noradrenalina y los inotrópicos están indicados en caso de gasto cardiaco bajo e inestabilidad hemodinámica. Son preferibles los inotrópicos que reducen las presiones de llenado cardiaco (levosimendán, inhibidores de la fosfodesterasa tipo II). Dado que los inotrópicos pueden agravar la hipotensión arterial, pueden combinarse con norepinefrina cuando sea necesario (figura 9)449.
11.2.4Shock cardiogénicoEl shock cardiogénico es un síndrome causado por una disfunción cardiaca primaria que causa la alteración del gasto cardiaco y un estado tisular de hipoperfusión potencialmente mortal que puede llevar al fracaso multiorgánico y la muerte450−452. El daño miocárdico que afecta gravemente a la función cardiaca puede ser agudo, como resultado de la pérdida repentina de tejido miocárdico (IAM, miocarditis), o progresivo, como se observa en pacientes con IC crónica descompensada, que sufren un deterioro de la estabilidad de la enfermedad por la progresión natural de la IC avanzada u otros factores desencadenantes426.
El diagnóstico de shock cardiogénico requiere que haya signos clínicos de hipoperfusión, como extremidades frías y sudorosas, oliguria, confusión mental, mareo y presión de pulso estrecha. Además, están presentes también manifestaciones bioquímicas de hipoperfusión, creatinina sérica elevada, acidosis metabólica y lactato sérico elevado, que reflejan hipoxia tisular y alteraciones del metabolismo celular que llevan a la disfunción orgánica437,453. Hay que recordar que la hipoperfusión no siempre se acompaña de hipotensión, ya que la PA puede estar conservada por un mecanismo compensatorio (con o sin fármacos vasopresores), si bien a costa de una perfusión y una oxigenación tisular insuficientes426,427,450,454.
El tratamiento del shock cardiogénico debe comenzar lo antes posible. La identificación temprana y el tratamiento de la causa subyacente, además de la estabilización hemodinámica y el tratamiento de la disfunción orgánica, son los elementos clave de su tratamiento (figura 10; sección 11.1 y figura 2 del material adicional).
Tratamiento del shock cardiogénico. ACM: asistencia circulatoria mecánica; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; TPT: terapia puente al trasplante. aICP en SCA, pericardiocentesis en taponamiento cardiaco, cirugía de válvula mitral en rotura de músculo papilar. En caso de rotura del septo interventricular, se debe considerar la ACM como TPT. bOtras causas son insuficiencia valvular aguda, embolia pulmonar, infección, miocarditis aguda o arritimias (véase la Figure 12).
El tratamiento se puede subdividir en 3 etapas diferentes (prehospitalaria, hospitalaria y antes del alta), que tienen distintos objetivos y requieren distintas estrategias terapéuticas (figura 11).
Fase prehospitalaria
En el contexto prehospitalario, se debe proceder a la monitorización no invasiva de los pacientes con ICA que incluya oximetría de pulso, PA, frecuencias cardiaca y respiratoria y ECG continuo, desde los primeros minutos tras el contacto del paciente y en la ambulancia siempre que sea posible305. El tratamiento con oxígeno se puede administrar con base en el juicio médico, excepto cuando la saturación de oxígeno sea < 90%, en cuyo caso se debe administrar. En pacientes con alteraciones respiratorias, frecuencia respiratoria > 25 respiraciones/min y saturación de oxígeno<90%, se debe iniciar la ventilación no invasiva444,448. Aunque se disponga de medios terapéuticos en el contexto prehospitalario, ningún estudio aleatorizado ha demostrado que la atención más efectiva en este contexto pueda alterar los resultados clínicos455. Además, el tratamiento prehospitalario en ningún caso debe retrasar el traslado inmediato de los pacientes con ICA al centro más adecuado455,456.
Tratamiento en el hospital
El proceso diagnóstico y el tratamiento farmacológico y no farmacológico debe iniciarse de inmediato y en paralelo (figura 12). Los pacientes con ICA deben clasificarse según el grado de inestabilidad hemodinámica y la gravedad del cuadro clínico para atenderlos en el nivel de atención apropiado. En esta fase inicial, son muy importantes las decisiones y disposiciones que se adopten (véase la sección 11.2 y las tablas 17-19 del material adicional).
Tratamiento inicial de la insuficiencia cardiaca aguda. ACM: asistencia circulatoria mecánica. aCausa mecánica aguda: rotura miocárdica que complica el síndrome coronario agudo (rotura de la pared libre, comunicación interventricular, insuficiencia mitral aguda), traumatismo torácico o intervención cardiaca, incompetencia de válvula nativa o protésica secundaria a endocarditis, disección o trombosis aórtica). bVéase en las Figures 7-10 los tratamientos específicos para distintas presentaciones clínicas.
La modalidad y la intensidad de la monitorización en el hospital dependen de la gravedad clínica, el tipo de servicio y la evolución del paciente (véase la sección 11.3 del material adicional). Dado que la ICA es una entidad heterogénea, su abordaje debe adaptarse a la presentación clínica principal. La estrategia de tratamiento comienza con la identificación de las causas específicas de la ICA1,305,430.
Entre ellas se incluyen los SCA, las urgencias hipertensivas, las arritmias rápidas o bradicardia/alteraciones de la conducción graves, las causas mecánicas agudas como la insuficiencia valvular aguda o la embolia pulmonar aguda, infecciones como la miocarditis, y taponamiento cardiaco (figura 12). Una vez descartadas estas entidades, las cuales requieren tratamiento o corrección urgente, el tratamiento de la ICA varía según las distintas presentaciones clínicas (figuras 7-10).
Antes del alta
Los pasos que hay que seguir antes del alta se describen en la sección 11.3.11.
11.3.2Oxigenoterapia y asistencia ventilatoriaEn la ICA no se debe administrar sistemáticamente oxígeno a los pacientes no hipoxémicos, ya que causa vasoconstricción y reducción del gasto cardiaco457. La oxigenoterapia está recomendada para pacientes con ICA y SpO2<90% o PaO2<60mmHg a efectos de corregir la hipoxemia. En la EPOC, la hiperoxigenación puede aumentar el desajuste ventilación-perfusión, suprimir la ventilación y producir hipercapnia. Durante el tratamiento con oxígeno, es preciso monitorizar el equilibrio acidobásico y la SpO2.
La ventilación no invasiva con presión positiva, ya sea presión positiva en vía aérea o soporte de presión, mejora la insuficiencia respiratoria, aumenta la oxigenación y el pH y reduce la presión parcial de dióxido de carbono (pCO2) y el esfuerzo respiratorio. Aunque en un gran estudio aleatorizado no se obtuvieron resultados significativos, un metanálisis mostró que esta estrategia mejora la disnea y reduce la necesidad de intubación y la mortalidad, comparada con la oxigenoterapia tradicional1,458,459. La ventilación no invasiva con presión positiva se debe iniciar lo antes posible en los pacientes con trastornos respiratorios (tasa respiratoria>25rpm, SpO2<90%) para mejorar el intercambio de gases y reducir la tasa de intubación endotraqueal448,459. Se debe aumentar la fracción de oxígeno inspirado hasta un 100% si es necesario, dependiendo del nivel de saturación de oxígeno.
Se debe monitorizar la presión arterial durante la ventilación no invasiva con presión positiva, ya que aumenta la presión intratorácica y reduce el retorno venoso y las precargas ventriculares derecha e izquierda. También puede reducir el gasto cardiaco y la PA, por lo que se debe aplicar con precaución en pacientes con poca reserva de precarga e hipotensión. El aumento de la resistencia vascular pulmonar y la poscarga del VD pueden tener efectos perjudiciales en la disfunción del VD448.
La intubación está recomendada para los casos de insuficiencia respiratoria progresiva que se produce a pesar de la administración de oxígeno o ventilación no invasiva (tabla 20 del material adicional)448.
11.3.3DiuréticosLos diuréticos intravenosos son la piedra angular del tratamiento de la ICA. Los diuréticos aumentan la secreción renal de agua y sal y están indicados para el tratamiento de la sobrecarga de fluidos y la congestión en la gran mayoría de los pacientes con ICA.
Se suele recurrir a los diuréticos del asa por su rápida acción y su eficacia. Los datos sobre las dosis óptimas y el momento y la vía de administración más adecuados son escasos. En el estudio DOSE no se observó ninguna diferencia en la variable principal de eficacia relativa a la evaluación global de los síntomas con un régimen de dosis altas comparado con un régimen de dosis bajas. Sin embargo, se observaron mayores alivio de la disnea, pérdida de peso y pérdida neta de fluidos (sin un efecto pronóstico para los aumentos de creatinina sérica) con el régimen de dosis altas460−462. Los diuréticos a dosis altas pueden causar una mayor activación neurohormonal y alteraciones electrolíticas, y suelen asociarse con peores resultados, aunque no se ha podido probar una relación causa-efecto en análisis retrospectivos463−466. Con base en estas observaciones, puede ser apropiado iniciar el tratamiento diurético intravenoso con dosis bajas para evaluar la respuesta al tratamiento y aumentar la dosis si la respuesta es insuficiente.
El tratamiento diurético se debe iniciar con una primera dosis intravenosa de furosemida o la dosis equivalente de bumetanida o torasemida, correspondiente a 1-2 veces la dosis oral diaria administrada al paciente antes del ingreso. Si el paciente no recibía tratamiento diurético oral, se puede prescribir una dosis inicial de furosemida de 20-40 mg o un bolo intravenoso de torasemida 10-20 mg145,467. La furosemida se puede administrar en 2-3 bolos diarios o como infusión continua. No se recomienda la administración de un único bolo diario debido a la posibilidad de retención de sodio después de la administración145,461. En caso de infusión continua, se puede administrar una dosis de carga para alcanzar antes un estado estable. La respuesta a los diuréticos se debe evaluar poco tiempo después de iniciado el tratamiento determinando el contenido de sodio en orina a las 2-6 h y la diuresis cada hora. Una respuesta satisfactoria al tratamiento diurético se define como un contenido de sodio en orina > 50-70 mEq/l a las 2 h o una diuresis > 100-150 ml/h durante las primeras 6 h145,468. Si la respuesta diurética es insuficiente, se puede doblar la dosis de diuréticos del asa intravenosos y después evaluar la respuesta al tratamiento145. Si la respuesta sigue siendo insuficiente (p. ej., una diuresis < 100ml/h con la dosis doble de diuréticos del asa, se puede considerar la administración de otra clase de diuréticos que actúan en diferentes zonas, como tiacidas, metolazona o acetazolamida. Esta combinación precisa de la vigilancia estrecha de los electrolitos séricos y la función renal (figura 13)145,469,470. Esta estrategia, basada en la evaluación temprana y frecuente de la respuesta diurética, permite comenzar el tratamiento con dosis relativamente bajas de diuréticos del asa y ajustar frecuentemente las dosis, con lo cual es menos probable que se produzca deshidratación y un aumento de la creatinina sérica. La dosis de diuréticos del asa se debe disminuir progresivamente cuando se alcance un significativo equilibrio de fluidos negativo. Hasta la fecha, este algoritmo de tratamiento diurético se basa más que nada en la opinión de expertos145,461.
Tratamiento diurético (furosemida) en la insuficiencia cardiaca aguda. Adaptada de Mullens et al.145. aPor lo general, la dosis máxima diaria de diuréticos i.v. es 400-600mg de furosemida, pero se puede considerar la administración de dosis de hasta 1.000mg para pacientes con insuficiencia renal grave. bEl tratamiento combinado es agragar al diurético del asa otro diurético con una vía de acción distinta, como tiacidas, metolazona o acetozolamida.
La transición a tratamiento oral se debe comenzar cuando el estado clínico del paciente sea estable. Se recomienda que, tras el alivio de la congestión, se mantenga el tratamiento con las dosis más bajas posibles de diuréticos del asa para evitar la congestión463,471. Además, se debe evitar que los pacientes con congestión persistente reciban el alta del hospital, ya que la congestión es uno de los más importantes predictores del aumento de muertes y rehospitalizaciones462,472. Por ello, se tendrá especial cuidado en lograr un estado de descongestión adecuado y establecer un régimen efectivo de tratamiento diurético a largo plazo antes del alta427,473.
11.3.4VasodilatadoresLos vasodilatadores intravenosos, como los nitratos o el nitroprusiato (tabla 21 del material adicional), dilatan los vasos venosos y arteriales, lo cual lleva a una reducción del retorno venoso al corazón, la congestión y la poscarga y un aumento del volumen latido y el consiguiente alivio de los síntomas. Los nitratos actúan fundamentalmente en venas periféricas, mientras que el nitroprusiato es un dilatador con un efecto arterial y venoso más equilibrado474,475. Debido a sus mecanismos de acción, los vasodilatadores intravenosos pueden ser más efectivos que los diuréticos para los pacientes con edema pulmonar agudo causado por un aumento de la poscarga y una redistribución de fluidos a los pulmones, con ninguna o mínima acumulación de fluidos427,476−478. No obstante, 2 ECDA recientes que compararon el tratamiento estándar con el uso intensivo, temprano y mantenido de vasodilatadores no lograron demostrar un efecto beneficioso de los vasodilatadores intravenosos comparados con diuréticos a dosis altas479,480. Por lo tanto, hasta ahora no se puede apoyar un régimen basado en el tratamiento con vasodilatadores en lugar del tratamiento convencional.
Pueden considerarse los vasodilatadores intravenosos para aliviar los síntomas de ICA siempre que la PAS sea > 110mmHg. Se puede comenzar con dosis bajas y aumentarlas gradualmente hasta lograr una mejoría del estado clínico manteniendo el control de la PA. Los nitratos generalmente se administran con un bolo inicial seguido de infusión continua. También se pueden administrar en bolos continuos. La nitroglicerina se puede administrar en 1-2 bolos para los pacientes con hipertensión grave y edema pulmonar agudo477. Deben tomarse precauciones para evitar la hipotensión causada por una reducción excesiva de la precarga y la poscarga. Por esta razón, se debe tener la máxima prudencia al aplicarlos a los pacientes con HVI o estenosis aórtica grave. Sin embargo, se han observado efectos favorables en pacientes con disfunción sistólica del VI y estenosis aórtica tras administrar los vasodilatadores con monitorización estrecha de los parámetros hemodinámicos481.
11.3.5InotrópicosLos inotrópicos siguen siendo necesarios para el tratamiento de los pacientes con gasto cardiaco bajo e hipotensión (tabla 22). Se debe reservarlos para los pacientes con disfunción sistólica del VI y PAS baja (< 90mmHg) que afecta a la perfusión de órganos vitales. En cualquier caso, los inotrópicos deben emplearse con precaución, empezando por dosis bajas seguidas de un aumento gradual de la dosis bajo estrecha vigilancia387,388.
Inotrópicos y vasopresores empleados para el tratamiento de la insuficiencia cardiaca aguda.
| Fármaco | Tasa de infusión |
|---|---|
| Dobutamina | 2-20 μg/kg/min (β+) |
| Dopamina | 3-5 μg/kg/min; inotrópico (β+)> 5 μg/kg/min: inotrópico (β+), vasopresor (α+) |
| Milrinona | 0,375-0,75 μg/kg/min |
| Enoximona | 5-20 μg/kg/min |
| Levosimendán | 0,1 μg/kg/min; se puede reducir a 0,05 o aumentar a 0,2 μg/kg/min |
| Norepinefrina | 0,2-1,0 μg/kg/min |
| Epinefrina | 0,05-0,5 μg/kg/min |
Los inotrópicos, especialmente los que tienen mecanismos adrenérgicos, pueden causar taquicardia sinusal, aumentar la frecuencia ventricular en pacientes con FA, inducir isquemia miocárdica y arritmias y aumentar la mortalidad387,388,430,478. El levosimendán o los inhibidores de la fosfodiesterasa tipo 3 son preferibles a la dobutamina para los pacientes tratados con BB, ya que actúan a través de mecanismos independientes482,483. Las limitaciones más importantes del levosimendán y los inhibidores de la fosfodiesterasa tipo 3 son la vasodilatación periférica excesiva y la hipotensión, especialmente cuando se administran a dosis altas o se comienza con la administración de un bolo482,484.
11.3.6VasopresoresLos vasopresores para el tratamiento de la ICA se muestran en la tabla 22.
Entre los fármacos con una potente acción vasoconstrictora arterial periférica, la norepinefrina es preferible para los pacientes con hipotensión grave. El objetivo es aumentar la perfusión de los órganos vitales, aunque esto sea a costa de un aumento de la poscarga del VI. Por ello, se puede considerar la combinación de norepinefrina con un inotrópico, sobre todo para los pacientes con IC avanzada y shock cardiogénico.
Algunos estudios, aunque con limitaciones, respaldan la norepinefrina como de primera elección frente a la dopamina o la epinefrina. La dopamina se comparó con la norepinefrina como primera línea de tratamiento para pacientes en shock y se asoció con más complicaciones arrítmicas y mayor mortalidad en los pacientes en shock cardiogénico, pero no en aquellos en shock hipovolémico o séptico. Aunque el estudio incluyó a 1.679 pacientes, solo se obtuvo significación estadística en el análisis de un subgrupo de 280 pacientes con shock cardiogénico, y menos del 10% de los pacientes sufrieron un IM. Debido a que no se obtuvieron datos sobre revascularización, no se puede generalizar los resultados485. En otro estudio aleatorizado y prospectivo, se comparó la epinefrina con la norepinefrina en pacientes en shock cardiogénico causado por IAM486. El estudio se interrumpió prematuramente debido a una mayor incidencia de shock refractario con epinefrina, que también se asoció con una frecuencia cardiaca más alta y acidosis láctica. A pesar de las limitaciones del estudio relacionadas con su tamaño relativamente pequeño, el seguimiento corto y la falta de datos sobre las dosis máximas alcanzadas, los resultados muestran mayores eficacia y seguridad de la norepinefrina. Estos resultados son compatibles con un metanálisis que incluyó a 2.583 pacientes con shock cardiogénico, en el que con epinefrina se observó un aumento del riesgo de muerte a 3 veces el de la norepinefrina en este grupo de pacientes487. En cualquier caso, la falta de información sobre las dosis, la duración del tratamiento y la etiología hace que estos resultados se deban considerar parcialmente exploratorios.
11.3.7OpiáceosLos opiáceos alivian la disnea y la ansiedad. Se pueden usar como sedantes durante la ventilación no invasiva con presión positiva para la adaptación del paciente. Los efectos secundarios dependientes de la dosis incluyen náuseas, hipotensión, bradicardia y depresión respiratoria.
Recomendaciones sobre el tratamiento inicial de la insuficiencia cardiaca aguda.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Oxígeno y asistencia ventilatoria | ||
| Se recomienda la administración de oxígeno y asistencia ventilatoria para los pacientes con SpO2<90% o PaO2<60mmHg a efectos de corregir la hipoxemia | I | C |
| Se recomienda la intubación del paciente en caso de insuficiencia respiratoria progresiva pese a la administración de oxígeno y ventilación no invasiva448 | I | C |
| Se debe considerar la ventilación no invasiva con presión positiva para los pacientes con trastornos respiratorios (frecuencia respiratoria>25rpm, SpO2<90%), que se aplicará lo antes posible para disminuir el déficit respiratorio y la tasa de intubación endotraqueal mecánica448 | IIa | B |
| Diuréticos | ||
| Se recomiendan los diuréticos i.v. para todo paciente con ICA ingresado con síntomas o signos de sobrecarga de fluidos para mejorar los síntomas145 | I | C |
| Se puede considerar la combinación de un diurético del asa con una tiacida para los pacientes con edema resistente que no responde al aumento de dosis de diuréticos del asa | IIa | B |
| Vasodilatadores | ||
| Se puede considerar la administración de vasodilatadores i.v. a los pacientes con ICA y PAS>110mmHg como tratamiento inicial para mejorar los síntomas y reducir la congestión475−477,479,480 | IIb | B |
| Inotrópicos | ||
| Se puede considerar la administración de inotrópicos a los pacientes con PAS < 90mmHg y evidencia de hipoperfusión que no responden al tratamiento estándar, con carga de fluidos, a efectos de mejorar la perfusión periférica y mantener la función orgánica387 | IIb | C |
| Debido a problemas de seguridad, no se recomienda la administración sistemática de inotrópicos, excepto cuando el paciente presente hipotensión sintomática y evidencia de hipoperfusión387,467,478 | III | C |
| Vasopresores | ||
| Se puede considerar la administración de un vasopresor (norepinefrina preferiblemente) a los pacientes en shock cardiogénico para aumentar la PA y la perfusión de órganos vitales485−487 | IIb | B |
| Otros fármacos | ||
| Se recomienda la profilaxis de tromboembolias (p. ej., con HBPM) para los pacientes que no estén anticoagulados ni tengan contraindicaciones para la anticoagulación, a efectos de reducir el riesgo de trombosis venosa profunda y embolia pulmonar494,495 | I | A |
| No se recomienda la administración sistemática de opiáceos, excepto para pacientes seleccionados con dolor o ansiedad intensos o intratables488,489 | III | C |
HBPM: heparina de bajo peso molecular; ICA: insuficiencia cardiaca aguda; i.v.: intravenoso; PaO2: presión parcial de oxígeno; PAS: presión arterial sistólica; SpO2: saturación de oxígeno transcutánea.
aClase de recomendación.
bNivel de evidencia.
Análisis retrospectivos indican que la administración de morfina se asocia con una mayor frecuencia de ventilación mecánica, hospitalizaciones prolongadas, más ingresos en la unidad de cuidados intensivos y mayor mortalidad488−491. Por lo tanto, no se recomienda utilizar los opiáceos en la ICA, aunque se pueden considerar para pacientes seleccionados, particularmente en caso de dolor y ansiedad intensos o intratables o en el contexto de los cuidados paliativos.
11.3.8DigoxinaLa administración de digoxina se debe considerar para los pacientes con FA y frecuencia ventricular rápida (> 110 lpm) pese al tratamiento con BB (véase también la sección 12.1.1)151,492,493. Se puede administrar en bolos intravenosos de 0,25-0,5mg si no se administró previamente. Sin embargo, para los pacientes con comorbilidades (p. ej., ERC) u otros factores que afecten al metabolismo de la digoxina (incluidos otros fármacos) o los pacientes mayores, es difícil establecer teóricamente la dosis de mantenimiento, por lo que se debe determinar las concentraciones séricas de digoxina. La digitoxina es una posible alternativa a la digoxina que se está evaluando en un estudio aleatorizado con grupo de control con placebo (identificador: NCT03783429)158.
11.3.9Profilaxis de tromboemboliasEstá recomendada la profilaxis de las tromboembolias con heparina (p. ej., HBPM) u otro anticoagulante, salvo que esté contraindicado o sea innecesario (por estar ya en curso un tratamiento con anticoagulantes orales)494,495.
11.3.10Asistencia circulatoria mecánica a corto plazoPara los pacientes que se presentan en shock cardiogénico, puede ser necesaria la ACM con el objetivo de aumentar el gasto cardiaco y favorecer la perfusión de órganos vitales. La ACM temporal se puede servir como puente a recuperación, puente a la decisión o puente a puente450−452. La mejoría inicial del gasto cardiaco, la PA y el lactato arterial se pueden contrarrestar con un número significativo de complicaciones. No se dispone de datos suficientes y rigurosos sobre los resultados, por lo que el uso indiscriminado de la ACM para los pacientes en shock cardiogénico no se sustenta en la evidencia y requiere la participación de un equipo multidisciplinario que incluya especialistas con experiencia en implante y tratamiento, de forma similar a los requisitos descritos para los centros especializados en IC avanzada (sección 11.4 y tabla 22 del material adicional; véase también la sección 10.2.2 de esta guía)376,496. Estudios recientes muestran que una «estrategia multidisciplinaria estandarizada» basada en algoritmos predefinidos y combinada con una monitorización intensiva (monitorización hemodinámica invasiva, lactato, marcadores de daño orgánico) podría traducirse en una mejora de la supervivencia497−499.
En el estudio IABPSHOCK-II no se observó ninguna diferencia en la mortalidad a los 30 días ni a largo plazo entre el balón de contrapulsación intraaórtico (BCIA) y el TMO en pacientes en shock cardiogénico causado por IAM sometidos a revascularización temprana500−502. Con base en estos resultados, no se recomienda el uso sistemático de BCIA para pacientes en shock cardiogénico tras el IM; no obstante, se podría considerar como tratamiento puente a la decisión, puente a recuperación o puente a puente, especialmente si el shock cardiogénico no está causado por SCA y es refractario a tratamiento farmacológico.
Otros dispositivos de ACM temporal se compararon con el BCIA en estudios aleatorizados pequeños y análisis ajustados por tendencia, pero no se obtuvieron resultados concluyentes503−507. Asimismo, son necesarios estudios aleatorizados que comparen el oxigenador extracorpóreo de membrana (ECMO) con BCIA o tratamiento médico. Un metanálisis de estudios observaciones mostró resultados favorables de pacientes en shock cardiogénico o parada cardiaca al recibir tratamiento con ECMO venoarterial comparados con los controles508. El ECMO venoarterial también se puede considerar en la miocarditis fulminante y otras entidades causantes de shock cardiogénico509. Dependiendo de la gravedad de la disfunción miocárdica y la insuficiencia mitral o aórtica concomitante, el ECMO venoarterial puede aumentar la poscarga del VI, la presión telediastólica del VI y la congestión pulmonar. En estos casos, es imprescindible descargar el VI mediante septostomía auricular/catéter de drenaje ventricular izquierdo o añadiendo un dispositivo de descarga ventricular como el Impella510,511.
Recomendaciones sobre la asistencia circulatoria mecánica a corto plazo para pacientes en shock cardiogénico.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la ACM temporal para pacientes en shock cardiogénico como tratamiento puente a la recuperación, puente a la decisión o puente a puente. Otras indicaciones son el tratamiento de la causa del shock cardiogénico o la ACM a largo plazo o el trasplante | IIa | C |
| Se puede considerar el BCIA para pacientes en shock cardiogénico como tratamiento puente a la recuperación, puente a la decisión o puente a puente, incluido el tratamiento de la causa del shock cardiogénico (complicación mecánica del IAM) o ACM a largo plazo o trasplante450 | IIb | C |
| No se recomienda el uso sistemático del BCIA para tratar el shock cardiogénico tras el IM500−502 | III | B |
ACM: asistencia circulatoria mecánica; BCIA: balón de contrapulsación intraaórtico; IAM: infarto agudo de miocardio; IM: infarto de miocardio.
aClase de recomendación.
bNivel de evidencia.
Un porcentaje significativo de pacientes con ICA reciben el alta con una pérdida de peso mínima o nula y, lo que es más importante, con congestión persistente427,472. La congestión persistente antes del alta se asocia con mayor riesgo de reingreso y muerte426,472. Por lo tanto, se debe optimizar el tratamiento, incluidas las dosis de diuréticos, para mantener al paciente sin síntomas de congestión.
En los pacientes con IC en descompensación aguda, se debe continuar el TMO oral, excepto cuando haya inestabilidad hemodinámica (hipotensión sintomática), función renal muy deteriorada o hiperpotasemia, en cuyo caso se puede reducir la dosis o interrumpir el tratamiento. Cuando se alcance la estabilización hemodinámica mediante tratamiento intravenoso, se debe optimizar el tratamiento oral antes del alta467. Los objetivos más importantes de la optimización del tratamiento son 3: en primer lugar, aliviar la congestión; segundo, tratar comorbilidades como el déficit de hierro que tienen impacto en la evolución después del alta512, y tercero, iniciar o restaurar el TMO asociado con efectos beneficiosos en los resultados. Las dosis se deben ajustar antes del alta y en la fase temprana tras esta.
Se ha observado en estudios clínicos que la optimización del tratamiento farmacológico se asocia con menos riesgo de reingreso a los 30 días, aunque hasta la fecha no se han llevado a cabo estudios prospectivos aleatorizados103,467,513. Análisis retrospectivos muestran que la interrupción o la reducción del tratamiento con BB durante las hospitalizaciones por ICA se asocia con peores resultados514. La instauración de tratamiento con un INRA para pacientes con IC-FEr estables recientemente hospitalizados, incluidos los no tratados previamente con IECA/ARA-II, es segura y se debe considerar en este contexto106,107. Recientemente, un estudio prospectivo aleatorizado demostró la seguridad y los mejores resultados del tratamiento con sotagliflozina para pacientes diabéticos hospitalizados por IC, independientemente de la FEVI136.
Se recomienda una consulta de seguimiento 1 o 2 semanas después del alta515,516. Esta consulta debe incluir el examen de signos y síntomas de IC, estado volémico, PA, frecuencia cardiaca y pruebas de laboratorio, que incluyan la función renal, electrolitos y posiblemente PN. También se debe determinar el estado del hierro y la función hepática, si no se ha hecho antes del alta. Con base en la evaluación clínica y las pruebas de laboratorio, se debe instaurar o ajustar el tratamiento modificador de la IC-FEr. Estudios prospectivos muestran que esta estrategia se asocia con tasas más bajas de reingresos a los 30 días, aunque hasta ahora no se han llevado a cabo estudios prospectivos aleatorizados513,516−518.
Recomendaciones sobre la atención antes del alta y el seguimiento temprano después del alta de los pacientes hospitalizados por insuficiencia cardiaca aguda.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda evaluar exhaustivamente a los pacientes hospitalizados por IC para descartar signos de congestión antes del alta y optimizar el tratamiento oral427,472 | I | C |
| Se recomienda la administración de tratamiento farmacológico oral basado en la evidencia antes del alta103,513 | I | C |
| Se recomienda una consulta de seguimiento 1-2 semanas después del alta para descartar signos de congestión, examinar la tolerancia al tratamiento farmacológico e iniciar o ajustar el tratamiento basado en la evidencia517,518 | I | C |
| Se debe considerar la carobximaltosa férrica en caso de déficit de hierro, definido como ferritina sérica<100ng/ml o 100-299ng/ml con Sat-T < 20%, para mejorar los síntomas y reducir las hospitalizaciones512 | IIa | B |
IC: insuficiencia cardiaca; Sat-T: saturación de transferrina.
aClase de recomendación.
bNivel de evidencia.
La FA y la IC coexisten frecuentemente519,520, y se pueden causar o exacerbar la una a la otra mediante diferentes mecanismos, como el remodelado estructural, la activación de sistemas neurohormonales y la disfunción del VI relacionada con la frecuencia519−523.
El porcentaje de pacientes con IC que sufren FA aumenta con la edad y la gravedad de la IC. Cuando la FA es la causa de la IC, el curso clínico parece más favorable que con otras causas de la IC (la llamada taquimiocardiopatía)524. Por el contrario, el desarrollo de FA en pacientes con IC crónica se asocia con peor pronóstico, ictus y aumento de la mortalidad525,526.
El tratamiento de los pacientes con IC y FA concomitantes se resume en la figura 147,521 e incluye:
- 1
Identificación y tratamiento de las posibles causas o factores desencadenantes de la FA.
- 2
Tratamiento de la IC.
- 3
Prevención de complicaciones embólicas.
- 4
Control de la frecuencia cardiaca.
- 5
Control del ritmo cardiaco.
Tratamiento de la fibrilación auricular en pacientes con insuficiencia cardiaca. Código de colores para las clases de recomendación: verde para clase I; amarillo para clase IIa; anaranjado para la clase IIb; rojo para la clase III (véase la Table 1 para más detalles sobre las clases de recomendación). AV: auriculoventricular; CVE: cardioversión eléctrica; FA: fibrilación auricular; IC: insuficiencia cardiaca; VP: venas pulmonares.
Identificación de factores desencadenantes y tratamiento de la FA
Se debe identificar y corregir las causas potenciales o los factores precipitantes, como hipertiroidismo, alteraciones electrolíticas, hipertensión no controlada, valvulopatía mitral e infección.
El empeoramiento de la congestión causado por la FA se debe tratar con diuréticos. El alivio de la congestión puede reducir la respuesta simpática y la frecuencia ventricular y aumentar la posibilidad de un retorno espontáneo a ritmo sinusal. La presencia de FA disminuye o elimina el beneficio pronóstico de los bloqueadores beta y hace que la ivabradina sea inefectiva12,125. Algunos tratamientos de la IC reducen el riesgo de FA, como los IECA, que lo reducen ligeramente, y quizá la TRC7,527.
Prevención de complicaciones embólicas
Salvo que existan contraindicaciones, se recomienda la administración de un anticoagulante oral a largo plazo para todos los pacientes con FA paroxística, persistente o permanente. Los anticoagulantes orales de acción directa (ACOD) son preferibles para la prevención de complicaciones tromboembólicas en los pacientes con FA sin estenosis mitral grave o válvula protésica mecánica, ya que tienen una eficacia similar a la de los antagonistas de la vitamina K (AVK) pero con menos riesgo de hemorragia intracraneal528.
Se puede considerar el cierre de la orejuela de la aurícula derecha para los pacientes con IC y FA que tienen contraindicaciones al tratamiento anticoagulante oral, aunque los datos de estudios aleatorizados no incluyen a pacientes con esta contraindicación529,530.
Control de la frecuencia cardiaca
Los datos sobre el control de la frecuencia cardiaca de los pacientes con IC y FA no son concluyentes. En el estudio RACE II y en el análisis combinado de los estudios RACE y AFFIRM, se comparó una estrategia de control menos estricto de la frecuencia cardiaca en reposo, definida como<110 lpm, frente a una estrategia de control estricto, definido como una frecuencia cardiaca en reposo<80 lpm y<110 lpm durante el ejercicio moderado152,531. Los estudios no encontraron ninguna diferencia en los resultados entre las 2 estrategias. Sin embargo, solo el 10% de los pacientes del estudio RACE II y el 17% de los incluidos en el análisis combinado tenían antecedentes de hospitalización por IC o NYHA II-III respectivamente152,531. La frecuencia cardiaca más alta se asoció con peores resultados en estudios observacionales532,533. Por lo tanto, es aceptable una estrategia inicial con un control de la frecuencia cardiaca menos estricto, pero con tratamiento dirigido a reducir la frecuencia cardiaca en caso de síntomas persistentes o disfunción cardiaca posiblemente relacionada con taquicardia (p. ej., miocardiopatía inducida por taquicardia)7,534.
Los BB pueden servir para controlar la frecuencia cardiaca de los pacientes con IC-FEr o IC-FElr, dado que se ha demostrado su seguridad en este tipo de pacientes (véase la sección 5.3.2)7,534,535. La digoxina o digitoxina se pueden considerar cuando la frecuencia ventricular permanece alta pese al tratamiento con BB o en caso de contraindicaciones o intolerancia a estos fármacos151,493,536. También se pueden considerar como tratamiento alternativo a los BB. Para los pacientes en NYHA IV o inestabilidad hemodinámica, se puede considerar la administración de amiodarona intravenosa para reducir la frecuencia ventricular537. En el caso de la IC-FEc, no hay evidencia sólida que demuestre la eficacia de ningún fármaco. El estudio RATE-AF comparó la digoxina con bisoprolol en pacientes con FA persistente y síntomas de NYHA II-IV. Comparada con bisoprolol, la digoxina tuvo el mismo efecto en la calidad de vida a los 6 meses (variable principal) y un mayor efecto en las clases funcionales EHRA y NYHA536. Solo el 19% de los pacientes tenían una FEVI < 50%, por lo que se puede considerar que la mayoría de ellos tienen IC-FElr o IC-FEc536.
Se puede considerar la ablación del nódulo AV para pacientes con un control inadecuado de la frecuencia cardiaca a pesar el tratamiento farmacológico y que no son elegibles para el control del ritmo mediante ablación con catéter o para pacientes con marcapasos biventricular7,538−540.
Control del ritmo cardiaco
Tras valorar el riesgo tromboembólico, se recomienda la cardioversión eléctrica urgente en el contexto de la descompensación aguda de la IC para los pacientes con frecuencia ventricular rápida e inestabilidad hemodinámica. Asimismo, se debe considerar la cardioversión para mejorar los síntomas de los pacientes con FA persistente y sintomática a pesar del TMO. Para pacientes sin tratamiento anticoagulante indefinido que tienen un episodio de FA de más de 48 h, es necesaria la anticoagulación oral terapéutica durante al menos 3 semanas o ecocardiografía transesofágica antes de la cardioversión7. En caso de ser preferible la cardioversión farmacológica, la amiodarona es el fármaco de elección, ya que otros fármacos antiarrítmicos (propafenona, flecainida, dronedarona) se asocian con peores resultados en la IC-FEr186,534,541−544. La amiodarona ayuda a mantener a los pacientes con IC en ritmo sinusal después de la cardioversión545,546.
Los estudios que incluyeron a pacientes con IC y compararon estrategias de control de la frecuencia frente al control del ritmo a base de tratamiento antiarrítmico no lograron demostrar ningún beneficio de una estrategia frente a la otra547−550. Más recientemente, el estudio EAST-AFNET 4, que incluyó a pacientes con FA de nueva aparición, el 28,6% con IC, se interrumpió antes de tiempo después de un seguimiento medio de 5,1 años debido a la baja incidencia de la variable principal compuesta de muerte, ictus u hospitalización por empeoramiento de la IC o SCA en los pacientes asignados a la estrategia de control temprano del ritmo cardiaco comparados con el tratamiento habitual551. Los pacientes asignados a la estrategia de control del ritmo cardiaco, sin embargo, tuvieron un seguimiento más estrecho, lo que podría haber influido en sus mejores resultados. La ablación con catéter se llevó a cabo en una minoría de pacientes del grupo de control del ritmo cardiaco (19,4%)551.
La ablación con catéter de la aurícula izquierda se comparó con tratamiento farmacológico para el control de la frecuencia o el ritmo cardiacos en 363 pacientes con FA persistente o paroxística, FEVI < 35% y un dispositivo implantado (DAI o TRC-D) reclutados en el estudio CASTLE-AF552. La variable principal de muerte por cualquier causa u hospitalización por IC ocurrió en menos pacientes del grupo de ablación que en el grupo de tratamiento farmacológico: 51 pacientes (28,5%) frente a 82 (44,6%) (hazard ratio [HR]=0,62; intervalo de confianza del 95% [IC95%], 0,43-0,87; p = 0,007). Además, la incidencia de otras variables de valoración, como muerte cardiovascular o por cualquier causa o empeoramiento de la IC, fue menor en el grupo de ablación552. Este estudio indica que la ablación con catéter puede mejorar el pronóstico de los pacientes con IC-FEr. No obstante, el estudio reclutó una población muy seleccionada (363 de 3.013 pacientes), no tenía enmascaramiento, hubo cruce de tratamiento entre grupos y el número de eventos fue bajo: 24 (13,4%) frente a 46 (25,0%) muertes por cualquier causa y 37 (20,7%) frente a 66 (35,9%) hospitalizaciones por IC en el grupo de ablación o de tratamiento farmacológico respectivamente552.
El estudio CABANA, iniciado por el investigador, sin enmascaramiento, multicéntrico y aleatorizado, reclutó a 2.204 pacientes con FA sintomática. El estudio no logró demostrar un beneficio de la estrategia de ablación de la FA frente al tratamiento farmacológico en la variable principal compuesta de muerte, ictus discapacitante, sangrado grave o parada cardiaca en la población total553. En un análisis de 778 pacientes (35%) con síntomas de NYHA II o superior, la variable principal ocurrió en 34 pacientes (9,0%) del grupo de ablación con catéter frente a 49 (12,3%) del grupo de tratamiento farmacológico (HR = 0,64; IC95%, 0,41-0,99)554. No obstante, en este estudio el número de eventos también fue pequeño y la IC se definió solo con base en los síntomas, solo estuvo disponible la FEVI del 73% de los pacientes (> 50% y 40-49% en el 79 y el 11,7% de los casos respectivamente)554. Tanto el estudio CASTLE-AF como el CABANA mostraron un efecto altamente significativo de la ablación con catéter en los síntomas de los pacientes552−554.
Otros 2 estudios prospectivos y aleatorizados reclutaron a pacientes con IC-FEr y FA persistente que se asignaron aleatoriamente a ablación con catéter o tratamiento farmacológico en uno de ellos (estudio AMICA, n=140) y ablación con catéter o amiodarona en el otro (estudio AATAC, n=203)555,556. El primer estudio no logró demostrar ninguna diferencia en el aumento de la FEVI entre los 2 grupos555. El segundo estudio mostró la superioridad de la ablación con catéter con respecto a la recurrencia de la FA (variable principal), además de una reducción de las hospitalizaciones no planificadas y la mortalidad556. Al contrario que el estudio AMICA555, pero en concordancia con el estudio CASTLE-AF552, el estudio AATAC también mostró el beneficio de la ablación con catéter en la FEVI556.
En conclusión, no hay suficiente evidencia a favor de una estrategia del control del ritmo cardiaco con tratamiento farmacológico frente al control de la frecuencia cardiaca en los pacientes con IC y FA547−551. Los resultados de estudios aleatorizados sobre la ablación con catéter comparada con el tratamiento farmacológico mostraron una mejoría de los síntomas, mientras que los resultados sobre mortalidad y hospitalizaciones se basaron en un número relativamente pequeño de eventos que no permite extraer conclusiones definitivas152,548−550,552−554,557.
Recomendaciones sobre el tratamiento de la fibrilación auricular para pacientes con insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Anticoagulación | ||
| Se recomienda la anticoagulación oral indefinidamente para los pacientes con FA, IC y una puntuación CHA2DS2-VASc ≥ 2 los varones o ≥ 3 las mujeres7 | I | A |
| Se recomiendan los ACOD en lugar de los AVK para los pacientes con IC, excepto para aquellos con estenosis mitral grave o válvula cardiaca protésica528,558 | I | A |
| Se debe considerar el tratamiento anticoagulante oral indefinidamente para la prevención del ictus de los pacientes con FA y una puntuación CHA2DS2-VASc de 1 los varones o 2 las mujeres7,559 | IIa | B |
| Control de la frecuencia cardiaca | ||
| Se debe considerar la administración de BB para el control de la frecuencia cardiaca a corto y largo plazo de los pacientes con IC y FA535 | IIa | B |
| Se debe considerar la digoxina cuando la frecuencia ventricular siga alta pese al tratamiento con BB o cuando haya contraindicaciones o intolerancia a estos fármacos536 | IIa | C |
| Cardioversión | ||
| Se recomienda la cardioversión eléctrica urgente en el contexto de la descompensación aguda de la IC de los pacientes que presentan frecuencia ventricular alta e inestabilidad hemodinámica | I | C |
| Se puede considerar la cardioversión para los pacientes cuya FA se asocia con el empeoramiento de los síntomas de IC pese al tratamiento farmacológico óptimo7,541 | IIb | B |
| Ablación con catéter de la FA | ||
| En caso de una asociación clara entre la FA paroxística o persistente y el empeoramiento de los síntomas de IC que persisten pese al tratamiento farmacológico óptimo, se debe considerar la ablación con catéter para prevenir o tratar la FA552−554,557 | IIa | B |
ACOD: anticoagulantes orales de acción directa; AVK: antagonistas de la vitamina K; BB: bloqueadores beta; CHA2DS2-VASc: insuficiencia cardiaca, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer); FA: fibrilación auricular; IC: insuficiencia cardiaca.
aClase de recomendación.
bNivel de evidencia.
Las arritmias ventriculares pueden ser una complicación y en algunos casos una causa de IC. Los latidos ventriculares prematuros (LVP) frecuentes pueden llevar a disfunción sistólica reversible. Entre los factores probables, están la disincronía y las alteraciones en la absorción de calcio560.
El tratamiento inicial de las arritmias ventriculares en la IC debe incluir la corrección de los potenciales factores desencadenantes (como alteraciones electrolíticas, en especial la hipopotasemia y la hiperpotasemia, y los fármacos proarrítmicos), además de la optimización del tratamiento farmacológico de la IC. Aunque la isquemia puede ser un factor desencadenante, no se ha demostrado que la revascularización pueda reducir el riesgo de arritmias ventriculares561.
La amiodarona también es efectiva para suprimir las arritmias ventriculares. Sin embargo, no reduce la incidencia de muerte súbita o la mortalidad total161. Para los pacientes con miocardiopatía inducida por contracción ventricular prematura, se puede considerar la administración de amiodarona para reducir las arritmias recurrentes y mejorar los síntomas y la función del VI, aunque hay que tener en cuenta sus efectos secundarios. El uso de otros fármacos se trata en la sección 12.1 del material adicional.
La ablación de los LVP por radiofrecuencia puede mejorar la función del VI y, posiblemente, los resultados de los pacientes con taquimiocardiopatía cuando los LVP contribuyen a la disfunción del VI562. La reducción mantenida de la carga basal de LVP se asoció con menos riesgo de muerte cardiaca, trasplante cardiaco u hospitalización por IC durante el seguimiento563,564.
12.1.3Bradicardia sintomática, pausas y bloqueo auriculoventricularLas indicaciones para el tratamiento con marcapasos de los pacientes con IC no son diferentes a las de pacientes con otras enfermedades cardiovasculares. Existen numerosas pruebas de que la estimulación eléctrica del VD puede tener efectos adversos en la función sistólica del VI, que llevaría en el largo plazo al desarrollo de IC565. Los pacientes con IC-FEr que requieren estimulación ventricular frecuente, p. ej., pacientes con bloqueo AV o FA lenta, y que tienen disfunción sistólica, deben recibir TRC en lugar del marcapasos convencional para evitar eventos adversos, como se demostró en el estudio BLOCK-HF216. En busca de una alternativa más fisiológica al marcapasos de VD, se está usando cada vez más la estimulación fisiológica566. En una comparación sin distribución aleatoria de 304 pacientes consecutivos con estimulación del BRI del haz de His y 433 pacientes consecutivos con estimulación del VD, el primer grupo tuvo menos hospitalizaciones por IC y mostró tendencia a reducción de la mortalidad567. Aunque esta técnica es prometedora, son necesarios más datos para confirmar su utilidad.
12.2Síndromes coronarios crónicosLa EC es la causa más frecuente de IC en países industrializados, de ingresos medios y cada vez más en países de ingresos bajos. Se debe considerar la EC como posible causa de la IC en todo paciente con IC de novo.
El proceso diagnóstico de los pacientes con IC y síndrome coronario crónico (SCC) se describe en la GPC ESC 2019 sobre SCC5. Se debe evaluar minuciosamente a los pacientes con IC para detectar signos o síntomas de SCC. Para ello, se recomienda recoger la historia clínica y familiar, exploración física, ECG y pruebas de imagen5. La documentación de la isquemia mediante pruebas invasivas y no invasivas puede resultar difícil en los pacientes con IC debido a la posible intolerancia al ejercicio y los efectos del aumento de las presiones telediastólicas del VI. Se puede considerar la coronariografía y la angio-TC para confirmar la EC y su extensión y valorar la indicación de revascularización (véase la sección 4.3)5.
12.2.1Tratamiento farmacológicoPor su beneficio pronóstico, los BB son fundamentales en el tratamiento de los pacientes con IC-FEr y EC116−120,568. Se debe considerar la ivabradina como una alternativa a los BB (si están contraindicados) o añadida al tratamiento antianginoso para pacientes en ritmo sinusal cuya frecuencia cardiaca sea ≥ 70 lpm139,569. Otros fármacos antianginosos (como amlodipino, felodipino, nicorandil, ranolazina y nitratos orales o transdérmicos) son efectivos para el tratamiento de los síntomas, aunque los datos sobre sus efectos son no significativos o insuficientes5,570−574. La trimetazidina parece tener efectos adicionales, como la mejoría de la función del VI y la capacidad de ejercicio en pacientes con IC-FEr y SCC tratados con BB575−577. Se puede considerar la administración de trimetazidina y otros fármacos antianginosos para pacientes con IC pese al tratamiento con BB y/o ivabradina. Los nitratos de acción corta deben usarse con precaución en los pacientes con IC, ya que causan hipotensión. El diltiazem y el verapamilo aumentan la incidencia de complicaciones relacionadas con la IC en los pacientes con IC-FEr, por lo que están contraindicados578.
La figura 15 muestra un algoritmo para el empleo de medicamentos antianginosos en pacientes con IC-FEr.
Algoritmo de tratamiento farmacológico para los síndromes coronarios crónicos en pacientes con IC-FEr. Código de colores para las clases de recomendación: verde para la clase I; amarillo para la clase IIa; anaranjado para la clase IIb; rojo para la clase III (véase la Table 1 para más detalles sobre las clases de recomendación). FC: frecuencia cardiaca; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; SCC: síndrome coronario crónico.
Se puede considerar la administración de BB, nitratos de acción prolongada, bloqueadores de los canales de calcio (BCC), ivabradina, ranolazina, trimetazidina, nicorandilo y sus combinaciones en la IC-FEc para el alivio de la angina, pero no se puede esperar un beneficio en las variables relativas a la IC y las complicaciones coronarias.
En el estudio COMMANDER-HF, el rivaroxabán a dosis bajas (2,5 mg 2 veces al día) no aportó un beneficio pronóstico adicional para los pacientes con IC-FEr y SCC. Este estudio evaluó la eficacia y la seguridad del rivaroxabán como tratamiento para reducir el riesgo de muerte, IM o ictus de los pacientes con IC y EC tras un episodio de descompensación de la IC579. El estudio incluyó a pacientes con IC-FEr y un episodio reciente de empeoramiento de la IC ocurrido en los últimos 21 días desde la fecha de reclutamiento. Este grupo de pacientes tiene un riesgo alto de complicaciones relacionadas con la IC, que fueron la causa principal de las muertes y las hospitalizaciones en el estudio. El rivaroxabán no tuvo ningún efecto en estas complicaciones. Por el contrario, en un análisis no preespecificado de subgrupos del estudio COMPASS, el rivaroxabán a dosis bajas, además de ácido acetilsalicílico (AAS), se asoció con una reducción de eventos isquémicos en los pacientes con IC, principalmente con IC-FElr o IC-FEc580. Con base en estos resultados, se puede considerar la administración de dosis bajas de rivaroxabán para pacientes con EC (o enfermedad arterial periférica) e IC, FEVI > 40% y en ritmo sinusal cuando el riesgo de ictus sea alto y el riesgo hemorrágico, bajo.
12.2.2Revascularización miocárdicaLos datos sobre el beneficio de la revascularización miocárdica para los pacientes con IC son escasos.
En el estudio STICH se comparó la cirugía de revascularización coronaria (CABG) con tratamiento farmacológico en pacientes con EC candidatos a CABG y con la función del VI reducida (FEVI ≤ 35%). En el seguimiento medio a los 56 meses, no hubo diferencias significativas entre el grupo de CABG y el de tratamiento farmacológico en cuanto a la tasa de mortalidad por cualquier causa, la variable principal del estudio89. En el informe del seguimiento a más largo plazo se reportó una reducción significativa de la mortalidad en el grupo de CABG frente al grupo de control (el 58,9 frente al 66,1%; HR = 0,84; IC95%, 0,73-0,97; p = 0,02) a los 10 años581. La muerte cardiovascular y la variable compuesta de muerte por cualquier causa u hospitalización por causas cardiovasculares también se redujeron significativamente en el grupo de CABG en el seguimiento a los 10 años581. Análisis posteriores del estudio STICH indican que la viabilidad miocárdica, la angina y la isquemia no se relacionaron con los resultados tras la revascularización92,93,582. El estudio HEART no tuvo suficiente potencia estadística (solo incluyó a 138 pacientes de los 800 previstos) y no logró demostrar ninguna diferencia entre los pacientes con IC tratados con CABG o tratamiento farmacológico583.
Actualmente no hay ningún estudio publicado que compare las intervenciones coronarias percutáneas (ICP) con el tratamiento farmacológico para los pacientes con IC-FEr, aunque el estudio REVIVED-BCIS2 acaba de finalizar la fase de reclutamiento de pacientes (identificador: NCT01920048)584. Además, tampoco hay estudios aleatorizados que comparen la ICP con la CABG, ya que en este tipo de estudios se excluye a los pacientes con IC-FEr. En un registro prospectivo, que incluyó a 4.616 pacientes con enfermedad multivaso e IC-FEr, las comparaciones ajustadas por tendencia mostraron una supervivencia similar (en el seguimiento medio de 2,9 años) entre los grupos de ICP y CABG, aunque se observó asociación entre la ICP y mayor riesgo de IM, especialmente en los pacientes con revascularización incompleta, y entre la CABG y mayor riesgo de ictus585. Un análisis ajustado por tendencia mostró un riesgo significativamente menor de muerte o eventos cardiovasculares graves en pacientes diabéticos con disfunción del VI y enfermedad multivaso tratados con CABG frente a ICP586. La CABG se asoció con mejores resultados que con ICP también en pacientes con disfunción moderada o grave del VI y enfermedad de tronco común izquierdo o EC compleja587,588. Dos metanálisis confirmaron que la CABG se asocia con mejores resultados tanto en mortalidad como en IM y repetición de la revascularización comparada con la ICP y/o el tratamiento farmacológico589,590.
12.3Valvulopatías cardiacas12.3.1Estenosis aórticaLa estenosis aórtica puede causar o empeorar la IC al aumentar la poscarga del VI y originar hipertrofia y remodelado del VI591. Cuando en pacientes con estenosis aórtica avanzada aparecen síntomas de IC, el pronóstico es muy malo. Ningún tratamiento farmacológico puede mejorar los resultados. Se debe administrar tratamiento médico para la estenosis aórtica a todos los pacientes con estenosis aórtica grave y sintomática. Se extremarán las precauciones cuando se usen vasodilatadores para evitar la hipotensión. Es importante que la posible mejoría de los síntomas tras el tratamiento farmacológico no retrase la intervención. Si hay sospecha de estenosis aórtica sintomática, grave y de gradiente alto (área valvular ≤ 1 cm2, gradiente medio ≥ 40mmHg), se debe descartar y corregir otras causas del aumento de flujo (anemia, hipertiroidismo, cortocircuitos arteriovenosos) antes de proseguir con la intervención de válvula aórtica592. Se recomienda una intervención de válvula aórtica para los pacientes con síntomas de IC y estenosis aórtica grave y de gradiente alto, independientemente de la FEVI. El tratamiento de la estenosis aórtica de flujo y gradiente bajos se describe en la figura 16592.
Tratamiento de los pacientes con estenosis aórtica grave, flujo bajo y gradiente bajo e insuficiencia cardiaca. Código de colores para las clases de recomendación: verde para la clase I; amarillo para la clase IIa (véase la Table 1 para más detalles sobre las clases de recomendación). EA: estenosis aórtica; EuroSCORE II: European System for Cardiac Operative Risk Evaluation II; FEVI: fracción de eyección del ventrículo izquierdo; RQVA: reemplazo quirúrgico de válvula aórtica; STS-PROM: Society of Thoracic Surgeons Predicted Risk of Mortality; TAVI: implante percutáneo de válvula aórtica; TC: tomografía computarizada; TMO: tratamiento médico óptimo. aÁrea valvular ≤ 1 cm2, velocidad pico<4,0m/s, gradiente medio<40; índice de volumen latido ≤ 35ml/m2. bEdad > 70 años, síntomas típicos sin otra explicación, hipertrofia ventricular izquierda o función longitudinal del VI reducida, gradiente medio en 30-40mmHg, área valvular ≤ 0,8 cm2, índice de volumen latido ≤ 35ml/m2 evaluados por técnicas distintas del Doppler estándar. cLa reserva de flujo se define como un aumento del índice de volumen latido>20%. dLa estenosis aórtica es muy probable si la puntuación de calcio es ≥ 3.000 en varones y ≥ 1.600 en mujeres. La estenosis aórtica es probable si la puntuación de calcio es ≥ 2.000 en varones y ≥ 1.200 en mujeres. La estenosis aórtica es poco probable si la puntuación de calcio es < 1.600 en varones y < 800 en mujeres. eAumento del área valvular a > 1,0 cm2 en respuesta al aumento de flujo (reserva de flujo) durante la ecocardiografía con dobutamina. fAumento del gradiente medio a ≥ 40mmHg sin cambios significativos en el área valvular en respuesta al aumento de flujo (reserva de flujo) durante la ecocardiografía con dobutamina. gSe recomienda el RQVA para pacientes menores de 75 años con riesgo quirúrgico bajo (puntuación STS-PROM o EuroSCORE II<4%), mientras que se recomienda el TAVI para los mayores de 75 años o con riesgo quirúrgico excesivo (puntuación STS-PROM o EuroSCORE II>8%). En el resto de los casos, se recomienda que el equipo cardiológico decida entre TAVI y RQVA valorando los pros y contras de cada procedimiento según la edad, la esperanza de vida, las preferencias del paciente y las características clínicas y anatómicas.
Recomendaciones sobre la revascularización miocárdica para pacientes con insuficiencia cardiaca y fracción de eyección reducida.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se debe considerar la CABG como estrategia de revascularización de primera elección para pacientes candidatos a cirugía, especialmente si tienen diabetes o enfermedad multivaso581,587,588,590 | IIa | B |
| Se debe considerar la resvascularización coronaria para aliviar los síntomas persistentes de angina (o equivalentes) pese al TMO, incluidos fármacos antianginosos, para pacientes con IC-FEr, SCC y anatomía coronaria adecuada para revascularización | IIa | C |
| Para los candidatos a DAVI que requieren revascularización coronaria, se debe evitar la CABG si es posible | IIa | C |
| Se puede considerar la revascularización coronaria para mejorar la evolución de los pacientes con IC-FEr, SCC y anatomía coronaria adecuada para la revascularización, después de evaluar minuciosamente la relación riesgo-beneficio individual, que incluya la anatomía coronaria (estenosis proximal > 90% en grandes vasos o estenosis en tronco común izquierdo o descendente anterior izquierda proximal), comorbilidades, esperanza de vida y perspectivas del paciente | IIb | C |
| Se puede considerar la ICP como alternativa a la CABG con base en la evaluación del equipo cardiológico y teniendo en cuenta la anatomía coronaria, las comorbilidades y el riesgo quirúrgico | IIb | C |
CABG: cirugía de revascularización coronaria; DAVI: dispositivo de asistencia ventricular izquierda; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; ICP: intervención coronaria percutánea; SCC: síndrome coronario crónico; TMO: tratamiento médico óptimo.
aClase de recomendación.
bNivel de evidencia.
Se recomienda la intervención de los pacientes con una esperanza de vida>1 año, evitando intervenciones innecesarias. El implante percutáneo de válvula aórtica (TAVI) se ha demostrado no inferior al reemplazo quirúrgico de la válvula aórtica (RQVA) en la reducción de eventos clínicos (incluida la mortalidad y el ictus discapacitante) para pacientes con riesgo quirúrgico intermedio o alto593−600. En cuanto a los pacientes con riesgo bajo, la media de edad de los incluidos en ECDA que compararon el TAVI con el RQVA fue > 70 años y el seguimiento se limitó a 2 años. Por lo tanto, el RQVA se recomienda para los pacientes menores de 75 años y con riesgo quirúrgico bajo (escala STS-PROM o EuroSCORE II<4%), mientras que se recomienda el TAVI para aquellos con edad > 75 años o con riesgo quirúrgico alto/excesivo (escala STS-PROM o EuroSCORE II > 8%). En el resto de los casos, la elección entre TAVI y RQVA se debe hacer según la valoración del equipo cardiológico, sopesando las ventajas y desventajas de cada procedimiento, la edad, la esperanza de vida, las preferencias del paciente y otros aspectos como las características clínicas y anatómicas.
Las intervenciones de válvula aórtica solo se deben llevar a cabo en centros que dispongan de cardiología intervencionista y cirugía cardiaca en el propio centro y un abordaje terapéutico estructurado y colaborativo basado en un equipo cardiológico.
Se puede considerar la valvuloplastia con balón para los pacientes con ICA muy sintomática (shock cardiogénico) como tratamiento puente a TAVI o RQVA o con insuficiencia cardiaca avanzada como tratamiento puente a la recuperación o definitivo.
12.3.2Insuficiencia aórticaLa insuficiencia aórtica grave puede llevar a la dilatación progresiva del VI, con los consiguientes disfunción, IC y mal pronóstico.
El tratamiento farmacológico puede mejorar los síntomas de IC de los pacientes con insuficiencia aórtica grave. En particular, los inhibidores del SRAA pueden ser útiles601. Los BB deben usarse con precaución, ya que prolongan la diástole y pueden empeorar la insuficiencia aórtica.
Para los pacientes con insuficiencia aórtica grave y síntomas de IC, se recomienda la cirugía de válvula aórtica independientemente de la FEVI592,602,603. En caso de riesgo quirúrgico alto o excesivo, se ha recurrido al TAVI para tratar la insuficiencia aórtica604.
12.3.3Insuficiencia mitralInsuficiencia mitral primaria (orgánica)
La insuficiencia mitral primaria tiene origen en anomalías del aparato valvular y puede causar IC.
La cirugía, preferiblemente de reparación, está recomendada para los pacientes con insuficiencia mitral primaria grave y síntomas de IC. Si la cirugía está contraindicada o se considera de alto riesgo, se puede considerar la reparación percutánea592,605.
Insuficiencia mitral secundaria (funcional)
La insuficiencia mitral secundaria es fundamentalmente una enfermedad del VI. También puede ocurrir por el agrandamiento del anillo mitral causado por la dilatación de la aurícula izquierda (AI)606. La insuficiencia mitral secundaria moderada o grave se asocia con un pronóstico muy desfavorable en los pacientes con IC607,608. Un experto en ecocardiografía debe evaluar la etiología y la gravedad de la insuficiencia mitral, con un enfoque multiparamétrico y, preferiblemente, con el paciente estabilizado tras la optimización del tratamiento farmacológico y la terapia de resincronización. Dado que la insuficiencia mitral secundaria es una entidad dinámica, puede ser útil la cuantificación ecocardiográfica durante el ejercicio para los pacientes con insuficiencia mitral secundaria moderada en reposo y con síntomas durante la actividad física609. Se recomienda la derivación temprana de los pacientes con IC e insuficiencia mitral moderada o grave a un equipo cardiológico multidisciplinario que incluya especialistas en IC para planificar la evaluación y el tratamiento. En primer lugar, el equipo cardiológico debe verificar si el paciente recibe el TMO que incluya la TRC cuando esté indicada (figura 17).
Tratamiento de la insuficiencia mitral secundaria en pacientes con insuficiencia cardiaca y fracción de eyección reducida. Código de colores para las clases de recomendación: verde para la clase I; amarillo para la clase IIa; anaranjado para la clase IIb (véase la Table 1 para más detalles sobre las clases de recomendación). ACM: asistencia circulatoria mecánica; AORE: área del orificio regurgitante efectivo; BcB: borde con borde; CABG: cirugía de revascularización coronaria; DAVI: dispositivo de asistencia ventricular izquierda; DTSVI: diámetro telesistólico del VI; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; IMS: insuficiencia mitral secundaria; IT: insuficiencia tricuspídea; NYHA: clase funcional de la New York Heart Association; TM: tratamiento médico; TMO: tratamiento médico óptimo; TPT: tratamiento puente al trasplante; TRC: terapia de resincronización cardiaca. aNYHA II-IV. bModerada-grave o grave (AORE ≥ 30 mm2). cDeben cumplirse todos los criterios siguientes: FEVI 20-50%, DTSVI<70mm, presión sistólica pulmonar<70mmHg, ausencia de disfunción del VI moderada o grave o IT grave, ausencia de inestabilidad hemodinámica612.
Para los pacientes con insuficiencia mitral grave e IC-FEr que requieren revascularización, se debe considerar la cirugía valvular y CABG combinadas. La cirugía aislada de válvula mitral puede ser una opción para los pacientes sintomáticos con insuficiencia mitral secundaria grave pese al TMO y riesgo quirúrgico bajo592.
Los estudios aleatorizados MITRA-FR y COAPT evaluaron la reparación percutánea de las valvas «borde con borde» además de TMO frente a TMO solo en pacientes sintomáticos con FEVI reducida (15-40% en MITRA-FR y 20-50% en COAPT) e insuficiencia mitral secundaria moderada-grave (AORE ≥ 20 mm2 en MITRA-FR y ≥ 30 mm2 en COAPT)610−612. El estudio MITRA-FR no logró demostrar ningún beneficio de la intervención en la mortalidad por todas las causas u hospitalizaciones por IC a los 12 meses (variable principal, HR = 1,16; IC95%, 0,73-1,84) y a los 24 meses610,611. En cambio, el estudio COAPT mostró una reducción significativa de las hospitalizaciones por IC a los 24 meses (variable principal, HR = 0,53; IC95%, 0,40-0,70) y de la mortalidad (variable secundaria, HR = 0,62; IC95%, 0,46-0,82)612. Las diferencias en la selección de pacientes, el tratamiento médico concomitante, la evaluación ecocardiográfica, los aspectos relacionados con el procedimiento y la gravedad de la insuficiencia mitral secundaria relacionada con el grado de dilatación del VI pueden ser la causa de la divergencia de los resultados de los estudios MITRA-FR y COAPT613−615. Por lo tanto, la reparación percutánea de válvula mitral «borde con borde» se puede considerar para mejorar la evolución de pacientes muy seleccionados que siguen sintomáticos (NYHA II-IV) a pesar del TMO, con insuficiencia mitral secundaria moderada-grave (AORE ≥ 30 mm2), características anatómicas favorables y que cumplen los criterios de inclusión del estudio COAPT (FEVI 20-50%, diámetro telediastólico del VI<70mm, presión pulmonar sistólica<70mmHg, ausencia de disfunción ventricular derecha moderada-grave, ausencia de insuficiencia tricuspídea grave, ausencia de inestabilidad hemodinámica) (figura 17)615,616.
La reparación percutánea de válvula mitral «borde con borde» se puede considerar también para mejorar los síntomas de los pacientes con IC avanzada, insuficiencia mitral secundaria grave y síntomas graves pese al TMO. Para estos pacientes también se debe valorar el trasplante cardiaco o el implante de DAVI376,617.
Están disponibles otros sistemas de reparación percutánea de válvula mitral, como la anuloplastia indirecta, para el tratamiento de la insuficiencia mitral secundaria. Esta técnica tiene una curva de aprendizaje más corta y menos requisitos técnicos que la reparación percutánea de válvula mitral «borde con borde» y no excluye la posibilidad de llevar a cabo otros procedimientos después. Un estudio aleatorizado con grupo placebo, en el que se probó un dispositivo de anuloplastia mitral transcatéter indirecta, mostró una reducción del volumen mitral regurgitante con remodelado inverso del VI y la AI a los 12 meses (variable principal)618. Un metanálisis posterior de datos de pacientes individuales confirmó resultados favorables en cuanto a los volúmenes de la AI y el remodelado del VI, con tendencia a la mejora en la prueba de 6 min de marcha y los síntomas, además de una reducción de las hospitalizaciones por IC619−622. El reemplazo percutáneo de la válvula mitral emerge como una opción de tratamiento, pero son necesarios estudios aleatorizados623.
Las intervenciones de válvula mitral no están recomendadas para pacientes con una esperanza de vida < 1 año por causas no cardiacas592.
Recomendaciones sobre el tratamiento de valvulopatías cardiacas en pacientes con insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Estenosis aórtica | ||
| Las intervenciones de válvula aórtica (TAVI o RQVA) están recomendadas para pacientes con IC y estenosis aórtica grave y de gradiente alto, para reducir la mortalidad y mejorar los síntomas594 | I | B |
| Se recomienda que el equipo cardiológico valore la elección de TAVI o RQVA teniendo en cuenta las preferencias del paciente y otros factores como la edad, el riesgo quirúrgico, aspectos clínicos, anatómicos y del procedimiento, además de sopesar la relación de riesgo-beneficio individual de cada estrategia592 | I | C |
| Insuficiencia mitral secundaria | ||
| Se puede considerar la reparación percutánea de válvula mitral «borde con borde» para pacientes muy seleccionados con insuficiencia mitral secundaria que no son candidatos a cirugía y no requieren revascularización, siguen sintomáticosc pese a TMO y cumplen los criteriosd para la reducción de las hospitalizaciones por IC612 | IIa | B |
| Para pacientes con IC, insuficiencia mitral secundaria grave y enfermedad coronaria que requiere revascularización, se debe considerar la CABG y la cirugía de válvula mitral combinadas | IIa | C |
| Se puede considerar la reparación percutánea de válvula mitral «borde con borde» para mejorar los síntomas de pacientes muy seleccionados con insuficiencia mitral secundaria que no son candidatos a cirugía y no requieren revascularización, siguen muy sintomáticos pese a TMO y no cumplen los criterios para la reducción de las hospitalizaciones por IC617 | IIb | C |
CABG: cirugía de revascularización coronaria; DTSVI: diámetro telesistólico del ventrículo izquierdo; FEVI: fracción de eyección del ventrículo izquierdo; NYHA: clase funcional de la New York Heart Association; RQVA: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica; TMO: tratamiento médico óptimo.
aClase de recomendación.
bNivel de evidencia.
cNYHA II-IV.
dDeben cumplirse todos los criterios siguientes: FEVI 20-50%, DTSVI<70mm, presión pulmonar sistólica<70mmHg, ausencia de disfunción ventricular derecha moderada o grave o insuficiencia tricuspídea grave, ausencia de inestabilidad hemodinámica612.
La insuficiencia tricuspídea puede causar o ser consecuencia de la disfunción del VD y la IC. En el tratamiento de la IC con insuficiencia tricuspídea se incluyen fámacos (diuréticos, antagonistas neurohormonales). En casos seleccionados se puede considerar la intervención percutánea y la cirugía592. Se debe considerar la participación de un equipo multidisciplinario que incluya a especialistas en IC para planificar la evaluación y el tratamiento.
Se recomienda la cirugía tricuspídea para los pacientes con insuficiencia tricuspídea grave que requieran cirugía cardiaca izquierda. También se puede considerar para pacientes con insuficiencia tricuspídea moderada y dilatación del anillo tricuspídeo que requiera cirugía cardiaca izquierda y pacientes sintomáticos con insuficiencia tricuspídea grave aislada592. Sin embargo, la cirugía de la insuficiencia triscuspídea aislada se asocia con alta mortalidad hospitalaria (8,8%), aunque el estado avanzado de la IC pudo influir en esos datos624. Recientemente, se han desarrollado técnicas transcatéter que pueden ser una opción de tratamiento de la insuficiencia tricuspídea. Los resultados preliminares muestran una mejoría de la insuficiencia tricuspídea y de los síntomas con tasas bajas de complicaciones625. Son necesarios estudios prospectivos para evaluar el impacto pronóstico de estos tratamientos en los pacientes con IC.
12.4HipertensiónLa hipertensión arterial es el más importante factor de riesgo de IC. Casi 2 tercios de los pacientes con IC tienen antecedente de hipertensión104,626. No se han hecho estudios clínicos para evaluar tratamientos antihipertensivos y el control de la PA en pacientes con IC e hipertensión.
El tratamiento de la IC-FEr de los pacientes hipertensos y normotensos es similar. Los fármacos recomendados, como los antagonistas neurohormonales, también reducen la PA. Los cambios en el estilo de vida, como la pérdida de peso, la restricción de la ingesta de sodio y el aumento de la actividad física, son medidas complementarias útiles4. La hipertensión no controlada es rara en los pacientes con IC-FEr, siempre que reciban TMO con las dosis recomendadas para la IC. Cuando sea necesaria una reducción adicional de la PA y no haya signos de sobrecarga de fluidos, se puede considerar la administración de amlodipino y felodipino, dado que se ha demostrado su seguridad en pacientes con IC-FEr570,571. Los BCC no dihidropiridínicos (diltiazem y verapamilo) y fármacos de acción central como la moxonidina están contraindicados, ya que se asocian con peores resultados627. Los bloqueadores alfa no tienen efectos en la supervivencia y, por lo tanto, no están indicados143. Pueden servir para tratar la hiperplasia prostática concomitante, pero se deben suspender en caso de hipotensión.
Con una prevalencia del 60-89%, la hipertensión es la causa más importante de IC-FEc39. Los pacientes con IC-FEc suelen tener una respuesta hipertensiva al ejercicio exagerada y pueden presentar edema pulmonar agudo hipertensivo628,629. El tratamiento antihipertensivo, que incluye IECA, ARA-II, BB, BCC y diuréticos, reduce la incidencia de IC630,631. La reducción de la PA también conlleva la regresión de la HVI, en un grado dependiente de la clase de fármaco prescrito4. Los IECA, ARA-II y BCC producen una regresión más efectiva de la HVI que los BB o los diuréticos632. El control inadecuado de la hipertensión puede precipitar episodios de descompensación. Se debe descartar otras causas de hipertensión secundaria, como la enfermedad renal vascular o parenquimatosa, el aldosteronismo primario y la apnea obstructiva del sueño (AOS), y en caso de que se confirme su diagnóstico, se debe considerar su tratamiento. El tratamiento de la hipertensión es importante para los pacientes con IC-FEc, pero no está claro cuál es la estrategia óptima. La estrategia de tratamiento considerada para la IC-FEr también se debe considerar en la IC-FEc4.
Los objetivos para la PA no están claros tanto en la IC-FEr como en la IC-FEc. No obstante, la evaluación de la edad y las comorbilidades del paciente (diabetes, ERC, EC, valvulopatía cardiaca e ictus) puede ayudar a personalizar el objetivo de PA4. Se debe hacer el esfuerzo necesario para alcanzar las dosis óptimas del tratamiento basado en la evidencia de los pacientes con IC-FEr, aunque se produzca una ligera hipotensión4,633. En cambio, en los pacientes con IC-FEc, HVI y escasa reserva de precarga, se debe evitar la hipotensión.
12.5IctusLa IC y el ictus coexisten frecuentemente porque comparten algunos factores de riesgo y sus mecanismos subyacentes519,634. Tienen mayor riesgo de ictus los pacientes con IC en ritmo sinusal39,426,635−637. La FA también confiere un riesgo adicional y los pacientes con IC y FA tienen un riesgo 5 veces mayor que la población de control519,634,638.
En relación con la tendencia temporal, la incidencia del ictus es más alta en los primeros 30 días después del diagnóstico de IC o de un episodio de descompensación de la IC, y disminuye en los primeros 6 meses tras el episodio agudo637,639. Los pacientes con ictus e IC tienen mayor mortalidad, déficits neurológicos más graves y hospitalizaciones más prolongadas que los pacientes sin IC637,640. Asimismo los pacientes con IC e ictus tienen más mortalidad que los pacientes sin ictus640. En el estudio COMMANDER-HF, del 47,5% de ictus, un 16,5% fueron discapacitantes y un 31%, mortales637.
Los pacientes con IC y FA concomitante, incluida la paroxística, tienen una puntuación CHA2DS2-VASc ≥ 1, por lo que tienen indicada la anticoagulación. La indicación de tratamiento antitrombótico para los pacientes con IC en ritmo sinusal es controvertida. En el estudio WARCEF, la warfarina redujo la incidencia de ictus isquémico, comparada con el AAS, pero se asoció con más hemorragias mayores y no tuvo una influencia en la variable principal compuesta de ictus isquémico, hemorragia intracerebral o muerte641. Varios metanálisis de estudios con grupo placebo confirmaron el aumento de riesgo de sangrado, que superaba el beneficio de la prevención del ictus, en pacientes con IC y en ritmo sinusal642. En el estudio COMMANDER-HF, el rivaroxabán (2,5mg/12h) no mejoró los resultados de la variable principal compuesta de mortalidad por cualquier causa, IM o ictus, y tampoco tuvo una influencia favorable en las muertes relacionadas con la IC o las hospitalizaciones por IC579. No hay datos que sustenten la prescripción sistemática de tratamiento anticoagulante para los pacientes con IC-FEr en ritmo sinusal sin antecedentes de FA paroxística. No obstante, se puede considerar la administración de dosis bajas de rivaroxabán para pacientes con SCC o enfermedad arterial periférica concomitantes, con riesgo alto de ictus y sin riesgo hemorrágico importante (véase la sección 12.2).
Se debe considerar la anticoagulación para pacientes con trombo intraventricular visible o con riesgo trombótico alto, como el de algunos pacientes con embolia periférica o algunas pacientes con miocardiopatía periparto o VI no compactado3,643−645.
13COMORBILIDADES NO CARDIOVASCULARES13.1Diabetes mellitusEl tratamiento de la IC es similar para pacientes con o sin diabetes6,646. En cambio, los fármacos antidiabéticos tienen efectos diferentes en los pacientes con IC y es preferible el uso de fármacos que sean seguros y reduzcan los eventos relacionados con la IC6,646,647.
Los iSGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina y sotagliflozina) se evaluaron en pacientes con enfermedad cardiovascular confirmada en los estudios EMPA-REG OUTCOME y VERTIS-CV, con enfermedad cardiovascular confirmada o factores de riesgo cardiovascular en los estudios CANVAS y DECLARE-TIMI 58 o con ERC y riesgo cardiovascular en el estudio SCORED respectivamente293−297. Un pequeño porcentaje de pacientes tenían IC. La empagliflozina y la canagliflozina redujeron la variable principal compuesta de eventos cardiovasculares adversos mayores (muerte cardiovascular o IM no mortal o ictus no mortal) y las hospitalizaciones en los estudios EMPA-REG OUTCOME y CANVAS respectivamente293,294. La empagliflozina también redujo la mortalidad por cualquier causa y la mortalidad cardiovascular sola293. Su efecto en la variable principal se asoció con la reducción de eventos relacionados con la IC293,294. En el estudio DECLARE-TIMI 58, la dapagliflozina no redujo la incidencia de eventos cardiovasculares mayores, pero sí la variable de eficacia de muerte cardiovascular u hospitalización por IC y la hospitalización por IC sola295. En el estudio VERTIS-CV, la ertugliflozina no redujo significativamente la variable principal de eventos cardiovasculares mayores ni la variable secundaria de muerte cardiovascular u hospitalización por IC, pero se observó una reducción estadísticamente significativa de las hospitalizaciones por IC y los reingresos297,648. En el estudio SCORED, la sotagliflozina redujo las muertes cardiovasculares y las hospitalizaciones por IC296. Un metanálisis de estos estudios y un estudio posterior sobre pacientes con ERC (estudio CREDENCE), mostraron que, en general, los iSGLT2 reducen en un 22% las hospitalizaciones por IC y por causas cardiovasculares649. Los iSGLT2 se toleran bien, aunque pueden causar infección fúngica genital y, en raras ocasiones, cetoacidosis diabética293−295. Los resultados de estudios sobre la dapagliflozina y la empagliflozina para pacientes con IC-FEr con o sin diabetes y sobre la sotagliflozina (iSGLT1/2) para pacientes con DMT2 estabilizados tras la hospitalización por ICA o en los primeros 3 días después del alta, apoyan la administración de esta clase de fármacos (véase las secciones 5.3.5 y 11.3.11)108,109,136.
Los estudios EMPA-REG OUTCOME, CANVAS, DECLARE-TIMI 58 y VERTIS-CV también mostraron una reducción del deterioro de la función renal, de la enfermedad renal en fase terminal o de la muerte por causas renales con los iSGLT2.
Con base en estos resultados, se recomienda la administración de iSGLT (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina y sotagliflozina) para prevenir la IC y la muerte cardiovascular y el deterioro de la función renal de los pacientes con DM2 y enfermedad cardiovascular y/o factores de riesgo cardiovascular o ERC. La dapagliflozina y la empagliflozina también están indicadas para el tratamiento de pacientes con DM2 e IC-FEr (véase las secciones 5.3.5 y 11.2.4); la sotagliflozina redujo las muertes cardiovasculares y las rehospitalizaciones por IC de los pacientes hospitalizados recientemente por IC6,296,646,647,650.
Según estudios observacionales, la metformina parece segura para los pacientes con IC, comparada con la insulina o las sufonilureas651,652. Sin embargo, no se recomienda para pacientes con TFGe < 30ml/min/1,73 m2 o disfunción hepática, dado el riesgo de acidosis láctica. Hasta la fecha no se ha evaluado en estudio clínicos con grupo de control6,646.
En cuanto a los inhibidores de la dipeptidil peptidasa 4 (DPP-4), las hospitalizaciones por IC aumentaron en un 27% en un estudio con saxagliptina en pacientes con diabetes653. Sin embargo, no se observaron diferencias entre el grupo de placebo y el tratamiento con alogliptina, sitagliptina o linagliptina en cuanto a las complicaciones por IC654−656. En un pequeño estudio de pacientes con diabetes e IC, la vidagliptina se asoció con un aumento del volumen del VI y del número de muertes y complicaciones cardiovasculares657. En términos generales, los efectos en la mortalidad o las complicaciones cardiovasculares no fueron significativos en los estudios y metanálisis sobre los inhibidores de la DPP-4658,659. Por lo tanto, estos fármacos no están recomendados para reducir las complicaciones cardiovasculares de los pacientes diabéticos con IC.
Los agonistas del receptor del péptido glucagón tipo 1 (GLP-1) reducen el riesgo de IM, ictus y muerte cardiovascular en pacientes con diabetes, pero probablemente no eviten una IC de nueva aparición6,660. La liraglutida no tuvo efectos en la FEVI, aumentó la frecuencia cardiaca y los eventos cardiovasculares graves en un estudio aleatorizado con grupo de placebo que incluyó a 241 pacientes con IC-FEr con o sin diabetes661. En otro estudio con 300 pacientes, no se obtuvieron resultados significativos de la variable principal, pero se observó un aumento numérico de las muertes y las hospitalizaciones por IC respecto al grupo de placebo662. Por lo tanto, no se recomiendan los agonistas del receptor del GLP-1 para la prevención de complicaciones de la IC.
La insulina es necesaria para los pacientes con diabetes mellitus tipo 1 (DM1) y para tratar la hiperglucemia de algunos pacientes con DM2, especialmente cuando se agota la función de las células beta. La insulina es una hormona con gran capacidad de retención de sodio y puede exacerbar la retención de fluidos en los pacientes con IC. Sin embargo, en un ECDA que incluyó a pacientes con DM2, alteraciones de la tolerancia a la glucosa o glucosa alterada en ayunas, la insulina no aumentó el riesgo de IC de nueva aparición663. En análisis retrospectivos de estudios aleatorizados y en bases de datos administrativas, la insulina se asoció con peores resultados664,665. En caso de que un paciente con IC necesitara isulina, se debe vigilarlo estrechamente para evitar el empeoramiento de la IC tras la instauración del tratamiento.
En varios estudios, las sulfonilureas se asociaron con mayor riesgo de complicaciones de la IC666,667, por lo que no son el tratamiento preferido para los pacientes con IC y, en caso de ser necesarias, se debe monitorizar estrechamente al paciente para evitar el empeoramiento de la IC tras el inicio del tratamiento6,646. Las tiazolidinedionas (glitazonas) causan retención de sodio y agua y aumentan el riesgo de empeoramiento y hospitalización por IC668, por lo que están contraindicadas para los pacientes con IC.
Recomendaciones sobre el tratamiento de la diabetes mellitus en la insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Los iSGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) están recomendados para los pacientes con DM2 y riesgo de complicaciones cardiovasculares, a efectos de reducir las hospitalizaciones por IC, complicaciones cardiovasculares mayores, disfunción renal en fase terminal y muerte cardiovascular293−297 | I | A |
| Los iSGLT2 (dapagliflozina, empagliflozina y sotagliflozina) están recomendados para los pacientes con DM2 e IC-FEr a efectos de reducir las hospitalizaciones por IC y muerte cardiovascular108,109,136 | I | A |
DM2: diabetes mellitus tipo 2; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2.
aClase de recomendación.
bNivel de evidencia.
Se recomienda evaluar la función tiroidea de todo paciente con IC, ya que tanto el hipotiroidismo como el hipertiroidismo pueden causar o precipitar la IC669. En estudios observacionales sobre pacientes con IC, el hipotiroidismo subclínico y los títulos bajos de triyodotironina se asociaron por separado con peores resultados670,671. Para el tratamiento de los trastornos tiroideos se debe seguir las recomendaciones generales de las guías de endocrinología. No hay estudios aleatorizados que evalúen la eficacia de la terapia de reemplazo tiroideo en el hipotiroidismo subclínico, pero hay consenso en que se debe corregir cuando la TSH es > 10 mUI/l, particularmente para los menores de 70 años. La corrección se debe valorar también a concentraciones de TSH más bajas (7-10 mUI/l)672−674.
13.3ObesidadLa obesidad es un factor de riesgo de hipertensión y EC y además se asocia con un aumento de riesgo de IC. Posiblemente tiene una relación más fuerte con la IC-FEc258,675−677. Una vez se diagnostica IC a un paciente obeso, se produce la paradoja de la obesidad, que consiste en que los pacientes con sobrepeso u obesidad leve-moderada tienen mejor pronóstico que los pacientes con menos peso, sobre todo con peso inferior al normal678,679. Sin embargo, en esta relación pueden influir otras variables y esta paradoja no se observa en pacientes con diabetes680,681. Además, el IMC no tiene en cuenta la composición corporal; p. ej., la relación entre la masa magra de músculo esquelético y la masa adiposa. Los pacientes obesos que se mantienen en buena forma física y conservan la masa de músculo esquelético tienen mejor pronóstico que los pacientes con obesidad sarcopénica682. La circunferencia de cintura o el cociente cintura-cadera, que mide la obesidad visceral, están menos influidas por la masa muscular y pueden tener una relación más fuerte con los resultados que el IMC, particularmente en mujeres683,684.
La grasa corporal tiene un impacto importante en el valor diagnóstico y pronóstico de numerosos parámetros. Los pacientes obesos con IC tienen concentraciones más bajas de PN debido a la expresión de los receptores de aclaramiento y un aumento de la degradación de los péptidos por el tejido adiposo74. El consumo pico de oxígeno ajustado por peso corporal subestima la capacidad de ejercicio de los pacientes obesos, que requieren un ajuste por masa magra a efectos de estratificar el riesgo96.
La obesidad puede ser una causa importante de IC-FEc y los pacientes obesos con IC-FEc tienen algunos mecanismos fisiopatológicos diferentes que los pacientes no obesos con IC-FEc258,675−677,685. En un estudio aleatorizado, la restricción calórica y el entrenamiento físico tuvieron efectos beneficiosos adicionales en la capacidad de ejercicio y la calidad de vida de los pacientes con obesidad e IC-FEc.337
13.4Fragilidad, caquexia, sarcopeniaLa fragilidad es un estado dinámico multidimensional, independiente de la edad, que hace al individuo más vulnerable al efecto de factores estresantes686. La IC y la fragilidad son entidades distintas que normalmente van asociadas. La evaluación de la fragilidad de los pacientes con IC es fundamental, ya que se asocia con resultados desfavorables y un menor acceso y tolerancia a los tratamientos. Se han propuesto varios instrumentos para cribar y evaluar la fragilidad en distintas enfermedades crónicas, incluida la IC. La HFA de la ESC desarrolló un instrumento específico para la IC basada en los 4 dominios más relevantes: clínico, psicocognitivo, funcional y social686.
Según un metanálisis reciente, la fragilidad es más prevalente en pacientes con IC que en la población general y puede ocurrir en hasta el 45% de los pacientes687,688. Los pacientes con IC tienen hasta 6 veces más posibilidades de ser frágiles y las personas frágiles tienen un riesgo de IC significativamente mayor689,690. La fragilidad se asocia con más riesgo de muerte, hospitalizaciones y deterioro funcional, además de hospitalizaciones más largas691−693. El tratamiento de la fragilidad en la IC debe ser multifactorial y dirigirse a sus componentes principales, y puede incluir la rehabilitación mediante entrenamiento físico, suplementos nutricionales y estrategias individualizadas para el tratamiento de comorbilidades686.
La caquexia se define como un «síndrome metabólico complejo asociado con una enfermedad subyacente y caracterizado por la pérdida de masa muscular con o sin pérdida de masa grasa»694. Su característica clínica principal es una pérdida > 5% de peso corporal en ausencia de edema en los últimos 12 meses o menos694,695. La caquexia es un proceso generalizado de debilitamiento que puede coexistir con fragilidad y ocurrir en el 5-15% de los pacientes con IC, especialmente aquellos con IC-FEr y un estado más avanzado de la enfermedad. Se asocia con una capacidad funcional reducida y menor supervivencia695−698. Dado que se asocia con otras enfermedades crónicas, como el cáncer, se debe investigar otras causas no cardiacas de la caquexia699.
La sarcopenia se define como poca masa muscular junto con función, fuerza y rendimiento muscular reducidos698. Normalmente se identifica por la masa de músculo esquelético apendicular, definida688,700,701 como la suma de la masa muscular de las cuatro extremidades 2 desviaciones estándar por debajo de la media del grupo de referencia (individuos sanos de 18-40 años) y con un valor de corte para los varones de 7,26kg/m2. La sarcopenia es un proceso fisiológico que ocurre con el envejecimiento, aunque también se puede acelerar por enfermedades crónicas, como el cáncer y la IC. La sarcopenia se puede detectar en el 20-50% de los pacientes con IC-FEr y se suele asociar con fragilidad y aumento de la morbimortalidad. Es un determinante principal de los resultados y tiene más efecto que el peso corporal y el IMC684,698,701,702. Hasta la fecha, la estrategia más efectiva para el tratamiento de la sarcopenia es el entrenamiento físico de resistencia, posiblemente combinado con una ingesta de proteínas de 1-1,5g/kg/día698,703. Varios tratamientos farmacológicos, incluidos componentes anabólicos como testosterona, hormona del crecimiento y agonistas del receptor de ghrelina, se investigaron en pequeños estudios que obtuvieron resultados favorables, fundamentalmente en términos de capacidad de ejercicio y fuerza muscular697,703−705. No hay datos sobre el impacto favorable del tratamiento de la sarcopenia en los resultados. No obstante, el entrenamiento físico tiene efectos beneficiosos en los pacientes con IC (véase la sección 9.4)95,323−329.
13.5Déficit de hierro y anemiaEl déficit de hierro y la anemia son comunes en la IC y se asocian de forma independiente con una capacidad de ejercicio reducida, hospitalizaciones por IC recurrentes y gran mortalidad cardiovascular y por cualquier causa706,707. La OMS define la anemia como una concentración de hemoglobina < 12g/dl en las mujeres y < 13g/dl en los varones. En pacientes con IC, el déficit de hierro se define como una concentración de ferritina sérica < 100ng/ml o de 100-299ng/ml con una saturación de transferrina (Sat-T)<20%708−710. La expresión y la concentración tisular de ferritina en sangre periférica aumenta con la inflamación y otras enfermedades como infección, cáncer, enfermedad hepática e IC. Por ello, se han aplicado valores de corte más altos para definir el déficit de hierro en los pacientes con IC709−711. Otro marcador de agotamiento del hierro intracelular puede ser la alta concentración de receptores solubles de transferrina, que deriva de la proteolisis de la membrana del receptor. Su síntesis aumenta con el déficit de hierro y no le afecta la inflamación. La alta concentración sérica del receptor soluble de transferrina identifica a los pacientes con alto riesgo de muerte adicional al de las variables pronósticas estándar711,712. No obstante, hasta ahora no se ha demostrado su utilidad para la indicación de tratamiento con suplementos de hierro.
El déficit de hierro, que puede darse independientemente de la anemia, se encuentra en hasta el 55% de los pacientes con IC crónica y hasta el 80% de aquellos con ICA713−716. Se puede producir por una mayor pérdida o una menor ingesta o absorción de hierro (desnutrición, obstrucción intestinal) o por una alteración del metabolismo del hierro causada por la activación inflamatoria crónica de la IC, aunque la causa exacta del déficit de hierro en la IC se desconoce. El déficit de hierro puede afectar a la capacidad funcional, desencadenar una descompensación circulatoria y promover la disfunción de músculo esquelético y se asocia con fragilidad, independientemente de la anemia716−718.
Ante todo paciente con IC, se recomienda el cribado de la anemia y el déficit de hierro mediante recuento sanguíneo completo, concentración de ferritina sérica y Sat-T. En caso de detectarse anemia o déficit de hierro, se deben realizar las pruebas necesarias para identificar su causa.
La darbepoetina alfa no logró reducir la mortalidad por cualquier causa o las hospitalizaciones por IC y aumentó el riesgo de complicaciones tromboembólicas en el único estudio aleatorizado a gran escala en pacientes con IC-FEr y anemia leve o moderada719. Por lo tanto, los estimuladores de la eritropoyetina no están indicados para el tratamiento de la anemia en la IC.
Recomendaciones sobre el tratamiento de la anemia y el déficit de hierro para pacientes con insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda el cribado periódico de la anemia y el déficit de hierro mediante recuento sanguíneo completo, concentración de ferritina sérica y Sat-T en todos los pacientes con IC | I | C |
| Se debe considerar la administración intravenosa de suplementos de hierro con carboximaltosa férrica para los pacientes sintomáticos con FEVI < 45% y déficit de hierro, definido como ferritina sérica < 100ng/ml o de 100-299ng/ml con Sat-T < 20%, para aliviar los síntomas de IC y mejorar la capacidad de ejercicio y la calidad de vida720,722,724 | IIa | A |
| Se debe considerar la administración intravenosa de suplementos de hierro con carboximaltosa férrica para los pacientes sintomáticos hospitalizados recientemente por IC y con FEVI < 50% y déficit de hierro, definido como ferritina sérica < 100ng/ml o de 100-299ng/ml con Sat-T < 20%, para reducir el riesgo de hospitalización por IC512 | IIa | B |
FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; Sat-T: saturación de transferrina.
aClase de recomendación.
bNivel de evidencia.
Varios ECDA han demostrado que la suplementación de hierro con carboximaltosa férrica intravenosa es segura y mejora los síntomas, la capacidad de ejercicio y la calidad de vida de los pacientes con IC-FEr y déficit de hierro720−723. Asimismo, varios metanálisis muestran una reducción del riesgo de las variables combinadas de mortalidad por cualquier causa u hospitalización por causas cardiovasculares, muerte cardiovascular u hospitalización por IC, y muerte por causas cardiovasculares u hospitalización recurrente por causas cardiovasculares o por IC724,725. Los efectos favorables de los suplementos de hierro fueron independientes a la coexistencia de anemia726. En el estudio AFFIRM-AHF, se aleatorizó a los pacientes hospitalizados por IC con FEVI < 50% y déficit de hierro a carboximaltosa férrica intravenosa o placebo, con administración repetida a intervalos de 6 semanas, y después 12, si estaba indicado según las pruebas repetidas de determinación de hierro512. La administración de carboximaltosa férrica no redujo significativamente la variable principal compuesta del total de hospitalizaciones por IC y muerte cardiovascular a las 52 semanas (cociente de tasas, 0,79; IC95%, 0,62-1,01; p=0,059). Sin embargo, redujo la variable compuesta de primera hospitalización por IC o muerte cardiovascular (HR = 0,80; IC95%, 0,66-0,98; p = 0,030) y el total de las hospitalizaciones por IC (cociente de tasas, 0,74; IC95%, 0,58-0,94; p = 0,013)512. Por lo tanto, se debe considerar la administración de suplementos de hierro con carboximaltosa férrica intravenosa para mejorar los síntomas, la capacidad de ejercicio y la calidad de vida de los pacientes con IC y FEVI < 45%. También se debe considerar para reducir las hospitalizaciones por IC de los pacientes con FEVI < 50% hospitalizados recientemente por empeoramiento de la IC. Se espera que los resultados de estudios en curso proporcionen más pruebas de los efectos de la carboximaltosa férrica en los pacientes con IC-FEc. También están en marcha estudios a gran escala con otras formulaciones de hierro para los pacientes con IC-FEr, IC-FEc e ICA727. La administración oral de hierro no es efectiva y no mejoró la capacidad de ejercicio de los pacientes con IC-FEr y déficit de hierro728, por lo que no se recomienda para el tratamiento del déficit de hierro en pacientes con IC.
13.6Disfunción renalLa ERC y la IC a menudo coexisten471,707,729 y comparten factores de riesgo, como la diabetes o la hipertensión. La ERC puede empeorar la función cardiovascular y causar hipertensión y calcificación vascular. La IC puede empeorar la función renal a través de los efectos de la activación neurohormonal e inflamatoria, la presión venosa aumentada y la hipoperfusión. El estrés oxidativo y la fibrosis tienen un papel importante como mecanismos patógenos en la IC con ERC730,731.
Aunque la ERC y el deterioro de la función renal parecen más comunes en la IC-FEc que en la IC-FElr y la IC-FEr, quizá por los mecanismos fisiopatológicos compartidos, parece que tienen menos relación con peores resultados en la IC-FEc que en la IC-FElr y la IC-FEr732,733.
La ERC es uno de los principales determinantes independientes de un aumento de la morbimortalidad en la IC471,734−736. Sin embargo, en algunos contextos los cambios en la creatinina sérica no se asocian con peores resultados. Cuando se inicia el tratamiento con inhibidores del SRAA, INRA o iSGLT2, la disminución inicial de la presión glomerular puede reducir la TFG y aumentar la concentración sérica de creatinina. Sin embargo, estos cambios suelen ser transitorios y ocurren aunque la evolución del paciente mejore y se ralentice el deterioro de la función renal en el largo plazo. Por ejemplo, en el estudio EMPEROR-Reduced, la reducción de la TFGe (corregida por placebo) inducida por la empagliflozina en la semana 4 fue de 2,4ml/min/1,73 m2 en los pacientes con ERC y 2,7ml/min/1,73 m2 en aquellos sin ERC, lo que implica una reducción de los títulos basales del 5,2 y el 3,8% respectivamente. A esto siguió una pendiente menos pronunciada de deterioro de la TFGe y una tasa menor de la variable renal combinada con empagliflozina frente a placebo, sin diferencia entre los pacientes con y sin ERC basal109,737.
Por lo tanto, con respecto a la instauración de tratamiento con inhibidores del SRAA, INRA o iSGLT2, la disminución transitoria de la función renal no debe llevar a la pronta interrupción del tratamiento. Se puede considerar aceptable un aumento de creatinina sérica < 50% del valor basal, siempre que sea<266μmol/l (3mg/dl), o una reducción de la TFGe < 10% del valor basal, siempre que la TFGe sea>25ml/min/1,73 m2 (véase la sección 5.3 y la tabla 8 del material adicional). Además, con respecto al tratamiento diurético, los aumentos pequeños y transitorios de la creatinina sérica durante el tratamiento de la ICA no se asocian con peores resultados, especialmente si van acompañados de descongestión108,109,460−462,471,729,737−740.
Estudios aleatorizados muestran que los pacientes con IC y ERC concomitante tienen más riesgo de complicaciones, pero el efecto beneficioso del tratamiento farmacológico es similar, o incluso mayor, que en los pacientes con función renal normal206,471,741,742. Los BB reducen la mortalidad de los pacientes con IC-FEr y disfunción renal moderada (TFGe, 45-59ml/min/1,73 m2) o moderadamente grave (TFGe, 30-44ml/min/1,73 m2), mientras que no hay evidencia sobre los pacientes con disfunción renal grave (TFGe < 30ml/min/1,73 m2)743. El sacubitrilo-valsartán, comparado con enalapril, llevó a un deterioro de la función renal más lento pese a un ligero aumento del cociente albúmina urinaria/creatinina, y mejoró de forma similar los resultados cardiovasculares para los pacientes con ERC y el resto de pacientes del estudio PARADIGM-HF127. Los iSGLT2 ralentizaron el deterioro de la función renal, comparado con placebo, en pacientes tanto con IC-FEr como con ERC108,109,737,738,744. La mejoría del gasto cardiaco tras la TRC o el implante de DAVI se puede asociar con una mejoría al menos transitoria de la función renal471,745,746. Los beneficios del DAI pueden reducirse en los pacientes con disfunción renal grave, dado el riesgo asociado de muerte por causas no arrítmicas747−749.
Hay pocos datos para respaldar recomendaciones sobre el tratamiento de los pacientes con IC y ERC grave, ya que hasta la fecha los ECDA han excluido a los pacientes con ERC en fases avanzadas (TFGe<30ml/min/1,73 m2) (tabla 23 del material adicional). En estudios más recientes, los valores de corte para la inclusión de pacientes fueron más bajos: 25ml/min/1,73 m2 en el estudio DAPA-CKD, 20ml/min/1,73 m2 en los estudios EMPEROR-Reduced y GALACTIC-HF y 15ml/min/1,73 m2 en el estudio VICTORIA109,141,737,738,750. Pese a las diferencias en las características basales de los pacientes con la función renal muy deteriorada y los demás pacientes, en los análisis de subgrupos de estos estudios no se observó ninguna interacción entre los efectos farmacológicos y la función renal109,141,738,750.
Fármacos oncológicos que causan insuficiencia cardiaca.
| Tratamiento oncológico | Indicación |
|---|---|
| Quimioterapia con antraciclina (doxorubicina, epirubicina, daunorubicina, idarubicina) | Cáncer de mama, linfoma, leucemia aguda, sarcoma |
| Tratamiento dirigido a los receptores del HER2 (trastuzumab, pertuzumab, trastuzumab emtansina T-DM1, lapatinib, neratinib, tucatinib) | Cáncer de mama HER2+Cáncer gástrico HER2+ |
| Inhibidor del FCEVITC (sunitinib, pazopanib, sorafenib, axitinib, tivozanib, cabozantinib, regorafenib, lenvatinib, vandetinib) y anticuerpos (bevacizumab, ramucirumab) | ITC/FCEV: cáncer renal, cáncer hepatocelular, cáncer de tiroides, cáncer de colón, sarcoma, TEGIAnticuerpos: cáncer de mama, cáncer de ovarios, cáncer gástrico, cáncer gastroesofágico, cáncer de colón |
| Inhibidores múltiples de la tirosincinasa: ITC BCR-ABL de segunda y tercera generación (ponatinib, nilotinib, dasatinib, bosutinib) | Leucemia mieloide crónica |
| Inhibidores del proteasoma (carfilzomib, bortezomib, ixazomib)Fármacos inmunomoduladores (lenalidomida, pomalidomida) | Mieloma múltiple |
| Combinación de inhibidores de RAF y MEK (dabrafenib+trametinib, vemurafenib+cobimetinib, encorafenib+binimetinib) | Melanoma por mutación del gen RAF |
| Terapia de privación androgénicaAgonistas de la GnRH (goserelina, leuprorelina)Antiandrógenos (abiraterona) | Cáncer de próstata, cáncer de mama |
| Inhibidores de punto de control inmunitario:Inhibidores de PD-1 (nivolumab, pembrolizumab)Inhibidores de CTLA-4 (ipilimumab)Inhibidores de PD-1 ligando (avelumab, atezolizumab, durvalumab) | Melanoma (metastásico y adyuvante)Cáncer renal metastásico, cáncer de pulmón no microcítico, cáncer de pulmón microcítico, linfoma de Hodgkin refractario, cáncer de mama metastásico triple negativo, cáncer de vejiga, cáncer de hígado, cáncer con MMR deficiente |
FCEV: factor de crecimiento endotelial vascular; GnRH: gonadoliberina; HER2: receptor 2 del factor de crecimiento epidérmico humano; ITC: inhibidor de la tirosincinasa; MEK: proteincinasa activada por mitógenos; MMR: desajuste en la reparación; TEGI: tumor del estroma gastrointestinal.
Los trastornos electrolíticos son frecuentes en los pacientes con IC y suelen ser iatrogénicos751. Las concentraciones séricas de potasio tienen una relación en forma de U con la mortalidad, con el menor riesgo de muerte en un intervalo relativamente estrecho de 4 a 5mmol/l752−758.
La hipopotasemia se define como potasio sérico<3,5mmol/l y puede ocurrir en un 50% de los pacientes con IC759. La hipopotasemia suele estar inducida por la administración de diuréticos del asa y tiacidas. Puede causar arritmias ventriculares potencialmente mortales y aumentar la mortalidad cardiovascular. El tratamiento de la hipopotasemia incluye inhibidores del SRAA, diuréticos ahorradores de potasio y suplementos orales de potasio (comprimidos de cloruro potásico). Cuando no es posible la administración oral, podría ser necesaria la infusión de suplementos de potasio (de 20 a 40mmol de potasio en 250-1.000ml de salino normal). La infusión de la solución rica en potasio debe tener una tasa lenta y se administrará a través de un vaso venoso grande mediante un catéter venoso.
La hiperpotasemia se define como potasio sérico>5mmol/l y se puede clasificar como leve (> 5,0 a<5,5mmol/l), moderado (5,5 a 6,0mmol/l) o grave (> 6,0mmol/l)760. La hiperpotasemia se asocia con mayor riesgo de hospitalización y muerte752,753,755,756,761,762. La hiperpotasemia se puede asociar con la administración de inhibidores del SRAA, ERC y aumento de la absorción760. La prevalencia de la hiperpotasemia en cualquier momento entre los pacientes con IC parece ser inferior al 5%757, pero la incidencia es mucho más alta, hasta el 40% en la IC crónica y el 73% en la ERC con seguimientos de aproximadamente 1 año753,756,757,763−765. En el estudio PARADIGM-HF, el tratamiento con sacubitrilo-valsartán se asoció con menos riesgo de hiperpotasemia grave que con enalapril128. La hiperpotasemia potencialmente mortal debe tratarse inmediatamente con una combinación de carbonato de calcio o bicarbonato sódico, insulina con o sin glucosa y agonistas betaadrenérgicos (como el salbutamol, fuera de indicación en algunos países de la UE). Estos fármacos favorecen la entrada de potasio en las células y no aumentan la excreción de potasio. Por lo tanto, solo ejercen un beneficio corto y la reactivación de la hiperpotasemia puede ocurrir después de unas horas. Se puede administrar diuréticos del asa para facilitar la pérdida de potasio.
Los aglutinantes de potasio se unen al potasio en el tracto gastrointestinal y reducen su absorción. Sirven para la reducción aguda y crónica de potasio. Incluyen el sulfonato de poliestireno sódico, el sulfonato de poliestireno de calcio, el patiromer cálcico de sorbitex y el ciclosilato de circonio y sodio (SZC); estos dos últimos se toleran mejor. El sulfonato de poliestireno sódico sigue indicado para la anuria u oliguria grave, pero no debe emplearse a medio o largo plazo, ya que puede tener efectos secundarios gastrointestinales graves, como necrosis intestinal760. El patiromer o el SZC aumentan la excreción fecal de potasio y actúan fundamentalmente en el colon. Ambos compuestos son efectivos para normalizar las concentraciones elevadas de potasio, mantener la normopotasemia a largo plazo y prevenir la recurrencia de hiperpotasemia, por lo que se pueden considerar para el tratamiento de esta entidad (véase la tabla 24 del material adicional)766−768.
Infección en pacientes con insuficiencia cardiaca.
| Los pacientes con IC tienen mayor riesgo de infección y peores resultados cuando sufren infecciones |
| La telemonitorización evita el riesgo de infecciones causadas por el contacto estrecho. Es útil durante situaciones de pandemia |
| Se puede implementar la telemonitorización para el seguimiento de pacientes en situaciones de pandemia |
| En situaciones de pandemia, se debe cribar la infección en el momento de la hospitalización, en caso de ingreso urgente o antes de las hospitalizaciones electivas |
| Además de los signos clínicos de IC, es necesario evaluar el estado de fluidos durante la hospitalización de los pacientes con sepsis concomitante. Se pueden tomar mediciones repetidas del diámetro y la colapsabilidad de la vena cava inferior mediante ecocardiografía para evaluar el estado de fluidos |
| Se debe continuar el TMO (incluidos bloqueadores beta, IECA, ARA-II o INRA, ARM e iSGLT2) de los pacientes con IC crónica siempre que lo permitan la PA y las condiciones hemodinámicas, teniendo en cuenta la interacción farmacológica con las terapias contra la infección y el perfil de efectos secundarios |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; IC: insuficiencia cardiaca; IECA: inhibidores de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; PA: presión arterial; TMO: tratamiento médico óptimo.
La disfunción renal y la hiperpotasemia son los principales motivos de la insuficiente prescripción de los inhibidores del SRAA, particularmente ARM, en la práctica clínica342,753,758,769−771. La administración de compuestos reductores de potasio, como patiromer o SZC, permitiría instaurar o aumentar el tratamiento en una mayor proporción de pacientes. Esta hipótesis se probó en estudios aleatorizados, con enmascaramiento doble y controlados con grupo placebo, en los que se administró patiromer o placebo a pacientes con ERC e hiperpotasemia o a pacientes cuyo tratamiento con inhibidores del SRAA se interrumpió por hiperpotasemia y tenían indicación de espironolactona por IC y/o hipertensión refractaria. El patiromer fue más efectivo en la reducción de potasio sérico y de los episodios de hiperpotasemia que el inicio o la intensificación del tratamiento con espironolactona772−775. Actualmente, el estudio DIAMOND (identificador: NCT03888066) está evaluando el impacto en las variables clínicas de una estrategia basada en la administración de patiromer, comparado con placebo, en pacientes con IC-FEr hiperpotasémicos mientras reciben tratamiento con inhibidores del SRAA o con antecedentes de hiperpotasemia y posterior reducción o interrupción de inhibidores del SRAA (véase la sección 13.1 del material adicional)776,777.
La hiponatremia se define como concentraciones de sodio sérico < 136mmol/l. Es frecuente en la IC y puede hallarse en hasta un 30% de los pacientes ingresados por IC. Refleja la activación neurohormonal y es un importante marcador independiente de mal pronóstico en pacientes con IC aguda o crónica778,779.
La hiponatremia grave puede causar síntomas neurológicos (convulsiones, obnubilación, delirio) por edema cerebral y puede requerir tratamiento inmediato con salino hipertónico con aumentos de sodio sérico de 1-2mmol/l/h, aunque menos de 8mmol/l en 24 h, ya que la corrección muy rápida aumenta el riesgo de mielinolisis. El tratamiento intravenoso no es necesario cuando la hiponatremia es menos grave (p. ej.,>124mmol/l) y cuando no hay síntomas. Dado que la patogénesis de la hiponatremia en la IC está relacionada con la dilución, es decir, está causada por retención de agua inducida por la secreción aumentada de vasopresina, el tratamiento se basa en la restricción de agua y antagonistas de la vasopresina. La restricción de fluidos a menos de 800-1.000ml/día puede estar indicada para alcanzar un ajuste negativo de agua y tratar la hiponatremia. La restricción de agua se asoció con una mejoría de la calidad de vida en un pequeño estudio aleatorizado, pero solo con ligeros aumentos de sodio sérico en un estudio observacional780,781. El tolvaptán, un antagonista oral de la acción de la arginina-vasopresina en el receptor V2, se puede usar para aumentar el sodio sérico y la diuresis en pacientes con hiponatremia persistente y congestión. Sin embargo, en los ECDA realizados no se han observado efectos significativos en las variables de valoración (véase la sección 13.1 del material adicional)782−785. En estudios pequeños y estudios observacionales, la infusión de salino hipertónico combinada con diuréticos del asa se asoció con un aumento de las concentraciones de sodio sérico y una mayor eficacia del tratamiento diurético786−788.
La hipocloremia (< 96mmol/l) es un predictor independiente de mortalidad en pacientes con IC aguda o crónica439,789−792. El cloro en sangre puede tener un efecto directo en el control de la secreción de renina y de la respuesta al tratamiento con diuréticos del asa o tiacidas439,793. La acetazolamida, un inhibidor de la anhidrasa carbónica, aumenta la reabsorción de cloro y causa una mayor excreción de bicarbonato y sodio en el túbulo proximal de la nefrona. Puede aumentar las concentraciones de cloro sérico y la diuresis en pacientes con IC grave y riesgo de resistencia diurética145,794. La acetazolamida se está investigando en un estudio multicéntrico aleatorizado en pacientes con IC descompensada469.
13.8Enfermedad pulmonar, trastornos respiratorios durante el sueñoEn total, la EPOC afecta a alrededor del 20% de los pacientes con IC y tiene un impacto importante en los síntomas y los resultados795−797. Debido al solapamiento de los signos y síntomas, la diferenciación entre IC y EPOC puede ser difícil. El examen de la función pulmonar con espirometría está recomendado como primera prueba diagnóstica y se debe considerar para los pacientes con sospecha de EPOC. Para una adecuada interpretación, se debe llevar a cabo en pacientes estables y euvolémicos, a efectos de evitar la confusión por la congestión relacionada con patrones de obstrucción pulmonar. En caso de incertidumbre sobre la reversibilidad de la obstrucción de vías aéreas, es necesario referir al paciente al servicio de neumología para que se realicen pruebas más sofisticadas (prueba broncodilatadora, prueba de provocación bronquial, capacidad de difusión)798,799.
Por lo general, los pacientes con EPOC toleran bien el tratamiento de la IC800. Los BB pueden empeorar la función de pacientes individuales, pero no están contraindicados en la EPOC ni en el asma, como mostraron los estudios GOLD y GINA respectivamente801,802. En el estudio GINA se mostró que el asma no se debe considerar una contraindicación absoluta para los BB cardioselectivos (bisoprolol, succinato de metoprolol o nebivolol) si se tienen en cuenta los riesgos relativos y los beneficios. En la práctica clínica, se debe promover el tratamiento con dosis bajas de BB cardioselectivos, con una estrecha vigilancia de signos o síntomas de obstrucción de vías aéreas (sibilancias, falta de aire o ralentización de la espiración). Aunque no se han probado en pacientes con IC, no parece que los corticoides inhalados y los agonistas betaadrenérgicos aumenten las complicaciones cardiovasculares, como la IC, en pacientes con riesgo alto803,804. Además, el tratamiento óptimo de la EPOC puede mejorar la función cardiaca805.
Los trastornos respiratorios durante el sueño ocurren en más de un tercio de los pacientes con IC y su prevalencia es mayor en los pacientes con ICA. Las formas más comunes son: la apnea central del sueño (ACS), similar a la respiración de Cheyne-Stokes, la apnea obstructiva del sueño (AOS) y un patrón mixto de ambas. Se ha demostrado que la ACS y la AOS se asocian con un peor pronóstico en la IC. La AOS se asocia con un aumento del riesgo de IC en varones. La ACS es el trastorno respiratorio durante el sueño más común en la IC-FEr y, a su vez, la IC-FElr es la causa más común de ACS806,807. Se debe investigar la presencia de trastornos respiratorios durante el sueño en los pacientes con IC. La revisión de la historia del sueño debe implicar a las parejas. Los cuestionarios son fundamentales para identificar a los pacientes en riesgo. La monitorización en el domicilio permite identificar y distinguir el tipo de apnea del sueño, aunque la polisomnografía nocturna sigue siendo la prueba definitiva807. El uso de servoventilación adaptativa no está recomendada para los pacientes con IC-FEr y ACS predominante, según los resultados del estudio SERVE-HF, en el que se observó un efecto no significativo en la variable principal combinada de muerte por cualquier causa o intervención cardiovascular para salvar la vida, pero que mostró un aumento de la mortalidad por todas las causas y cardiovascular con la servoventilación adaptativa808. En un estudio multicéntrico prospectivo que incluyó a 151 pacientes con ACS se evaluó la estimulación transvenosa del nervio frénico809. La variable principal de eficacia fue la reducción del índice de apneas-hipopneas desde la fase basal hasta los 6 meses, que alcanzó un porcentaje alto de los pacientes asignados a tratamiento activo. Otras medidas de la calidad del sueño y la calidad de vida mejoraron y no hubo diferencias en ninguna de las variables de seguridad entre el tratamiento activo y el control809. Se observaron resultados similares en 96 pacientes con IC810.
Los pacientes con IC-FEr evaluados para el tratamiento de trastornos respiratorios del sueño con presión positiva en la vía aérea deben someterse a un estudio formal del sueño para documentar el tipo de apnea del sueño predominante (central u obstructiva). Cuando el trastorno respiratorio del sueño está causado por AOS, la hipoxemia nocturna se puede tratar con suplementación de oxígeno nocturna, presión positiva continua en la vía aérea, presión positiva con 2 niveles de presión en la vía aérea y servoventilación adaptativa. No obstante, de ninguna de estas intervenciones se han demostrado efectos beneficiosos en los resultados de la IC807. Cuando el trastorno respiratorio del sueño está causado por ACS, la presión positiva en la vía aérea está contraindicada para los pacientes con IC-FEr808. Para estos pacientes, se puede considerar el implante de un dispositivo de estimulación del nervio frénico con el objetivo de aliviar los síntomas.
13.9Hiperlipemia y tratamiento hipolipemianteDos grandes estudios que incluyeron a pacientes con IC-FEr y 1 metanálisis de 24 ECDA no mostraron beneficio del tratamiento con estatinas en cuanto a mortalidad cardiovascular o ictus en pacientes con IC-FEr811,812. En un metanálisis de los estudios CORONA y GISSI-HF, se observó una reducción de las hospitalizaciones por IC y una ligera reducción de los IM813−815. Con base en la evidencia actual, no está recomendada la administración sistemática de estatinas a pacientes con IC sin otra indicación (p. ej., EC). Dado que no hay evidencia de daño tras la manifestación de IC en los pacientes tratados con estatinas, no es necesario interrumpir el tratamiento de los pacientes que ya las toman.
13.10Gota y artritisCon una prevalencia de hasta el 50%, la hiperuricemia es un hallazgo frecuente en los pacientes con IC crónica816,817. El tratamiento diurético puede causar o agravar la hiperuricemia, que está relacionada con los síntomas, la capacidad de ejercicio, la gravedad de la disfunción diastólica y el pronóstico a largo plazo817,818. Por cada aumento de ácido úrico en sangre de 1mg/dl, los riesgos de mortalidad por cualquier causa y hospitalización por IC aumentan un 4 y un 28% respectivamente819. El febuxostat y el alopurinol reducen el ácido úrico. El alopurinol se asoció con menores tasas de mortalidad por cualquier causa y cardiovascular, comparado con febuxostat en un estudio multicéntrico a doble ciego y de no inferioridad que incluyó a 6.190 pacientes con gota y enfermedad cardiovascular, el 20% con IC, tras un seguimiento de 32 meses820. Por lo tanto, el alopurinol está recomendado como fármaco de primera elección para la reducción del urato en pacientes con IC y sin contraindicaciones. No hay evidencia de que el tratamiento reductor de ácido úrico tenga efectos beneficiosos en la función del VI, los síntomas o los resultados de los pacientes con IC821−823.
Con respecto al tratamiento de los ataques de gota, los antiinflamatorios no esteroideos (AINE) pueden empeorar la función renal y precipitar la descompensación aguda de la IC. La colchicina es preferible, ya que se asocia con menos efectos secundarios824. No obstante, debe administrarse con precaución a los pacientes con disfunción renal y está contraindicada para los pacientes en diálisis. En modelos experimentales se observó un aumento de la vulnerabilidad ventricular825.
La artritis es una comorbilidad habitual y motivo frecuente tanto de la prescripción de AINE como de la automedicación con ellos. Estos fármacos están relativamente contraindicados, ya que pueden precipitar la descompensación aguda en los pacientes con IC826. La artritis reumatoide se asocia con un aumento de 2-3 veces del riesgo de IC y este riesgo es independiente de la presencia de cardiopatía isquémica, lo cual indica que tiene un papel directo en la fisiopatología de la IC827,828. No se ha establecido la seguridad de los fármacos modificadores de la enfermedad en la IC. Las dosis altas de fármacos contra el factor de necrosis tumoral alfa se asociaron con un empeoramiento de la IC en los estudios iniciales y deben administrarse con precaución. No se observaron efectos adversos con dosis más bajas829−831.
13.11Disfunción eréctilLa disfunción eréctil es un problema serio en pacientes con IC, ya que se asocia con factores de riesgo cardiovascular, comorbilidades (diabetes), estilo de vida (inactividad) y tratamiento (fármacos)832. En la población general, la prevalencia de la disfunción eréctil se estima en el 50% de los varones de 60 o más años, pero puede ser de hasta el 81% de los pacientes cardiacos de diferentes culturas y grupos étnicos833. El diagnóstico debe incluir cuestionarios para evaluar una posible disfunción eréctil y los factores que pueden estar relacionados con ella. Muchas clases de fármacos cardiovasculares, particularmente los diuréticos y los BB, pueden causar disfunción eréctil. No obstante, la relación entre el tratamiento cardiovascular contemporáneo y la disfunción eréctil no está clara834. Para el tratamiento de la disfunción eréctil, los inhibidores de la fosfodiesterasa 5 suelen ser seguros y efectivos para los pacientes con IC estable834,835. Ningún estudio ha demostrado la mayor eficacia o seguridad de un fármaco sobre otros. Sin embargo, no se debe administrar inhibidores de la fosfodiesterasa 5 a pacientes tratados con nitratos, y los nitratos no deben administrarse en las primeras 24 h tras la administración de sildenafilo o vardenafilo o en las primeras 48 h tras la administración de tadalafilo834.
13.12DepresiónLa depresión afecta al 20% de los pacientes con IC y es grave en la mitad de ellos. Su incidencia es mayor en las mujeres y se asocia con peor estado clínico y mal pronóstico836−838. Se recomienda el cribado de la depresión mediante un cuestionario validado si hay sospecha clínica de depresión. El Inventario de Depresión de Beck y la Escala de Depresión Cardiaca son los cuestionarios formalmente validados para evaluar la depresión en pacientes con IC. También se puede aplicar otros cuestionarios, como la Escala de Depresión Geriátrica, la Escala de Depresión de Hamilton o la Escala de Ansiedad y Depresión Hospitalaria837,838.
No hay consenso sobre la mejor terapia para los pacientes con IC y depresión. Las intervenciones psicosociales pueden mejorar los síntomas depresivos, pero no tienen un efecto en el pronóstico de los pacientes con IC deprimidos839. Los síntomas depresivos pueden mejorar con inhibidores selectivos de la recaptación de serotonina, pero los estudios diseñados específicamente para evaluar el efecto de estos fármacos en los pacientes con IC y depresión no lograron mostrar un beneficio significativo en los síntomas ni en los resultados clínicos frente al placebo840,841. Curiosamente, los pacientes del grupo a placebo también mejoraron, lo cual indica la importancia de la mejor atención recibida por estos pacientes. Ambos estudios demostraron la seguridad de la sertralina y el escitalopram respectivamente840,841. Se debe evitar los antidepresivos tricíclicos para el tratamiento de la depresión en la IC, ya que pueden causar hipotensión, empeoramiento de la IC y arritmias837,838.
13.13CáncerEn pacientes con cáncer, la IC se produce como resultado de la interacción entre el tratamiento anticancerígeno, el propio cáncer y el perfil cardiovascular del paciente (factores de riesgo y enfermedad cardiovascular concomitante)842−846. Algunos tratamientos contra el cáncer pueden causar IC directamente por su efecto cardiotóxico (tabla 23) o indirectamente por otros mecanismos como miocarditis, isquemia, hipertensión sistémica o pulmonar, arritmias o valvulopatías844,845,847−852. La IC, a su vez, puede afectar a los resultados del cáncer al privar a los pacientes de tratamientos efectivos contra el cáncer699. Algunos datos epidemiológicos y experimentales indican que existe una interacción recíproca adicional entre el cáncer y la IC, ya que algunos estudios, pero no todos, muestran una mayor incidencia del cáncer en los pacientes con IC853−858.
La prevención de la IC en pacientes con cáncer sometidos a tratamientos contra el cáncer potencialmente cardiotóxicos requiere la evaluación minuciosa y el tratamiento de los pacientes antes, durante y después de la terapia contra el cáncer, preferiblemente en el contexto de un servicio integrado de cardio-oncología (figura 18)845,859,860. Se recomienda evaluar el riesgo cardiovascular basal mediante la escala HFA-ICOS en todos los pacientes programados para tratamientos contra el cáncer potencialmente cardiotóxicos846. Se han desarrollado formularios para evaluar el riesgo cardiovascular basal para distintas terapias anticancerígenas potencialmente cardiotóxicas. El antecedente de IC o miocardiopatía caracteriza a los pacientes en riesgo muy alto o alto con los tratamientos anticancerígenos, excepto los antiandrógenos para el cáncer de próstata. Una FEVI < 50% es un factor de riesgo adicional para los pacientes con riesgo alto, y las concentraciones basales de PN o troponina elevadas son criterios adicionales de riesgo medio para la mayoría de los tratamientos anticancerígenos846.
Tratamiento de los pacientes con cáncer e insuficiencia cardiaca. ECG: electrocardiograma; FCEV: factor de crecimiento endotelial vascular; HER2: receptor 2 del factor de crecimiento epidérmico humano; HFA: Heart Failure Association; IC: insuficiencia cardiaca; ICOS: International Cardio-Oncology Society; MEK: proteincinasa activada por mitógenos; PN: péptido natriurético. aQuimioterapia con antraciclina, tratamiento con trastuzumab y HER2, inhibidores del VEGF, inhibidores de proteasoma, combinación de RAF+MEK. bSe puede emplear los criterios cardiovasculares de riesgo basal de la HFA-ICOS para calcular el riesgo bajo, medio o alto846. cSe debe aplicar vigilancia intensiva entre las semanas 1 y 4. dSe debe aplicar vigilancia estándar cada 3 meses. eVigilancia anual de seguimiento durante 5 años, que incluye anamnesis, examen médico, concentraciones de PN y troponinas y ecocardiograma865.
Durante el tratamiento del cáncer con terapias potencialmente cardiotóxicas, se puede monitorizar la función sistólica del VI mediante ecocardiografía. Se debe reconsiderar la quimioterapia e iniciar tratamiento con un IECA y un BB (preferiblemente carvedilol) para los pacientes que desarrollen disfunción sistólica del VI, definida como una reducción absoluta de la FEVI ≥ 10% a < 50%844,861−864. La imagen de strain longitudinal puede detectar la disfunción cardiaca en una fase más temprana865,866. En un estudio prospectivo aleatorizado se comparó una reducción relativa ≥ 12% del strain longitudinal con la disminución de la FEVI en pacientes en riesgo alto sometidos a quimioterapia potencialmente cardiotóxica. Comparado con el tratamiento basado en la FEVI, el basado en el strain longitudinal global llevó a la misma reducción de la FEVI (variable principal), pero con menos pacientes con disfunción cardiaca al final del estudio, lo cual sustenta la utilidad del strain longitudinal global para la detección temprana de la cardiotoxicidad867. También se obtuvieron resultados prometedores para la detección temprana de disfunción cardiaca mediante la monitorización de biomarcadores como PN y troponina868,869. Los pacientes que reciben inmunoterapia con inhibidores de punto de control inmunitario tienen más riesgo de miocarditis. En estos casos, es necesario monitorizar los signos y síntomas relacionados con la terapia, determinar semanalmente la troponina cardiaca durante al menos las primeras 6 semanas desde el comienzo de la terapia y actuar en consecuencia870.
El momento más adecuado para las pruebas de imagen y la determinación de biomarcadores depende del tratamiento anticancerígeno y el perfil de riesgo del paciente (figura 18)865. En general, los pacientes programados para terapias potencialmente cardiotóxicas deben tener una evaluación basal para definir el nivel de riesgo de cardiotoxicidad (bajo, medio o alto) y la intensidad del seguimiento y la monitorización durante y después del tratamiento anticancerígeno865. Los pacientes que sobreviven al cáncer y han estado expuestos a terapias potencialmente cardiotóxicas deben ser monitorizados periódicamente a largo plazo, ya que la IC podría aparecer varios años después del tratamiento anticancerígeno865,871.
Recomendaciones sobre el tratamiento de los pacientes con cáncer e insuficiencia cardiaca.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Se recomienda que los pacientes con cáncer y riesgo aumentado de cardiotoxicidad, definida como antecedente o factores de riesgo de enfermedad CV, cardiotoxicidad previa o exposición a fármacos cardiotóxicos, sean evaluados antes de iniciarse el tratamiento oncológico, preferiblemente por un cardiólogo con experiencia e interés en cardio-oncología | I | C |
| Se debe considerar el tratamiento con un IECA y un bloqueador beta (preferiblemente carvedilol) para los pacientes con cáncer que desarrollan disfunción sistólica del VI, definida como una disminución ≥ 10% de la FEVI y a un valor<50%, durante la quimioterapia con antraciclina861,862 | IIa | B |
| Se debe considerar la evaluación basal del riesgo CV de todos los pacientes con cáncer que van a recibir algún tratamiento oncológico que pueda causar IC846,865 | IIa | C |
CV: cardiovascular; FEVI: fracción de eyección del ventrículo izquierdo; IECA: inhibidor de la enzima de conversión de la angiotensina; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
Las infecciones pueden empeorar los síntomas de IC y ser un factor desencadenante de ICA872,873. La sepsis grave y la neumonía pueden causar daño miocárdico y deprimir la función cardiaca, lo que llevaría a disfunción cardiaca e IC, y este riesgo es mayor para los pacientes con antecedentes de IC873−875. La reciente pandemia por coronavirus (COVID-19) se ha convertido en una de las causas más importantes de morbimortalidad, además de descompensación de la IC873,876−878. Se han publicado pautas específicas para esta entidad879. Las recomendaciones generales relativas a las infecciones se encuentran en la tabla 24.
Según los resultados de estudios observacionales y análisis retrospectivos, la inmunización contra la gripe se asocia con menos riesgo de mortalidad por cualquier causa de los pacientes con IC880−882. Se debe considerar la vacunación de los pacientes con IC contra la gripe y la enfermedad neumocócica, además de la COVID-19, siempre que estén disponibles879,883.
14SITUACIONES ESPECIALES14.1Embarazo14.1.1Embarazo e insuficiencia cardiaca preexistenteLas mujeres con IC preexistente tienen más riesgo de complicaciones cardiovasculares durante el embarazo, incluida la descompensación de la IC. Se debe referir a las pacientes con riesgo moderado o alto (clase III-IV de la clasificación de la OMS modificada) a un centro especializado con un equipo multidisciplinario de cardiología y obstetricia884. En la figura 19 se presenta un algoritmo para el diagnóstico y el tratamiento de las pacientes con IC antes y durante el embarazo.
Tratamiento de las pacientes con insuficiencia cardiaca antes y durante el embarazo. ECG: electrocardiograma; IC: insuficiencia cardiaca; OMSm: clasificación de la Organización Mundial de la Salud modificada. aAsesoramiento sobre anticoncepción y consulta a un especialista de IC cuando se planee una gestación.
Las intervenciones antes del embarazo incluyen la modificación de la medicación para la IC con el objetivo de evitar el daño fetal. Los IECA, ARA-II, INRA y ARM, la ivabradina y los iSGLT2 están contraindicados y se deben suspender antes de la concepción, con estrecha vigilancia clínica y ecocardiográfica. El tratamiento con BB se debe continuar y cambiar a un bloqueador selectivo del receptor adrenérgico β1 (bisoprolol, succinato de metoprolol). Si es necesario, se puede iniciar tratamiento con hidralazina, nitratos orales y metildopa. Para pacientes con IC y FA, se recomienda la anticoagulación terapéutica con HBPM en el primer y el tercer trimestre y AVK con el INR habitual o HBPM durante el segundo trimestre. Se debe evitar los ACOD884.
El examen de las pacientes con IC antes del embarazo o con un nuevo embarazo debe incluir la evaluación clínica (síntomas, examen clínico, PA, SaO2), ECG y ecocardiografía en reposo. Un equipo multidisciplinario formado por cardiólogos, obstetras y anestesiólogos (equipo de cardiología y obstetricia) debe planificar las modalidades de parto alrededor de las 35 semanas. Se deben hacer evaluaciones bimensuales de las mujeres en clase OMS modificada II-III y mensuales para aquellas con IC preexistente en clase OMS modificada III. A las gestantes con IC avanzada (FEVI < 30%, NYHA III-IV) en clase OMS modificada IV se las puede referir a un centro especializado para asesorarlas sobre la posibilidad de interrumpir el embarazo. Un equipo multidisciplinario formado por cardiólogos, obstetras y anestesiólogos debe planificar y tomar decisiones con la paciente sobre las modalidades de parto alrededor de las 35 semanas884.
14.1.2Insuficiencia cardiaca de nueva aparición durante el embarazoEl aumento de la demanda a la función ventricular debido al aumento de volumen circulante y el gasto cardiaco durante el embarazo puede desenmascarar causas preexistentes de IC no diagnosticadas, como miocardiopatías y valvulopatías885. Es más probable que los síntomas aparezcan en el segundo trimestre cuando la demanda por el aumento de gasto cardiaco es mayor. Los episodios graves de estrés emocional durante el embarazo y el parto pueden ocasionar el síndrome de tako-tsubo884,885.
La miocardiopatía periparto se presenta como IC secundaria a disfunción sistólica del VI, normalmente con una FEVI<45%, y ocurre hacia el final del embarazo (tercer trimestre) o en los meses posteriores al parto sin otra causa identificable. La mayoría de los casos de miocardiopatía periparto se diagnostican en el posparto. Su prevalencia varía de 1:100 en Nigeria a 1:1.000 en Sudáfrica y 1:1.500 en Alemania643. En estudios prospectivos de cohortes se observaron mortalidades a los 6 meses del 2,0% en Alemania al 12,6% en una cohorte de 206 pacientes en Sudáfrica643.
La miocardiopatía periparto se presenta frecuentemente con IC aguda, pero también puede ocurrir con arritmias ventriculares y parada cardiaca. Una FEVI<30%, la dilatación del VI, un diámetro telesistólico del VI > 6,0cm y la implicación del VD se asocian con resultados adversos643. La recuperación cardiaca puede ocurrir en los primeros 3-6 meses, pero se puede retrasar hasta 2 años. Las tasas de recuperación varían entre regiones, del 75% a menos del 50%886−888.
El diagnóstico y el tratamiento de las embarazadas que contraen IC dependen del contexto clínico y la gravedad de la presentación. Se recomienda una evaluación cardiaca detallada con ecocardiografía, determinación de PN, ecografía y monitorización fetal. En los casos de IC de nueva aparición o incertidumbre en el diagnóstico, se puede considerar la RMC sin contraste.
Los casos leves se pueden tratar con diuréticos orales, BB, hidralazina y nitratos orales. Las embarazadas que presenten signos de ICA requieren hospitalización urgente. En caso de miocardiopatía periparto que se presenta con IC grave y shock cardiogénico que requiere apoyo inotrópico o vasopresor, se recomienda la derivación de la paciente a un centro especializado en IC con disponibilidad de ECMO, DAVI y trasplante cardiaco. Se debe considerar la cesárea urgente (independientemente del estado de gestación) con ACM inmediatamente disponible. Los fármacos adrenérgicos (dobutamina, adrenalina) pueden ejercer efectos perjudiciales889. Cuando una paciente con miocardiopatía periparto está hemodinámicamente inestable, se puede considerar el tratamiento con levosimendán o ACM. Se puede considerar el implante de un DAVI como puente al tratamiento o puente a la recuperación en los casos de shock cardiogénico refractario643. Para pacientes con miocardiopatía periparto aguda, se ha propuesto la administración de bromocriptina, un inhibidor de la secreción de un fragmento de prolactina de 16kDa que podría contribuir a la fisiopatología de la miocardiopatía periparto. Un estudio aleatorizado de 63 pacientes evaluó el tratamiento con bromocriptina a largo plazo (8 semanas) frente al tratamiento a corto plazo (1 semana). La bromocriptina se asoció con la recuperación de la función del VI, sin diferencias entre los 2 regímenes de tratamiento y en consonancia con los resultados de un registro internacional previo sobre miocardiopatía periparto890,891. Por lo tanto, se puede considerar la bromocriptina para el tratamiento de la miocardiopatía periparto. Si se inicia el tratamiento, se debe tener en cuenta sus efectos adversos, como trombosis venosa profunda y cese de la lactancia, por lo que se debe acompañar con anticoagulación profiláctica o terapéutica.
14.2Miocardiopatías14.2.1Epidemiología y diagnósticoLas miocardiopatías pueden ser heredadas (genética/familiar) y adquiridas. También se pueden acelerar por modificadores de la enfermedad892−894. Constituyen un grupo heterogéneo de enfermedades y son la causa más importante de IC895. La miocardiopatía dilatada (MCD) tiene una prevalencia estimada de 1:250 a 1:500 en la población general, la miocardiopatía hipertrófica (MCH) se sitúa entre 1:500 y 1:5.000 y la miocardiopatía arritmogénica (MCA) se estima que está presente en 1:1.000 a 1:5.000 personas895,896.
Entre las causas directas de las miocardiopatías se incluyen las variantes genéticas patogénicas (mutaciones), toxinas, autoinmunidad, enfermedades de almacenamiento, infecciones y taquiarritmias. Los modificadores de la enfermedad, entidades que pueden agravar o desencadenar una miocardiopatía, incluyen factores epigenéticos y modificadores adquiridos, como el embarazo y la mayoría de las comorbilidades cardiovasculares. Es importante tener presente durante el proceso diagnóstico la interacción entre las causas genéticas y las adquiridas897. La identificación de una causa adquirida de la miocardiopatía no excluye la presencia de una variante genética patogénica, mientras que esta requiere una causa adquirida o un modificador de la enfermedad para manifestarse clínicamente. Las causas y modificadores de la enfermedad más frecuentes se resumen en la tabla 25.
Posibles causas y modificadores de la enfermedad de las miocardiopatías más frecuentes.
| Causa | Modificador de la enfermedad | Fenotipo | |
|---|---|---|---|
| Mutaciones genéticas | |||
| LMNA | x | MCD | |
| TTN | x | x | MCD, (MCH) |
| ARM20 | x | MCD | |
| MYH7 | x | MCD, MCH | |
| MYPC | x | MCD, MCH | |
| TnT | x | MCD, MCH | |
| PLN | x | MCD, MCH, MCA | |
| DSP | x | x | MCA, MCD, miocarditis |
| SCxN5a | x | x | MCA, (MCD) |
| Tropomiosina 1 | x | MCD | |
| Hemocromatosis (gen HFE, C282Y) | x | MCH, MCD | |
| Galactosidasa A (enfermedad de Fabry) | x | MCH | |
| Alteraciones neuromusculares | |||
| Distrofia muscular de Duchenne, distrofia muscular de Becker, distrofia miotónica | x | MCD | |
| Trastornos sindrómicos | |||
| Mutaciones mitocondriales ligadas a X | x | MCD | |
| Enfermedades adquiridas | |||
| Infección (virus) | x | x | Miocarditis, MCD |
| Enfermedades inmunomediadas (artritis reumatoide, lupus eritematoso sistémico, dermatomiositis) | x | x | Miocarditis, MCD |
| Tóxica (alcohol, anfetaminas, cocaína) | x | x | MCD, miocarditis |
| Fármacos (antraciclinas, trastuzumab, inhibidores de punto de control inmunitario) | x | x | MCD, miocarditis |
| Sobrecarga (hemocromatosis) | x | x | MCH, MCD |
| Periparto (embarazo) | x | x | MCD |
| Comorbilidades con posibles interacciones con mutaciones genéticas y efectos en el fenotipo y los resultados | |||
| Taquiarritmias | x | x | MCD |
| Diabetes mellitus | x | x | MCD, MDH |
| Hipertensión | x | x | MCD, MDH |
| Hipotiroidismo e hipertiroidismo | x | MCD, MDH, miocarditis | |
DSP: desmoplaquina; LMNA: lámina A y C; MCA: miocardiopatía arritmogénica; MCD: miocardiopatía dilatada; MCH: miocardiopatía hipertrófica; MYH7: gen de la cadena pesada de miosina; MYPC: proteína C de unión a la miosina; PLN: fosfolambán; SCN5a: subunidad alfa del canal de sodio cardiaco 5; TnT: troponina T; TTN: titina.
Los componentes clave del proceso diagnóstico de los pacientes con IC y miocardiopatía se recogen en la tabla 26892,894,895,898,899. Los aspectos específicos del diagnóstico y el tratamiento se resumen en las tablas 27-29. La anamnesis, las pruebas de laboratorio y las pruebas de imagen son los medios diagnósticos de primera línea. La ecocardiografía es esencial para el diagnóstico y la monitorización de la miocardiopatía hipertrófica, dilatada y arritmogénica. La RMC proporciona información morfológica y pronóstica más detallada y se debe hacer en la fase inicial. La prevalencia de las mutaciones genéticas varía según el fenotipo morfológico o la causa adquirida subyacente. Las mutaciones genéticas ocurren en alrededor del 40% de las MCD, el 60% de las MCH y el 15% de las miocardiopatías inducidas por quimioterapia, alcohólicas o periparto895,898,900−905. La prevalencia de las mutaciones genéticas es superior al 10% en la MCD no familiar898,906. La detección de una variante genética patogénica en los pacientes con miocardiopatía permite predecir mejor la progresión y los resultados de la enfermedad, puede contribuir a la indicación de implante de un dispositivo y al asesoramiento genético para las familias.
Evaluación diagnóstica inicial de los pacientes con sospecha de miocardiopatía.
| Anamnesis que incluya preguntas detalladas sobre enfermedades sistémicas, agentes tóxicos (quimioterapia, alcohol, drogas) e historia familiar de enfermedad cardiaca o neuromuscular o muerte súbita cardiaca de familiares a una edad joven (< 50 años) |
| Pruebas de laboratorio, incluidas enzimas cardiacas y musculares, función hepática y renal, hemoglobina, recuento leucocitario (con recuento diferencial de leucocitos para detectar eosinofilia), péptidos natriuréticos, función tiroidea, estado del hierro y marcadores de enfermedad autoinmunitaria sistémica (PCR-as, anticuerpos antinucleares, receptores, receptores solubles de IL-2) |
| ECG estándar de 12 derivaciones y ecocardiografía para detectar arritmias y evaluar la estructura y la función cardiacas y alteraciones concomitantes |
| Coronariografía invasiva o angio-TC para descartar EC significativa en pacientes con disfunción cardiaca |
| RMC con secuenciación en T1 y T2 y RTG para visualizar cambios estructurales, depósito, infiltración, inflamación, fibrosis y tejido cicatricial |
| Asesoramiento y pruebas genéticas dependiendo de la edad, la historia familiar y el fenotipo cardiaco |
| ECG ambulatorio durante 24 o 48 h para detectar arritmias auriculares y ventriculares |
EC: enfermedad coronaria; ECG: electrocardiograma; IL-2: interleucina 2; PCR-as: proteína C reactiva de alta sensibilidad; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
Miocardiopatía dilatada o miocardiopatía hipocinética no dilatada: aspectos específicos del diagnóstico y el tratamiento.
| Criterios diagnósticos y definiciones894,895 |
| MCD: dilatación del VI y disfunción sistólica en ausencia de condiciones de carga anormales conocidas o EAC significativaMiocardiopatía hipocinética no dilatada (MCHND): disfunción VI o biventricular global (FEVI<45%) sin dilatación, en ausencia de condiciones de carga anormales conocidas o EAC significativaLa MCD y la MCHND se consideran «familiares» si uno o más familiares de primer o segundo grado tienen estas enfermedades, o si un familiar de primer grado tuvo MCD confirmada en la autopsia y muerte súbita antes de los 50 años de edad |
| Asesoramiento y pruebas genéticas892,894,898,916 |
| Indicación. Todos los pacientes con diagnóstico de MCD o MCHND y adultos familiares de primer grado de estos pacientes y una mutación patogenética, independientemente de su fenotipo, para identificar a los individuos afectados genéticamente en una fase preclínicaLos adultos familiares de primer grado deben repetir la evaluación cada 5 años o antes si tienen menos de 50 años o se encuentran alteraciones no diagnósticasSe debe realizar una evaluación clínica, ECG, ecocardiografía y posiblemente RMC a todos los familiares de primer grado de los pacientesLos resultados pueden identificar a los pacientes con MCD o MCHND y riesgo muy alto de arritmias o que requieren otros tratamientos específicosLa identificación temprana de familiares asintomáticos puede facilitar el tratamiento precoz y la prevención de la progresión de la IC, además del asesoramiento genético apropiadoPanel mínimo de genesa: TTN, LMNA, MHC, TnT, troponina-C, MYPC, ARM20, PLN, subunidad alfa del canal de sodio, BAG3, actina alfa del músculo cardiaco, nexilina, tropomiosina-1, vinculinaSe podría considerar otras secuencias adicionales para el análisis de un conjunto muy grande de genes cuando haya una historia familiar clara o un fenotipo estructural, preferiblemente combinado con segregación familiar |
| Biopsia endomiocárdica97,907,917-919 |
| Indicación. Si hay sospecha de fenotipos que requieren tratamientos específicos (miocarditis de células gigantes, miocarditis eosinofílica, sarcoidosis, vasculitis, LES, otras enfermedades sistémicas, autoinmunitarias, inflamatorias o de depósito)Número de muestras. Un mínimo de 5, pero posiblemente al menos 7 muestras: 3 para patología, 2 para infección (ADN, RCP) y 2 para ADN/replicación viral918,919Etiología. Detección de virus cardiotrópicos comunes (parvovirus B19, HHV4, HHV6, enterovirus, adenovirus y Coxsackie) mediante RCPti cuando se sospeche etiología viralSe debe evaluar, si es posible, el ARBm viral para la replicación viral activaOtras pruebas cuando estén indicadas: CMV, VIH, Borrelia burgdorferi (enfermedad de Lyme), Coxiella burnetii (fiebre Q), Trypanosoma cruzi (enfermedad de Chagas) y SARS-CoV-2Análisis inmunohistoquímico. Cuantificación de linfocitos por tinción con CD3, CD4, CD8 o CD45 y macrófagos CD68 por mm2; anti-HLA-DRHistología. Tinción de hematoxilina-eosina, evaluación de la fibrosis por tinción tricrómica de Masson y rojo picrosirio, detección de fibrillas amiloides con rojo Congo |
| Opciones terapéuticas895,917 |
| Tratamiento de la IC-FEr (véase las secciones 5 y 6) |
| Mutación de LMNA, ARN20, PLN y FLN. Riesgo más alto de muerte súbita: se debe considerar la prevención primaria temprana con implante de DAI (según los factores de riesgob)920 |
| Mutación de TTN. Tasa más alta de remodelado inverso del VI (en hasta el 70%), pero con riesgo más alto de taquiarritmias auriculares y ventriculares |
| Enfermedad de Lyme (Borrelia). Tratamiento con doxiciclina |
| Enfermedad de Chagas (T. cruzi). Tratamiento específico según las recomendaciones actuales921,922 |
| Enfermedades autoinmunitarias/inflamatorias. Considere el tratamiento inmunosupresor en la miocarditis de células gigantes, miocarditis eosinofílica, sarcoidosis o vasculitis, y para pacientes muy seleccionados con inflamación cardiaca de origen desconocido según la evaluación de un equipo multidisciplinar (cardiología e inmunología) |
ADN: ácido desoxirribonucleico; ARM 20: ácido ribonucleico de unión al motivo 20; ARN: ácido ribonucleico; ARNm: ácido ribonucleico mensajero; BAG3: atanogén 3 asociado a Bcl2; CMV: citomegalovirus; DAI: desfibrilador automático implantable; EC: enfermedad coronaria; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; FLN: filamina; HHV: virus del herpes humano; HLA-DR: antígenos leucocitarios humanos, isotipo DR; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; LES: lupus eritematoso sistémico; LMNA: lámina A y C; MCD: miocardiopatía dilatada; MCHND: miocardiopatía hipocinética no dilatada; MHC: cadena pesada de miosina; MYPC: proteína C de unión a la miosina; PLN: fosfolambán; RCP: reacción en cadena de la polimerasa; RCPti: reacción en cadena de la polimerasa con transcriptasa inversa; RMC: resonancia magnética cardiaca; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; TnT: troponina T; TTN: titina; TVNM: taquicardia ventricular no mantenida; VI: ventrículo izquierdo; VIH: virus de la inmunodeficiencia humana.
aEsta lista de genes no es exhaustiva e irá cambiando según se tenga más conocimiento sobre la patogénesis. Contacte con el departamento de genética para consultar el panel de genes que utilizan.
bFactores de riesgo de los pacientes con mutación de LMNA: TVNM durante ECG ambulatorio, FEVI<45% en la primera evaluación, sexo masculino y mutaciones no antisentido (inserción, supresión, truncamiento o mutaciones que afectan al splicing).
Miocardiopatía hipertrófica: aspectos específicos del diagnóstico y el tratamiento.
| Definición895,896,923 |
| Un grosor de la pared>14mm en uno o más segmentos miocárdicos del VI que no se explica solo por las condiciones anormales de cargaUna obstrucción del TSVI ≥ 30mmHg en reposo o durante el ejercicio, hipertrofia asimétrica o un aumento de RTG con patrón parcheado en la pared media del segmento más atrofiado son indicadores adicionales de MCHSe puede considerar familiar cuando se confirma la MCH en 2 o más familiares de primer o segundo grado o cuando se confirma la MCH en autopsia y muerte súbita antes de los 50 años de edad de un familiar de primer grado |
| Diagnóstico diferencial |
| Puede resultar complejo en la hipertrofia fisiológica inducida por entrenamiento atlético intenso, hipertensión grave o estenosis aórtica y en la hipertrofia septal aislada. Se considera MCH genética si la hipertrofia del VI es desproporcionada con respecto al factor desencadenante adquiridoConsidere la amiloidosis una causa posible si se detecta un aumento del grosor del septo interauricular, las válvulas AV o la pared libre del VD (véase la sección 14.6) |
| Asesoramiento y pruebas genéticas |
| Indicación. Se debe ofrecer a los pacientes con diagnóstico de MCH para identificar una posible causa genética subyacente y a los familiares adultos de primer grado de los pacientes con MCH y una mutación patogénica, independientemente del fenotipo, con el objetivo de identificar en una fase preclínica a los individuos afectadosSe debe realizar una evaluación clínica, ECG y ecocardiografía a los familiares de primer grado que tengan la misma mutación patogénica que el pacienteCuando no se identifiquen mutaciones genéticas en el paciente o si no se realizan pruebas genéticas, se debe considerar la evaluación clínica con ECG y ecocardiografía para los adultos familiares de primer grado, que se repetirá cada 2-5 años o antes si se detectan anomalías no diagnósticasPanel mínimo de genesa (la mutación de genes sarcoméricos se detecta en alrededor del 60% de los casos): TTN, LMNA, MHC, TnT, troponina-C, MYPC, ARM20, PLN, subunidad alfa del canal de sodio, BAG3, actina alfa del músculo cardiaco, nexilina, tropomiosina-1 y vinculina898,924-926Podrían considerarse secuencias adicionales para el análisis de un conjunto muy grande de genes cuando haya una historia familiar clara o un fenotipo estructural, preferiblemente combinado con segregación familiar.Entidades específicasMiastenia: considere la presencia de mutaciones mitocondriales ligadas a X, alteraciones del depósito de glucógeno, mutaciones de FHLI, ataxia de FriedreichEntidades sindrómicas (deterioro cognitivo o visual, ptosis palpebral): considere la presencia de mutaciones mitocondriales ligadas a X, síndrome de Noonan, enfermedad de DanonLentigos extendidos: considere los síndromes de Leopard o Noonan |
| Biopsia endomiocárdica |
| Indicación. Se puede considerar cuando la evaluación clínica basal indica inflamación cardiaca o enfermedad de depósito que no se puede diagnosticar por otros medios896 (véase la sección 14.6) |
| Opciones terapéuticas895,896,923 |
| Obstrucción del TSVIEvite la hipovolemia (deshidratación), los dilatadores arteriales y venosos (nitratos e inhibidores de la fosfodiesterasa 5) y la digoxina.Administre bloqueadores beta no vasodilatadores o verapamilo si los bloqueadores beta no se toleran o no son eficacesLos diuréticos del asa o las tiacidas deben administrarse con precaución y a dosis bajas para mejorar la disnea asociada con la obstrucción del TSVI, pero evitando la hipovolemiaSe puede considerar el tratamiento invasivo (reducción septal mediante ablación con alcohol o miomectomía) en centros con experiencia para los pacientes con un TSVI en reposo o máximo provocado ≥ 50mmHg que siguen sintomáticos (NYHA III-IV o síncope) pese al TMOPueden considerarse nuevos fármacos y dispositivos cuando estén disponibles909,927 |
| Pacientes sintomáticos sin obstrucción del TSVIUso cauteloso de diuréticos del asa o tiacidas a dosis bajas para evitar la hipovolemiaEl verapamilo y el diltiazem con una FEVI > 50% y los bloqueadores beta no se toleran o no son eficaces |
| Indicación de DAIBasada en modelos de riesgo de muerte súbita cardiaca928-930Considere el implante de DAI en caso de:• Historia familiar de muerte súbita de uno o más familiares de primer grado antes de los 40 años de edad o muerte súbita a cualquier edad de un familiar de primer grado con MCH confirmada• Taquicardia ventricular no sostenida• Síncope por causas desconocidas931 |
| Enfermedad de FabryTerapia de reemplazo enzimático (déficit de alfagalactosidasa A)895 |
| Amiloidosis. Véase la sección 14.6 y la Figure 21 |
ARM20: ácido ribonucleico de unión al motivo 20; AV: auriculoventricular; BAG3: atanogén 3 asociado a Bcl2; DAI: desfibrilador automático implantable; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; LMNA: lámina A y C; MCH: miocardiopatía hipertrófica; MHC: cadena pesada de miosina; MYPC: proteína C de unión a la miosina; NYHA: clase funcional de la New York Heart Association; PLN: fosfolambán; RTG: realce tardío de gadolinio; TMO: tratamiento médico óptimo; TnT: troponina T; TSVI: tracto de salida del ventrículo izquierdo; TTN: titina; VD: ventrículo derecho; VI: ventrículo izquierdo.
aEsta lista de genes no es exhaustiva e irá cambiando según se tenga más conocimiento sobre la patogénesis. Contacte con el departamento de genética para consultar qué panel de genes utilizan.
Miocardiopatía arritmogénica: aspectos específicos del diagnóstico y el tratamiento912,915,932.
| Definición |
| Enfermedad hereditaria del músculo cardiaco caracterizada por la progresiva sustitución fibrograsa del miocardio del VD que puede actuar como sustrato de arritmias ventriculares, síncope de origen desconocido o muerte súbita cardiacaEn más del 30% de los pacientes con MCA está implicado el VI y hay disfunción sistólica, por lo que su fenotipo se puede solapar con la MCD |
| Diagnóstico933 |
| Se basa en la evaluación de una combinación de factores genéticos (mayormente mutaciones en genes desmosomales con patrón autosómico dominante), arritmias ventriculares documentadas y criterios de imagen (ecocardiografía y RMC) de displasia del VD con sustitución fibrograsa, confirmada mediante BEM o no. Las alteraciones electrocardiográficas específicas pueden estar presentes o ausentes |
| Asesoramiento y pruebas genéticas898,912 |
| Indicación. Se debe ofrecer a los pacientes con sospecha de MCA y a los familiares adultos de primer grado de los pacientes con MCA y una mutación patogénica, independientemente del fenotipo, con el objetivo de identificar en una fase preclínica a los individuos afectadosEl cribado genético familiar puede estar indicado para la estratificación del riesgo de arritmiasSe debe realizar una evaluación clínica, ECG, ecocardiografía y posiblemente RMC a los familiares de primer grado que tengan la misma mutación patogénica que el pacienteCuando no se identifican mutaciones genéticas en el paciente o si no se realizan pruebas genéticas, se debe considerar la evaluación clínica con ECG y ecocardiografía para los familiares de primer grado adultos, que se repetirá cada 2-5 años o antes si se detectan anomalías no diagnósticas |
| Panel mínimo de genes:Genes desmosomales, fundamentalmente en caso de afección aislada del VD: placoglobina, DSP, PKP2, DSG2 y DSC2aCon afección del VI/MCD frecuente: DSP, FLNC, SCN5A, TMEM43, FLN, LDB3, desmina, actinina alfa, BAG3, NKX2-5, ARN20, SCN5A, KCNQ1, KCNH2, TRPM4 o variantes de PLN en particularEn caso de hipertrofia leve del VI: considere variantes de la TnTAnomalías cutáneas, hiperqueratosis palmar y plantar: considere mutaciones recesivas raras que causan el síndrome de Carvajal y la enfermedad de Naxos. Placoglobina (JUP)Si se detecta miocarditis y MCA mediante RMC: considere variantes del gen DSP934,935 |
| Biopsia endomiocárdica |
| Se debe reservar para pacientes muy seleccionados tras la evaluación de los resultados de pruebas no invasivas. La sustitución fibrograsa con o sin sustitución fibrótica en la biopsia son los hallazgos característicos. La BEM tiene poca sensibilidad para el diagnóstico de MCA en los casos de distribución focal |
| Opciones terapéuticas |
| Tratamiento para la IC-FEr (véase las secciones 5 y 6)Se debe evitar los deportes de competición y limitar el ejercicio a actividades de ocio936Pacientes con arritmias ventriculares: el tratamiento con bloqueadores beta debe aumentarse hasta la dosis máxima tolerada como tratamiento de primera línea. Se puede considerar la administración de amiodarona además de bloqueadores beta o cuando estos estén contraindicados o no se toleren. El implante de un DAI está indicado en caso de antecedente de muerte súbita recuperada o taquicardia ventricular sostenida o hemodinámicamente mal tolerada910-912Pacientes sin arritmias ventriculares: se puede considerar el implante de un DAI (véase la sección 6.1), incluso en pacientes con mutaciones de los genes LMNA o FLNC y FEVI < 45%912 |
ARM20: ácido ribonucleico de unión al motivo 20; BAG3: atanogén 3 asociado a Bcl2; BEM: biopsia endomiocárdica; DAI: desfibrilador automático implantable; DSC2: desmocolina 2; DSG2: desmogleína 2; DSP: desmoplaquina; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; FLN: filamina; FLNC: filamina C; IC: insuficiencia cardiaca; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; JUP: placoglobina de unión; KCNH2: canales de potasio activados por voltaje, subfamilia H, miembro 2; KCNQ1: canales de potasio activados por voltaje, subfamilia Q, miembro 1; LDB3: proteína de unión al dominio 3 de LIM; LMNA: lámina A y C; MCA: miocardiopatía arritmogénica; MCD: miocardiopatía dilatada; NKX2-5: factor de transcripción relacionado con NK2.5; PKP2: placofilina 2; PLN: fosfolambán; RMC: resonancia magnética cardiaca; SCN5a: subunidad alfa del canal de sodio cardiaco 5; TMEM43: proteína transmembrana 43; TnT: troponina T; TRPM4: receptor de potencial transitorio de subfamilia M, miembro 4; VD: ventrículo derecho; VI: ventrículo izquierdo.
La biopsia endomiocárdica (BEM) con cuantificación inmunohistoquímica de células inflamatorias sigue siendo la prueba estándar para la identificación de la inflamación cardiaca. Permite confirmar el diagnóstico de enfermedad autoinmunitaria de los pacientes con MCD y sospecha de miocarditis de células gigantes, miocarditis eosinofílica, vasculitis y sarcoidosis893,907. También puede ayudar en el diagnóstico de enfermedades de depósito, incluidas la amiloidosis y la enfermedad de Fabry, cuando las pruebas genéticas o de imagen no permiten establecer un diagnóstico definitivo (véase también la sección 14.6). Asimismo, se puede considerar la BEM en la MCH si no se puede identificar causas genéticas o adquiridas. Se debe sopesar los riesgos y beneficios de la BEM y el procedimiento debe reservarse para situaciones específicas en las que los resultados de la prueba puedan afectar al tratamiento.
14.2.2TratamientoEl tratamiento farmacológico actual de los pacientes con IC y miocardiopatía dilatada, hipertrófica o arritmogénica no es diferente del tratamiento general de la IC, con la excepción de algunos aspectos peculiares que se resumen en las tablas 27-29. El estudio piloto TRED-HF evaluó la posibilidad de suspender el tratamiento farmacológico a los pacientes con MCD no isquémica que tuvieron una recuperación parcial o total de la FEVI (> 40%). En los primeros 6 meses, se observó recidiva de la MCD en el 44% de los pacientes y un remodelado rápido del VI con cambios tisulares y funcionales tempranos incluso en los pacientes en que no recidivó271,908.
En un estudio de fase 3 aleatorizado a doble ciego y controlado con placebo (EXPLORER-HCM), el tratamiento con mavacamtén mejoró la capacidad de ejercicio, la obstrucción del tracto de salida del VI, la clase funcional (NYHA) y el estado clínico de los pacientes con MCH obstructiva. Estos resultados ofrecen la posibilidad de un tratamiento específico para las miocardiopatías hereditarias909.
Se debe considerar el implante de un DAI para los pacientes con MCD, MCH o miocardiopatía arritmogénica (véase la sección 6)895,910−912. La fuerza de la indicación varía según los factores de riesgo de muerte súbita, con mayor prioridad para los pacientes con un realce tardío de gadolinio (RTG) significativo en la RMC, pacientes más jóvenes o con un fenotipo familiar/genético específico (tablas 27-29).
Los modelos de riesgo para la predicción de los beneficios del DAI que se aplicaron a los pacientes reclutados en el estudio DANISH podrían ayudar a establecer la indicación de DAI para los pacientes con MCD166,913. El tratamiento de la MCH y la miocardiopatía arritmogénica, incluidas las indicaciones de DAI, se describe en documentos publicados anteriormente895,896,899,912,914,915.
14.3Ventrículo izquierdo no compactadoEl ventrículo izquierdo no compactado (VINC) es una miocardiopatía congénita poco frecuente que se caracteriza por trabeculaciones endomiocárdicas que aumentan en número y prominencia. En la mayoría de los casos, incluidos los causados por mutaciones de los genes MYH7 o MYBPC3, el VINC es hereditario con un patrón autosómico dominante644,937,938. Existe un solapamiento claro en las familias con fenotipo de MCD y MCH. Con bastante frecuencia, se encuentran individuos con características de VINC en familias con miembros afectos que presentan MCH o MCD típicas. Por lo tanto, el VINC no se trata como una enfermedad separada, si no como una presentación rara de susceptibilidad genética a MCH o MCD939.
14.4Enfermedad auricular14.4.1DefiniciónLa enfermedad auricular, también denominada insuficiencia o miopatía auricular, se puede definir como un conjunto de cambios estructurales, electrofisiológicos y funcionales subclínicos que pueden tener consecuencias clínicas606,940,941. Se ha señalado que la enfermedad auricular une la IC (especialmente la IC-FEc) con la FA, ya que normalmente coexisten, están estrechamente relacionadas y comparten factores de riesgo606,685,942,943.
14.4.2DiagnósticoSe puede evaluar el tamaño y la función auriculares mediante distintas modalidades de imagen, como ecocardiografía bidimensional o tridimensional, deformación miocárdica, TC y RMC944. Los biomarcadores cardiacos, como troponinas cardiacas de alta sensibilidad y PN, aportan información sobre aspectos fisiopatológicos de la enfermedad auricular945−947. Las altas concentraciones de PN en la FA también pueden indicar enfermedad auricular subyacente942,948. Hasta ahora no se ha llevado a cabo una caracterización exhaustiva de los factores clínicos, de imagen, bioquímicos y moleculares de la enfermedad auricular.
14.4.3TratamientoLa enfermedad auricular es un nuevo objetivo terapéutico para la prevención de la FA, la tromboembolia sistémica y, quizá, la IC-FEc949. La enfermedad auricular parece resultar de factores de riesgo y comorbilidades compartidas que predisponen tanto a la FA como a la IC, por lo que la diabetes mellitus, la hipertensión, la obesidad, el tabaquismo y la inactividad física son de suma importancia para su desarrollo7,950.
El tratamiento efectivo de la IC y la FA (véase la sección 12.1.1), además del tratamiento de la insuficiencia mitral (véase la sección 12.3.3), también contribuyen a contrarrestar la progresión de la enfermedad auricular.
14.5Miocarditis14.5.1Epidemiología y diagnósticoLa incidencia mundial de la miocarditis aguda se estima en 1,5 millones de casos anuales951. La contribución de la miocarditis como causa de la IC varía según la edad y las regiones geográficas desde aproximadamente el 0,5 al 4,0%918,952. La inflamación crónica documentada por biopsia endomiocárdica se puede encontrar en un 9-30% de los pacientes adultos con MCD918,953. Las etiologías más frecuentes que desencadenan la miocarditis aguda en Europa se resumen en la tabla 30.
Etiologías que pueden desencadenar miocarditis aguda para tener en cuenta917.
| Infecciosa | |
| Viral | Parvovirus B19, virus de herpes humano 6, virus de Epstein-Barr, enterovirus (Coxsackie, adenovirus), CMV, VIH, SARS-CoV-2 |
| Otros | Borrelia, Coxiella burnetii (fiebre Q) |
| Enfermedad sistémica | |
| Autoinmunitaria y otras | Sarcoidosis, miocarditis de células gigantes, miocarditis eosinofílica, LES, vasculitis con ANCA positiva, artritis reumatoide y otras enfermedades autoinmunitarias |
| Tóxica | |
| Medicación | Inhibidores de punto de control inmunitario, antraciclinas, clozapina, fármacos adrenérgicos, fluorouracilo 5 |
| Otros agentes | Alcohol, anfetaminas, cocaína |
ANCA: anticuerpos anticitoplasma de neutrófilos; CMV: citomegalovirus; LES: lupus eritematoso sistémico; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; VIH: virus de la inmunodeficiencia humana.
La presentación clínica de la miocarditis aguda puede abarcar desde síntomas leves a shock cardiogénico. El proceso diagnóstico de la miocarditis aguda en pacientes con IC se resume en la tabla 31 y la figura 20. Los criterios específicos para la biopsia y la RMC se encuentran en las tablas 32 y 33.
Proceso diagnóstico en caso de sospecha de miocarditis aguda.
| Definición de sospecha de miocarditis aguda | |||
| Presentación clínica y una o más pruebas diagnósticas obligatorias con resultados positivos (preferiblemente RMC), en ausencia de EC, valvulopatía o cardiopatía congénita significativas u otras causas | |||
| Sensibilidad | Especificidad | ||
| Presentación clínica | |||
| Dolor torácido agudo/de nueva presentación, disnea, signos de IC izquierda o derecha, arritmias no explicadas o muerte súbita recuperada | Baja | Baja | |
| Pruebas diagnósticas obligatorias | |||
| ECG | Alteraciones nuevas y dinámicas en ST-T, incluida la elevación del segmento ST en seudoinfarto, arritmias auriculares o ventriculares, bloqueos AV y alteraciones del QRS | Alta | Baja |
| Pruebas de laboratorio | Troponinas elevadas con cambios dinámicos compatibles con necrosis miocárdicaAnálisis estándar, incluido recuento leucocitario para descartar eosinofilia919,954 | Intermedia | Baja |
| Ecocardiografía | Nuevas anomalías estructurales o funcionales, anomalías de la movilidad de la pared regional o disfunción ventricular general sin dilatación ventricular o con dilatación leve, aumento del grosor parietal debido a edema miocárdico, derrame pericárdico o trombos intracardiacos no relacionados con otras enfermedades (p. ej., EC, SCA o valvulopatía) | Alta | Baja |
| RMC | Detección de edema, inflamación y fibrosis, cuantificación y localización mediante mapeo en T1 y T2, evaluación del volumen extracelular y RTG (véase la Table 33)955,956 | Alta | Intermedia |
| Pruebas diagnósticas adicionales | |||
| Coronariografía o angio-TC | Excluye la EC o los SCA significativos en caso de sospecha clínica de miocarditis | Alta | Alta |
| Biopsia endomiocárdica | Diagnóstico e indicación de tratamiento específico (véase la Table 32) | Intermedia | Alta |
| PET cardiaca | Puede ser útil en pacientes que no pueden someterse a RMC o con sospecha de enfermedad autoinmunitaria o sarcoidosis cardiaca919,957 | Baja | Baja |
| [2,0]Pruebas de laboratorio adicionales | Enzimas de músculo esquelético, función hepática y renal, péptidos natriuréticos, función tiroidea, estado del hierro, marcadores de enfermedad sistémica autoinmunitaria | Baja | Baja |
| PCR elevada en el 80-90% de los pacientes919,954 | Intermedia | Baja | |
| Determinación por RCP de virus cardiotrópicos comunes. Puede detectar la infección sistémica, pero no puede probar la infección cardiaca ni sustituir el análisis genómico viral en muestras de BEM917Los anticuerpos IgG circulantes contra virus cardiotropos son comunes en ausencia de miocarditis viralUtilidad diagnóstica muy limitada917,918Pruebas específicas para SARS-CoV-2, Borrelia, VIH o CMV en caso de sospecha clínica | Baja | Baja | |
AV: auriculoventricular; BEM: biopsia endomiocárdica; CMV: citomegalovirus; EC: enfermedad coronaria; ECG: electrocardiograma; IC: insuficiencia cardiaca; IgG: immunoglobulina G; PCR: proteína C reactiva; PET: tomografía por emisión de positrones; QRS: ondas Q, R y S en el ECG; RCP: reacción en cadena de la polimerasa; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; SCA: síndrome coronario agudo; ST-T: segmento ST y onda T en el electrocardiograma; ST: segmento ST en el electrocardiograma; VIH: virus de la inmunodeficiencia humana.
Biopsia endomiocárdica para pacientes con sospecha de miocarditis.
| Indicación (véase también la sección 4.3)Disfunción cardiaca grave, progresiva o persistente o arritmias ventriculares potencialmente mortales o bloqueo AV de tipo Mobitz 2 de segundo grado o mayor cuando no se espera una respuesta a corto plazo (< 1-2 semanas) al tratamiento médico habitualEl objetivo es identificar la etiología e indicar el tratamiento específico (p. ej., miocarditis de células gigantes, miocarditis eosinofílica, sarcoidosis cardiaca, trastornos sistémicos inflamatorios)97,98,917,918,958 |
| Número y zona de obtención de las muestrasUn mínimo de 5, pero posiblemente al menos 7 muestras: 3 para patología, 2 para infecciones (ADN, RCP) y 2 para virus del ADN/reproducción viral. Ventrículo izquierdo y/o derecho. Se puede considerar la RMC o la PET para guiar la obtención de muestras919 |
| EtiologíaAnálisis genómico cuantitativo viral de la RCP para virus cardiotrópicos comunes (parvovirus B19, HHV4, HHV6, enterovirus, adenovirus y Coxsackie) mediante RCP-tiSe puede determinar el ARMm viral para la reproducción viral activa, aunque tiene una sensibilidad bajaSi está indicado, evalúe la presencia de CMV, VIH, Borrelia, Coxiella burnetii (fiebre Q) y SARS-CoV-2 |
| Diagnóstico de inflamaciónAnálisis inmunohistoquímico con tinción de anticuerpos anti-CD3, CD4, CD8 o CD45 para linfocitos y anticuerpos anti-CD68 para macrófagos y anticuerpos anti-HLA-DR907,917,918,959 |
| Implicaciones terapéuticasTratamiento inmunosupresor. Puede estar indicado con base en los resultados de la BEM, p. ej., en la miocarditis de células gigantes o en la miocarditis eosinofílica, pero posiblemente también en la sarcoidosis o la vasculitis o para pacientes seleccionados con inflamación cardiaca significativa de origen desconocido, según la valoración de un equipo multidisciplinario98,917-919,954Tratamiento antibiótico: Borrelia (enfermedad de Lyme)Tratamiento antiviral: VIH, CMV, HHV6 dependiendo de la carga y la reproducción viral (ARNm) |
ADN: ácido desoxirribonucleico; ARNm: ácido ribonucleico mensajero; BEM: biopsia endomiocárdica; CMV: citomegalovirus; HHV: virus de herpes humano; HLA-DR: antígenos leucocitarios humanos, isotipo DR; PET: tomografía por emisión de positrones; RCP: reacción en cadena de la polimerasa; RCPti: reacción en cadena de la polimerasa con transcriptasa inversa; RMC: resonancia magnética cardiaca; SARS-CoV-2: coronavirus 2 del síndrome respiratorio agudo grave; VIH: virus de la inmunodeficiencia humana.
Resonancia magnética cardiaca para pacientes con sospecha de miocarditis955,956.
| IndicaciónEstá indicada en la fase basal para pacientes con historia clínica+ECG, troponina elevada o anomalías ecocardiográficas y EC significativa descartada o poco probableEs recomendable para el seguimiento de los pacientes con disfunción persistente en la ecocardiografía, arritmias o anomalías en el ECGa |
| Hallazgos más importantesBasales: imágenes ponderadas en T1 (inflamación, daño) y T2 (edema), volumen extracelular y RTG en las 2 primeras semanas tras la presentación de los síntomas956,960En el seguimiento: RTG para evaluar el grado de cicatrización, mapeo en T1 y T2 para identificar la inflamación persistentea |
| Relevancia diagnósticaAl menos un criterio con base en T2 (aumento global o regional del tiempo de relajación miocárdica en T2 o un aumento de la intensidad de la señal de las imágenes ponderadas en T2), con al menos un criterio con base en T1 (aumento del T1 miocárdico, volumen extracelular o RTG) en la fase agudaLa presencia de un solo marcador (enT2 o T1) podría sustentar el diagnóstico de inflamación miocárdica aguda en un contexto clínico compatible, aunque su especificidad es menor en la fase agudaUn estudio T1/T2 negativo no excluye un proceso inflamatorio en marcha durante la fase agudaa |
EC: enfermedad coronaria; ECG: electrocardiograma; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio.
aSuelen ser necesarios como mínimo 3 meses para que desaparezcan de la RMC los signos de edema (secundario a inflamación en la fase aguda o basal). A los 6 meses, los signos de edema en T1 o T2 deberían haber desaparecido si la inflamación se ha revertido completamente. No obstante, la ausencia de signos de edema en T1 o T2 no descarta una posible inflamación crónica de baja intensidad.
Tratamiento de los pacientes con insuficiencia cardiaca y miocarditis aguda. ACM: asistencia circulatoria mecánica; BEM: biopsia endomiocárdica; EC: enfermedad coronaria; ECG: electrocardiograma; IC: insuficiencia cardiaca; RMC: resonancia magnética cardiaca; SCA: síndrome coronario agudo; TC: tomografía computarizada. aPara descartar EC/SCA.
Puede ser útil hospitalizar al menos 48 h a los pacientes con miocarditis aguda e IC, especialmente en caso de concentraciones elevadas de troponinas y disfunción cardiaca o arritmias en la presentación inicial.
Aunque no hay pruebas suficientes en el contexto específico de la miocarditis aguda, en caso de disfunción sistólica del VI se recomienda el tratamiento para la IC-FEr. El tratamiento inmunosupresor solo está indicado en casos seleccionados de miocarditis aguda (tabla 34). Una vez reducidas las enzimas cardiacas, revertidas las arritmias y estabilizada la disfunción sistólica, se debe continuar el tratamiento estándar de la IC durante al menos 6 meses (véase la figura 20).
Tratamiento y seguimiento de la miocarditis aguda.
| Se debe iniciar el tratamiento de la IC en caso de disfunción sistólica del VI en el momento de la presentación y se continuará durante al menos 6 meses hasta la recuperación funcional completa (FEVI>50%)918,919 |
| Es necesario el tratamiento inmunosupresor durante al menos 6-12 meses para la miocarditis aguda con evidencia clínica de enfermedad autoinmunitaria o confirmada por BEM, incluida la miocarditis de células gigantes, vasculitis o sarcoidosis98,917-919,953,954,961 |
| No se recomienda prescribir sistemáticamente tratamiento inmunosupresor para la miocarditis aguda sin evidencia clínica de enfermedad autoinmunitaria o confirmada mediante BEM917. Se puede valorar la administración de tratamiento empírico inicial con corticoides intravenosos en los casos de alta sospecha de miocarditis en relación con entidades inmunitarias, especialmente si se complica con IC aguda, arritmias malignas o bloqueo AV de grado alto954,962 |
| En caso de síntomas, enzimas cardiacas elevadas o anomalías en el ECG o en pruebas de imagen, se debe evitar la actividad deportiva intensa durante al menos 6 meses desde la recuperación completa936 |
| Es necesario un seguimiento anual con ECG y ecocardiografía durante al menos 4 años, ya que la miocarditis aguda puede causar miocardiopatía dilatada en alrededor del 20% de los casos |
AV: auriculoventricular; BEM: biopsia endomiocárdica; ECG: electrocardiograma; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; VI: ventrículo izquierdo.
Se ha valorado el tratamiento inmunosupresor para la inflamación cardiaca crónica confirmada en biopsia y sin evidencia de infección viral activa918,919. Este tratamiento se asoció con una mejoría de la función cardiaca en pequeños estudios y con mejores resultados en un estudio observacional retrospectivo953,963,964. Son necesarios estudios prospectivos con fármacos inmunosupresores o inmunomoduladores, ya sean antiguos o modernos. Está en marcha un estudio controlado con placebo sobre los efectos de la inmunoabsorción con inmunoglobulina intravenosa y se están estudiando otras opciones de tratamiento919.
14.6Amiloidosis14.6.1Epidemiología y diagnósticoLa amiloidosis cardiaca o miocardiopatía amiloide sigue siendo una causa de IC infradiagnosticada895,965,966. Las 2 formas de amiloidosis cardiaca más prevalentes son la amiloidosis de cadenas ligeras de inmunoglobulina (AL-CA) y la amiloidosis por transtirretina (ATTR). La TTR-CA incluye el tipo salvaje (> 90% de los casos) y el tipo hereditario o variante (< 10%). Se estima que entre el 6 y el 16% de los pacientes mayores de 65 años con HVI de etiología desconocida o IC-FEc al ingreso o estenosis aórtica grave sometidos a reemplazo de válvula aórtica podrían tener TTR-CA de tipo salvaje967−972.
Recientemente se ha revisado el diagnóstico y el tratamiento de la amiloidosis cardiaca973. La edad (> 65 años) y la IC, junto con un grosor de la pared del VI > 12mm en la ecocardiografía, son los criterios más importantes para la sospecha de amiloidosis cardiaca973. Los criterios para sospechar amiloidosis cardiaca y confirmar el diagnóstico se encuentran en la tabla 35 y la figura 21 de esta guía y en la tabla 25 del material adicional973,974. La imagen cardiaca y la biopsia endomiocárdica o extracardiaca son necesarias para el diagnóstico de la AL-CA en los pacientes con pruebas hematológicas anormales (figura 21).
Signos de alarma en las formas más frecuentes de amiloidosis cardiaca.
| Tipo | Signos de alerta | TTR | AL |
|---|---|---|---|
| Extracardiaco | Polineuropatía | × | × |
| Disautonomía | × | × | |
| Hematomas cutáneos | × | ||
| Macroglosia | × | ||
| Sordera | × | ||
| Síndrome de túnel carpiano bilateral | × | ||
| Rotura atraumática del tendón bíceps | × | ||
| Estenosis del canal lumbar | × | ||
| Depósitos intravítreos | ×a | ||
| Historia familiar | ×a | ||
| Insuficiencia renal | × | ||
| Proteinuria | × | ||
| Cardiacos | ClínicosHipotenso o normotenso, si antes estaba hipertenso | × | × |
| ECG | |||
| Patrón del ECG de seudoinfarto | × | × | |
| Voltaje QRS bajo/disminuido para el grosor del VI | × | × | |
| Alteraciones de la conducción AV | × | × | |
| Pruebas de laboratorio | |||
| Concentración de NT-proBNP desproporcionadamente alta para el grado de IC | × | × | |
| Concentraciones de troponina que persisten elevadas | × | × | |
| Ecocardiografía | |||
| Aspecto granular o sparkling del miocardio | × | × | |
| Engrosamiento de la pared del ventrículo derecho | × | × | |
| Engrosamiento de las válvulas auriculoventriculares | × | × | |
| Derrame pericárdico | × | × | |
| Strain longitudinal reducido pero conservado en segmentos apicales | × | × | |
| RMC | |||
| RTG subendocárdico | × | × | |
| Valores en T1 nativos elevados | × | × | |
| Aumento del volumen extracelular | × | × | |
| Cinética anormal del gadolinio | × | × |
AL: cadena ligera de inmunoglobulina; AV: auriculoventricular; CA: amiloidosis cardiaca; ECG: electrocardiograma; IC: insuficiencia cardiaca; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; QRS: ondas Q, R y S en el ECG; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; TTR: transtirretina; VI: ventrículo izquierdo Adaptada de García-Pavia et al.973.
aTTR-CA hereditaria.
Diagnóstico y tratamiento de la amiloidosis cardiaca en pacientes con insuficiencia cardiaca. Adaptada de García-Pavia et al.973. 99mTc-PYP: pirofosfato de tecnecio; ATTR: amiloidosis por transtirretina; DPD: ácido 3,3-difosfono-1,2-propanodicarboxilico; HMDP: hidroxil metilo bisfosfonato; IC: insuficiencia cardiaca; RMC: resonancia magnética cardiaca; SPECT: tomografía por emisión monofotónica; VI: ventrículo izquierdo. aLos signos de alerta se recogen en la Table 35. bPor lo general se requiere biopsia endomiocárdica para el diagnóstico del subtipo cardiaco. cRequiere biopsia que puede ser cardiaca o abdominal.
La gammagrafía planar con 99mTc-PYP, DPD o HMDP y con SPECT tiene una especificidad y un valor predictivo positivo del 100% para la TTR-CA975. Sin embargo, la RMC tiene sensibilidad y especificidad del 85 y el 92% respectivamente966,976. La forma hereditaria de la amiloidosis se debe descartar mediante pruebas genéticas. La biopsia endomiocárdica es la prueba estándar para el diagnóstico de la TTR-CA, ya que tiene cerca del 100% de sensibilidad y especificidad si las muestras se obtienen en más de 4 zonas distintas y se determina la presencia de depósitos amiloides mediante la tinción con rojo Congo966. No obstante, la biopsia no es necesaria en caso de obtenerse un grado 2-3 de positividad en la gammagrafía con SPECT (figura 21)973.
14.6.2Tratamiento de la amiloidosis y la insuficiencia cardiacaEl mantenimiento de la euvolemia es crucial aunque complejo, dada la marcada reducción de la capacidad ventricular977. Si hay síntomas de IC, se puede administrar un diurético del asa, posiblemente con un ARM, pero la hipotensión ortostática puede causar intolerancia. Asimismo, los BB, la digital, los IECA, los ARA-II y los INRA pueden no tolerarse bien debido a la hipotensión, y además su utilidad en el tratamiento de la amiloidosis no está bien definida. Es frecuente que haya que valorar la suspensión de estos tratamientos debido a hipotensión o bradicardia973,974. Deben evitarse los BCC, ya que pueden causar hipotensión grave y fatiga o formar complejos con amiloides966.
La infiltración amiloide en la pared auricular produce miopatía auricular y disociación electromecánica con riesgo embólico alto. Los pacientes con amiloidosis cardiaca y antecedentes de FA deben recibir tratamiento anticoagulante. Hasta ahora, no hay datos que sustenten el tratamiento anticoagulante para pacientes en ritmo sinusal7,978. La amiodarona es el fármaco antiarrítmico preferido973.
El tratamiento de la amiloidosis de cadenas ligeras de inmunoglobulina (AL-CA) se basa en el tratamiento del trastorno hematológico subyacente con quimioterapia o trasplante autólogo de células madre.
La estabilización y la reducción de la producción de TTR son la base del tratamiento de la amiloidosis por transtirretina (TTR-CA). El trasplante de hígado y/o corazón solo se debe considerar en la fase terminal de la TTR-CA. El tratamiento con tafamidis se asoció con una reducción de la mortalidad por cualquier causa y las hospitalizaciones por causas cardiovasculares en la TTR-CA cardiaca y no cardiaca hereditaria y de tipo salvaje confirmada mediante biopsia; este efecto se observó sobre todo en los pacientes en NYHA I y II en la fase basal. La mejoría funcional se apreció en los primeros 6 meses, pero la reducción de la mortalidad ocurrió casi 2 años más tarde979,980. Se puede considerar el patisirán intravenoso —una molécula de interferencia del ARN— o inotersén subcutáneo —un oligonucleótido antisentido inhibidor de la TTR— para los pacientes con polineuropatía amiloidótica por TTR hereditaria (figura 21)981,982. Se puede considerar el diflunisal fuera de indicación combinado con un inhibidor de la bomba de protones para la TTR-CA de tipo salvaje983.
14.7Miocardiopatía por sobrecarga de hierroLa sobrecarga de hierro es el resultado de un aumento determinado genéticamente de la absorción intestinal de hierro en el contexto de la hemocromatosis hereditaria (sobrecarga de hierro primaria) o por múltiples transfusiones sanguíneas requeridas para el tratamiento de enfermedades hematológicas, como la betatalasemia (sobrecarga de hierro secundaria)984. En la sobrecarga de hierro, la capacidad de unión al hierro de la transferrina está saturada y el hierro no ligado a transferrina penetra en los cardiomiocitos a través de los canales del calcio de tipo L, lo que produce daño miocárdico oxidativo985.
Otras complicaciones inducidas por el hierro, como la enfermedad hepática y las anomalías endocrinas, contribuyen adicionalmente al deterioro cardiaco986,987. El resultado final es la aparición de miocardiopatía por sobrecarga de hierro, que puede tener un fenotipo restrictivo o dilatado; el primero puede evolucionar al segundo con la progresión de la enfermedad. El depósito miocárdico de hierro se puede calcular con precisión mediante la técnica de RMCT2*; los valores de T2* se correlacionan con la función sistólica del VI y el VD y predicen IC o arritmias inducidas por sobrecarga de hierro984. El tratamiento con quelantes del hierro como la deferoxamina, deferiprona y deferasirox es efectivo para la prevención de la miocardiopatía por sobrecarga de hierro, mientras que cuando ya está establecida se puede revertir completamente con terapia quelante intensiva y combinada985.
Recomendaciones sobre el tratamiento de la amiloidosis cardiaca y por transtirretina.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Está recomendado el tratamiento con tafamidis para los pacientes con miocardiopatía por TTR hereditaria confirmada mediante pruebas genéticas y síntomas de NYHA I-II para aliviar los síntomas y reducir las hospitalizaciones por causas cardiovasculares y la mortalidad979 | I | B |
| Está recomendado el tratamiento con tafamidis para los pacientes con TTR-CA de tipo salvaje y síntomas de NYHA I-II para aliviar los síntomas y reducir las hospitalizaciones por causas cardiovasculares y la mortalidad979 | I | B |
CA: amiloidosis cardiaca; NYHA: clase funcional de la New York Heart Association; TTR: transtirretina.
aClase de recomendación.
bNivel de evidencia.
En una reciente guía de la ESC se ha revisado el diagnóstico y el tratamiento de la cardiopatía congénita del adulto (CCA)988. La IC es un problema común que afecta al 20-50% de la población con CCA y una importante causa de muerte989. La fisiopatología de la disfunción cardiaca en la CCA suele diferenciarse de la cardiopatía adquirida (no congénita), particularmente en los individuos con: VD sistémico, ventrículo subpulmonar defectuoso, fisiología de ventrículo único988, daño relacionado con la cirugía, sobrecarga crónica de presión o volumen en ventrículo sistémico o subpulmonar y aquellos con hipertrofia o sin compactación inducidas por mutaciones genéticas. Por lo tanto, no siempre se puede extrapolar las recomendaciones actuales para el tratamiento de la IC a los pacientes con CCA. Además, los datos disponibles sobre el tratamiento de la IC en pacientes con CCA no son concluyentes y derivan de cohortes de pocos pacientes. Por consiguiente, las recomendaciones específicas en la CCA se basan fundamentalmente en la experiencia clínica o en declaraciones de posición990.
Se debe derivar a los pacientes con CCA e IC a centros especializados. La tabla 36 resume los principios generales de tratamiento mientras se espera a la derivación del paciente.
Tratamiento de la cardiopatía congénita del adulto y la insuficiencia cardiaca en centros especializados.
| Se debe derivar a centros especializados a los pacientes con CCA e IC crónica |
| Se debe seguir las guías actuales para el tratamiento médico de la IC crónica a falta de guías específicas para la CCA. No está claro si el tratamiento a largo plazo con moduladores neurohormonales afecta a los resultados clínicos y el pronóstico en la CCA |
| El sacubitrilo-valsartán puede reducir la morbilidad991-993, pero por ahora no se puede establecer recomendaciones por la naturaleza retrospectiva o anecdótica de estas observaciones |
| Se debe tratar las comorbilidades de la IC, como diabetes mellitus, FA, ACS, déficit de hierro y caquexia, siguiendo las recomendaciones específicas descritas en este documento |
| En la circulación biventricular, los pacientes con insuficiencia sistémica del VI deben recibir tratamiento convencional para la IC; esta recomendación se puede considerar también para pacientes sintomáticos con ventrículo derecho sistémico defectuoso |
| El tratamiento con diuréticos está recomendado para controlar los síntomas de retención de fluidos |
| Se debe iniciar con precaución el tratamiento de los pacientes sintomáticos con ventrículo único defectuoso tras operación de Fontan o en caso de cortocircuitos persistentes derecha-izquierda y teniendo en cuenta el equilibrio inestable entre la precarga ventricular y la poscarga sistémica |
| La TRC puede ser una opción terapéutica para los pacientes con CCA e IC, pero la evidencia en este contexto específico es insuficiente. La eficacia de la TRC depende del sustrato estructural y funcional subyacente, como la anatomía del ventrículo sistémico (izquierdo, derecho o ventrículo funcional único), la presencia y el grado de insuficiencia de las válvulas AV sistémicas, la enfermedad miocárdica primaria o la cicatrización y el tipo de retraso de la conducción eléctrica988 |
| El tratamiento de los pacientes con CCA e IC aguda se debe administrar en un centro especializado, con experiencia en el uso de inotrópicos y disponibilidad de oxigenador extracorpóreo de membrana y técnicas avanzadas de tratamiento puente988,994 |
| Se recomienda que un equipo de especialistas en CCA e IC evalúe en el momento oportuno la indicación de trasplante en un centro de trasplante con experiencia en CCA |
| Los dispositivos de asistencia ventricular pueden ser el tratamiento puente al trasplante; para un subgrupo de pacientes podría ser una opción de terapia de destino |
ACS: apnea central del sueño; AV: auriculoventricular; CCA: cardiopatía congénita del adulto; FA: fibrilación auricular, IC: insuficiencia cardiaca; TRC: terapia de resincronización cardiaca; VI: ventrículo izquierdo.
Principales indicadores de calidad de la ESC para la evaluación de la atención y los resultados de los pacientes con insuficiencia cardiaca (la lista completa se ha publicado en un artículo aparte).
| Dominio 1. Indicadores de calidad estructuralesa |
| Principal (1): el centro debe disponer de un equipo multidisciplinario para la atención de los pacientes con IC |
| Numerador: disponibilidad de un equipo multidisciplinario dedicado a la atención de los pacientes con IC |
| Dominio 2. Evaluación de los pacientesb |
| Principal (1): porcentaje de pacientes que tienen documentado el tipo clínico de IC (IC-FEr, IC-FEm, IC-FEc) |
| Numerador: número de pacientes con IC que tienen documentado el tipo clínico de IC (IC-FEr, IC-FEm, IC-FEc) |
| Denominador: número de pacientes con IC |
| Principal (2): porcentaje de pacientes con IC que tienen documentados los hallazgos del ECG |
| Numerador: número de pacientes con IC que tienen documentados los hallazgos del ECG |
| Denominador: número de pacientes con IC |
| Principal (3): porcentaje de pacientes con IC en los que se determina la concentración de péptidos natriuréticos |
| Numerador: número de pacientes con IC en los que se determina la concentración de péptidos natriuréticos |
| Denominador: número de pacientes con IC |
| Dominio 3. Tratamiento inicial |
| Principal (1): porcentaje de pacientes con IC-FEr a los que se prescribe tratamiento con bloqueadores beta (bisoprolol, carvedilol, succinato de metropolol de liberación prolongada o nebivolol) en ausencia de contraindicaciones |
| Numerador: número de pacientes con IC-FEr a los que se prescribe tratamiento con bloqueadores beta (bisoprolol, carvedilol, succinato de metropolol de liberación prolongada o nebivolol) |
| Denominador: número de pacientes con IC-FEr sin contraindicaciones para el tratamiento con bloqueadores beta (bisoprolol, carvedilol, succinato de metropolol de liberación prolongada o nebivolol) |
| Principal (2): porcentaje de pacientes con IC-FEr a los que se prescribe un IECA, ARA-II o INRA en ausencia de contraindicaciones |
| Numerador: número de pacientes con IC-FEr a los que se prescribe un IECA, ARA-II o INRA |
| Denominador: número de pacientes con IC-FEr sin contraindicaciones para el tratamiento con IECA, ARA-II o INRA |
| Principal (3): porcentaje de pacientes con IC y evidencia de retención de fluidos a los que se prescribe tratamiento diurético |
| Numerador: número de pacientes con IC y evidencia de retención de fluidos a los que se prescribe tratamiento diurético |
| Denominador: número de pacientes con IC y evidencia de retención de fluidos que no tienen contraindicaciones para el tratamiento diurético |
| Principal (4): porcentaje de pacientes con IC-FEr a los que se prescribe un ARM en ausencia de contraindicaciones |
| Numerador: número de pacientes con IC-FEr a los que se prescribe un ARM |
| Denominador: número de pacientes con IC-FEr sin contraindicaciones para el tratamiento con un ARM |
| Principal (5): porcentaje de pacientes con IC-FEr a los que se prescribe un iSGLT2 en ausencia de contraindicaciones |
| Numerador: número de pacientes con IC-FEr a los que se prescribe un iSGLT2 |
| Denominador: número de pacientes con IC-FEr sin contraindicaciones para el tratamiento con iSGLT2 |
ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; BRI: bloqueo de rama izquierda; DAI: desfibrilador automático implantable; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; NYHA: clase funcional de la New York Heart Association; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; TMO: tratamiento médico óptimo.
aLos indicadores de calidad estructurales son mediciones binarias (sí/no) y, por lo tanto, solo tienen numerador.
bLos análisis de sangre incluyen urea, creatinina, electrolitos, recuento sanguíneo completo, glucosa, glucohemoglobina, tirotropina, función hepática, lípidos y estado del hierro.
- 1
Los pacientes con IC se clasifican según su FEVI. Los que tienen la FEVI entre el 41 y el 49% se definen como «FEVI ligeramente reducida» (IC-FElr).
- 2
La determinación de PN y la ecocardiografía tienen un papel central en el diagnóstico de la IC.
- 3
Los IECA o INRA, los BB, los ARM y los iSGLT2 son la piedra angular del tratamiento de los pacientes con IC-FEr.
- 4
Se recomienda el implante de un DAI para pacientes seleccionados con IC-FEr de etiología isquémica y se debe considerar en la IC-FEr de etiología no isquémica.
- 5
Se recomienda la TRC con marcapasos o desfibrilador para los pacientes con IC-FEr en ritmo sinusal y BCR ≥ 150ms, y se debe considerar para aquellos con BCR entre 130-149ms o sin BCR ≥ 150ms.
- 6
Las terapias avanzadas para la IC (trasplante cardiaco, ACM) pueden ser adecuadas para pacientes seleccionados.
- 7
Se puede considerar la administración de IECA/INRA, BB y ARM a los pacientes con IC-FElr.
- 8
El diagnóstico de IC-FEr requiere evidencia objetiva de anomalías cardiacas estructurales o funcionales, además de concentraciones de PN elevadas compatibles con disfunción diastólica del VI y presiones elevadas de llenado del VI. Se recomienda una prueba de estrés diastólico cuando estos marcadores no sean concluyentes.
- 9
Hasta la fecha, no se ha demostrado que ningún tratamiento reduzca la morbimortalidad de los pacientes con IC-FEc.
- 10
Se recomienda incluir a los pacientes con IC en un programa multidisciplinario de atención especializada.
- 11
Para los pacientes que puedan, se recomienda la actividad física para mejorar la capacidad de ejercicio y la calidad de vida y reducir las hospitalizaciones por IC.
- 12
Para evaluar la indicación de trasplante cardiaco, se debe derivar a los pacientes con IC avanzada refractaria a tratamiento farmacológico o con dispositivos que no tengan contraindicaciones absolutas. Se puede considerar también la ACM como puente al trasplante o como terapia definitiva para pacientes seleccionados.
- 13
Las 4 presentaciones clínicas más importantes de la ICA son: IC en descompensación aguda, edema pulmonar agudo, insuficiencia del VD y shock cardiogénico.
- 14
El tratamiento de la ICA se basa en la administración de diuréticos para la congestión, inotrópicos y ACM temporal para la hipoperfusión periférica.
- 15
Se debe vigilar estrechamente a los pacientes hospitalizados por IC para descartar signos de congestión persistentes. El tratamiento oral se debe optimizar antes del alta.
- 16
Además de la anticoagulación oral, se debe considerar una estrategia para controlar el ritmo cardiaco, incluida la ablación con catéter, para los pacientes cuyos síntomas o disfunción cardiaca estén asociados con la FA.
- 17
Se recomienda el RQVA o el TAVI, según la valoración del equipo cardiológico, para los pacientes con estenosis aórtica grave y sintomática.
- 18
Se debe valorar para reparación percutánea de «borde con borde» a los pacientes con insuficiencia mitral secundaria aislada que cumplan los criterios del estudio COAPT, mientras que se debe valorar para cirugía a los pacientes con insuficiencia mitral secundaria y EC.
- 19
Se recomienda que los pacientes con DM2 reciban tratamiento con iSGLT2.
- 20
Para los pacientes sintomáticos con FEVI < 45% o recientemente hospitalizados por IC con FEVI ≤ 50% y déficit de hierro, se recomienda el cribado periódico de la anemia y el déficit de hierro y se debe considerar la administración intravenosa de un suplemento de hierro con carboximaltosa férrica.
En los últimos años se han producido avances importantes en el diagnóstico y el tratamiento de los pacientes con IC. Estudios clínicos recientes han recabado evidencia convincente sobre nuevas opciones de tratamiento para la IC que pueden conducir a cambios importantes en el abordaje de la enfermedad en los próximos años. Estos descubrimientos, no obstante, plantean nuevos desafíos y aún no se dispone de evidencia en numerosas áreas. En la siguiente lista se propone una selección de aspectos comunes que requieren investigación clínica en el futuro.
(1) Definición y epidemiología
- (i)
Investigación sobre las características subyacentes, la fisiopatología y el diagnóstico de la IC-FElr y la IC-FEc.
- (ii)
Consenso sobre los valores o intervalos de FE normales.
- (iii)
Caracterización adecuada del fenotipo de la IC-FEc.
- (iv)
Más información sobre la incidencia y la prevalencia de la función sistólica «recuperada».
(2) Diagnóstico
- (i)
Estudios definitivos sobre el papel de los biomarcadores, centrados en su valor adicional para el diagnóstico de la IC.
- (ii)
Estudios aleatorizados sobre el cribado de la IC en sujetos asintomáticos que podría llevar a mejores resultados.
- (iii)
Estudios que demuestren el impacto de la determinación de biomarcadores para identificar a los individuos con riesgo de IC, guiar el tratamiento de los pacientes con IC y mejorar los resultados.
- (iv)
Protocolos validados para el diagnóstico de IC-FElr e IC-FEc.
(3) Tratamiento farmacológico para la IC crónica
- (i)
Estudios pragmáticos sobre el orden que se debe seguir para añadir fármacos modificadores de la enfermedad en la IC-FEr.
- (ii)
Tratamientos específicos para la IC-FElr y la IC-FEc y, posiblemente, sus diferentes fenotipos.
- (iii)
Más datos y estudios prospectivos sobre el tratamiento de la IC-FEr de los pacientes con TFGe < 30ml/min/1,73 m2.
- (iv)
Más evidencia de estudios prospectivos sobre el tratamiento de los pacientes con fenotipos específicos de la IC: miocarditis, cardiotoxicidad, miocardiopatías hereditarias, miocardiopatía periparto, amiloidosis.
- (v)
Estrategias de abordaje y tratamiento de la función sistólica del VI «recuperada».
- (vi)
Más evidencia sobre los efectos de la restricción de fluidos y de la ingesta de sal y aspectos nutricionales.
(4) Dispositivos e intervenciones
- (i)
Indicaciones para el implante de DAI en subgrupos específicos de IC-FElr/IC-FEc y selección de candidatos a DAI en la IC-FEr, incluidos los pacientes con cardiopatía isquémica y no isquémica.
- (ii)
Estudios sobre la eficacia de la TRC en la FA.
- (iii)
Estudios prospectivos aleatorizados sobre el impacto en los resultados de la ablación de la FA comparada con el TMO en pacientes con IC.
- (iv)
Estudios sobre el tratamiento percutáneo de valvulopatías y su impacto en la evolución y la calidad de vida de los pacientes.
- (v)
Estudios aleatorizados grandes sobre la modulación de la contractilidad cardiaca y la estimulación de barorreceptores en la IC-FEr.
(5) Abordaje de la enfermedad
- (i)
Papel de las estrategias de monitorización a distancia en la IC después de la pandemia de COVID-19.
- (ii)
Estudios sobre los modelos de seguimiento más adecuados para los pacientes con IC estables.
- (iii)
Estudios para determinar las opciones específicas de cuidados paliativos.
(6) IC avanzada
- (i)
Definición más precisa de los perfiles de riesgo según la clasificación INTERMACS y otras clasificaciones.
- (ii)
Estudios aleatorizados para establecer los efectos de la ACM a largo plazo en los resultados de pacientes hospitalizados o ambulatorios (p. ej., con perfil INTERMACS 4-6).
- (iii)
Avances en la ACM a largo plazo, incluidas estrategias para reducir el riesgo de sangrado, complicaciones tromboembólicas e infección.
- (iv)
Avances en el tratamiento farmacológico de numerosos pacientes que no son candidatos a ACM o trasplante cardiaco que incluyan el desarrollo de nuevas estrategias terapéuticas, inotrópicos o miotrópicos nuevos para los pacientes con IC avanzada.
(7) IC aguda
- (i)
Definición y clasificación más precisas del fenotipo de los pacientes para facilitar el tratamiento más adecuado.
- (ii)
Utilización basada en la evidencia de técnicas de imagen y determinación de biomarcadores que tengan un impacto en la evolución clínica de los pacientes.
- (iii)
Desarrollo de estrategias eficaces para aliviar la congestión, incluida la monitorización del tratamiento diurético, y mejorar la perfusión orgánica.
- (iv)
Identificación de los tratamientos con un impacto positivo en los resultados después del alta.
- (v)
Nuevos dispositivos para la ACM a corto plazo.
- (vi)
Definición de las opciones de tratamiento basadas en la evidencia y algoritmos terapéuticos para los pacientes en shock cardiogénico.
(8) Comorbilidades cardiovasculares
- (i)
Estudios aleatorizados que muestren las mejores estrategias para el tratamiento de las arritmias ventriculares.
- (ii)
Estudios aleatorizados para establecer el papel de los procedimientos de revascularización coronaria en diferentes subgrupos de pacientes.
- (iii)
Estudios aleatorizados para establecer el impacto del tratamiento percutáneo de la valvulopatía mitral o tricuspídea en los resultados y la calidad de vida de los pacientes con IC.
(9) Comorbilidades no cardiovasculares
- (i)
Estudios aleatorizados sobre caquexia, sarcopenia y fragilidad que muestren el impacto del tratamiento en la calidad de vida y los resultados.
- (ii)
Estudios aleatorizados sobre tratamientos con fármacos o dispositivos para pacientes con ERC grave e IC.
- (iii)
Estudios aleatorizados que muestren los efectos del tratamiento de las anomalías electrolíticas en los resultados.
- (iv)
Estudios aleatorizados que muestren los efectos del tratamiento de la apnea central del sueño en los resultados.
- (v)
Estudios prospectivos que muestren el impacto del diagnóstico temprano, la prevención y el tratamiento de la cardiotoxicidad del tratamiento anticancerígeno en los resultados y la calidad de vida.
- (vi)
Mejor tratamiento de las infecciones y prevención del daño cardiaco asociado con la infección.
(10) Situaciones especiales
- (i)
Estudios aleatorizados sobre el tratamiento de la miocardiopatía periparto.
- (ii)
Adecuada caracterización del fenotipo de las miocardiopatías mediante pruebas genéticas, biomarcadores y técnicas de imagen y tratamiento individualizado de estos pacientes.
- (iii)
Estudios aleatorizados sobre el tratamiento de los distintos tipos de miocarditis, incluida la terapia inmunosupresora.
- (iv)
Estudios aleatorizados sobre nuevos tratamientos de las diferentes formas de amiloidosis cardiaca.
- (v)
Definición y tratamiento adecuados de la miopatía de la aurícula izquierda.
| Recomendaciones | Clasea | Nivelb |
|---|---|---|
| Recomendaciones para el diagnóstico de la IC crónica | ||
| BNP/NT-proBNPc | I | B |
| ECG de 12 derivaciones | I | C |
| Ecocardiografía transtorácica | I | C |
| Radiografía de tórax | I | C |
| Análisis sanguíneo habitual para comorbilidades: recuento sanguíneo completo, urea y electrolitos, función tiroidea, glucosa en ayunas y HbA1c, lípidos. Determinación de hierro: Sat-T y ferritina | I | C |
| La RMC está recomendada para la evaluación de la estructura y la función miocárdicas de los pacientes con una ventana acústica inadecuada | I | C |
| La RMC está recomendada para la caracterización del tejido miocárdico en caso de sospecha de enfermedad infiltrativa, miocardiopatía de Fabry, enfermedad inflamatoria (miocarditis), miocardiopatía por VI no compactado, amiloidosis, sarcoidosis, sobrecarga de hierro o hemocromatosis | I | C |
| La coronariografía invasiva está recomendada para pacientes con angina pese al tratamiento farmacológico o con arritmias ventriculares sintomáticas | I | B |
| La prueba de esfuerzo cardiopulmonar está recomendada como parte de la evaluación para trasplante cardiaco o ACM | I | C |
| El cateterismo de corazón derecho está recomendado para pacientes con IC grave evaluados para trasplante cardiaco o ACM | I | C |
| Recomendaciones para el tratamiento de la IC-FEr | ||
| Se recomienda un IECA para reducir el riesgo de hospitalización por IC y muerte de los pacientes con IC-FEr | I | A |
| Se recomienda un bloqueador beta para reducir el riesgo de hospitalización por IC y muerte de los pacientes con IC-FEr estable | I | A |
| Se recomienda un ARM para reducir el riesgo de hospitalización por IC y muerte de los pacientes con IC-FEr | I | A |
| La dapagliflozina o empagliflozina están recomendadas para reducir el riesgo de hospitalización por IC y muerte de los pacientes con IC-FEr | I | A |
| El sacubitrilo-valsartán está recomendado como sustituto de un IECA para reducir el riesgo de hospitalización por IC y muerte de los pacientes con IC-FEr | I | B |
| Los diuréticos están recomendados para aliviar los síntomas, mejorar la capacidad de ejercicio y reducir las hospitalizaciones por IC de los pacientes con IC-FEr y signos o síntomas de congestión | I | C |
| Se recomienda un ARA-IIc para reducir el riesgo de hospitalización por IC y muerte cardiovascular de los pacientes que no toleran los IECA o INRA (que también deber recibir un bloqueador beta y un ARM) | I | B |
| No se recomienda añadir un ARA-II (o inhibidor de la renina) a la combinación de un IECA y un ARM para los pacientes con IC, debido al aumento de riesgo de disfunción renal e hiperpotasemia | III | C |
| Se recomienda implantar un DAI para reducir el riesgo de muerte súbita y mortalidad por cualquier causa de los pacientes recuperados de una arritmia ventricular causante de inestabilidad hemodinámica y con una esperanza de vida > 1 año en buen estado funcional si no hay una causa reversible o cuando la arritmia se produzca menos de 48 h después de un IM | I | A |
| Se recomienda implantar un DAI para reducir el riesgo de muerte súbita y mortalidad por cualquier causa de los pacientes con IC sintomática (NYHA II-III) de etiología isquémica (excepto si han sufrido un IM en los últimos 40 días; véase a continuación) y FEVI ≤ 35% pese al TMO ≥ 3 meses siempre que su esperanza de vida sea significativamente > 1 año en buen estado funcional | I | A |
| No se recomienda implantar un DAI en los primeros 40 días tras el IM, ya que en ese periodo la intervención no mejora el pronóstico | III | A |
| No se recomienda el implante de un DAI a pacientes en NYHA IV con síntomas graves y refractarios al tratamiento farmacológico, excepto si son candidatos a TRC, DAV o trasplante cardiaco | III | C |
| Se recomienda la TRC para los pacientes con IC sintomáticos, en ritmo sinusal con QRS ≥ 150 ms con morfología de BRI y FEVI ≤ 35% pese al TMO a efectos de mejorar los síntomas y reducir la morbimortalidad | I | A |
| Se recomienda la TRC, en lugar de marcapasos de VD, para los pacientes con IC-FEr y cualesquiera clase funcional de la NYHA o amplitud del QRS que tengan indicación para marcapasos ventricular y BAV de alto grado a efectos de reducir la morbilidad. Esto incluye a los pacientes con FA | I | A |
| No se recomienda la TRC para pacientes con QRS<130ms que no tengan indicación de marcapasos debido a BAV de grado alto | III | A |
| Recomendaciones para el tratamiento de la IC-FElr y la IC-FEc | ||
| Se recomienda el tratamiento diurético para los pacientes con IC-FElr y congestión, para aliviar síntomas y signos | I | C |
| Se recomienda el cribado y el tratamiento de etiologías y comorbilidades cardiovasculares y otras para pacientes con IC-FEc (véase las correspondientes secciones de este documento) | I | C |
| Se recomienda el tratamiento diurético de los pacientes con IC-FEc y congestión para aliviar síntomas y signos | I | C |
| Recomendaciones sobre la prevención de la IC crónica | ||
| Se recomienda el tratamiento de la hipertensión para prevenir o retrasar la aparición de IC y prevenir las hospitalizaciones por IC | I | A |
| Se recomienda el tratamiento con estatinas para los pacientes con riesgo alto o enfermedad cardiovascular confirmada para prevenir o retrasar la aparición de IC y prevenir las hospitalizaciones por IC | I | A |
| Los iSGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) están recomendados para los pacientes con diabetes y riesgo alto o enfermedad cardiovascular confirmada para prevenir las hospitalizaciones por IC | I | A |
| Se recomienda asesorar a los pacientes sobre los efectos nocivos del sedentarismo, la obesidad, el tabaquismo y la ingesta excesiva de alcohol a efectos de prevenir o retrasar la IC | I | C |
| Otras recomendaciones sobre el tratamiento de la IC crónica | ||
| Se recomienda incluir a los pacientes con IC en un programa de atención multidisciplinaria para reducir el riesgo de hospitalización por IC y la mortalidad | I | A |
| Se recomiendan las estrategias de autocuidados para reducir el riesgo de hospitalización por IC y la mortalidad | I | A |
| Se recomiendan los programas de atención domiciliaria y ambulatoria para reducir el riesgo de hospitalización por IC y la mortalidad | I | A |
| Se recomienda el entrenamiento físico para todos los pacientes que puedan realizarlo a efectos de mejorar la capacidad de ejercicio y la calidad de vida y reducir las hospitalizaciones por ICd | I | A |
| Recomendaciones para el tratamiento de los pacientes con IC avanzada | ||
| Los pacientes evaluados para ACM a largo plazo deben tener una buena adherencia, capacidad para manejar el dispositivo y apoyo psicosocial | I | C |
| Se recomienda el trasplante cardiaco para los pacientes con IC avanzada refractaria al tratamiento con fármacos o dispositivos que no tengan contraindicaciones absolutas | I | C |
| Recomendaciones sobre el tratamiento de los pacientes con IC aguda | ||
| Se recomienda administrar oxígeno a los pacientes con SpO2 < 90% o PaO2 < 60mmHg a efectos de corregir la hipoxemia | I | C |
| Se recomienda la intubación del paciente en caso de insuficiencia respiratoria progresiva que persista pese a la administración de oxígeno y ventilación no invasiva | I | C |
| Se recomiendan los diuréticos i.v. para todo paciente con ICA ingresado con síntomas o signos de sobrecarga de fluidos para mejorar los síntomas | I | C |
| Se recomienda la profilaxis de tromboembolias (p. ej., con HBPM) para los pacientes que no estén anticoagulados ni tengan contraindicaciones para la anticoagulación a efectos de reducir el riesgo de trombosis venosa profunda y embolia pulmonar | I | A |
| Debido a problemas de seguridad, no se recomienda el uso sistemático de inotrópicos, sino cuando el paciente presente hipotensión sintomática y evidencia de hipoperfusión | III | C |
| No se recomienda el uso sistemático de opiáceos, excepto para pacientes seleccionados con dolor o ansiedad intensos o intratables | III | C |
| No se recomienda el uso sistemático de BCIA para tratar el shock cardiogénico tras el IM | III | B |
| Recomendaciones para la atención de pacientes después de la hospitalización por IC | ||
| Se recomienda el examen minucioso de los pacientes hospitalizados por IC para descartar antes del alta signos de congestión persistentes y optimizar el tratamiento oral | I | C |
| Se recomienda administrar antes del alta un tratamiento oral basado en la evidencia | I | C |
| Se recomienda una consulta de seguimiento 1 o 2 semanas después del alta para evaluar los signos de congestión y la tolerancia al tratamiento farmacológico e iniciar o aumentar el tratamiento basado en la evidencia | I | C |
| Recomendaciones sobre el tratamiento de los pacientes con IC y FA | ||
| Se debe considerar el tratamiento anticoagulante oral a largo plazo para la prevención del ictus en pacientes con FA y puntuación CHA2DS2-VASc de 1 los varones y 2 las mujeres | I | A |
| Se recomiendan los ACOD en lugar de AVK para los pacientes con IC, excepto para aquellos con estenosis mitral grave o válvula cardiaca protésica | I | A |
| En el contexto de la descompensación aguda de la IC de los pacientes con frecuencia ventricular alta e inestabilidad hemodinámica, se recomienda la cardioversión eléctrica urgente | I | C |
| No está recomendado el tratamiento con los antiarrítmicos flecainida, encainida, disopiramida, dronedarona y sotalol D debido a problemas de seguridad | III | A |
| No se recomienda tratar con diltiazem o verapamilo a los pacientes con IC-FEr, ya que aumentan el riesgo de empeoramiento y hospitalización por IC | III | C |
| Recomendaciones sobre el tratamiento de los pacientes con IC y estenosis aórtica | ||
| Las intervenciones de válvula aórtica (TAVI o RQVA) para los pacientes con IC y estenosis aórtica grave y de gradiente alto están recomendadas para reducir la mortalidad y mejorar los síntomas | I | B |
| Se recomienda que el equipo cardiológico valore la elección entre TAVI y RQVA teniendo en cuenta las preferencias del paciente y otros factores como la edad, el riesgo quirúrgico y aspectos clínicos, anatómicos y del procedimiento, además de sopesar la relación de riesgo-beneficio individual de cada estrategia | I | C |
| Recomendaciones sobre el tratamiento de los pacientes con IC y diabetes | ||
| Se recomiendan los iSGLT2 (canagliflozina, dapagliflozina, empagliflozina, ertugliflozina, sotagliflozina) para los pacientes con DM2 y riesgo de complicaciones cardiovasculares para reducir las hospitalizaciones por IC, los eventos cardiovasculares mayores, la disfunción renal en fase terminal y la muerte cardiovascular | I | A |
| Se recomiendan los iSGLT2 (dapagliflozina, empagliflozina y sotagliflozina) para los pacientes con DM2 e IC-FEr para reducir las hospitalizaciones por IC y la muerte cardiovascular | I | A |
| No se recomiendan las tiazolidinedionas (glitazonas) para los pacientes con IC, ya que aumentan el riesgo de empeoramiento y hospitalización por IC | III | A |
| La saxagliptina, un inhibidor de la DPP-4, no está recomendada para pacientes con IC | III | B |
| Recomendaciones sobre el tratamiento de los pacientes con IC y déficit de hierro | ||
| Se recomienda el cribado periódico de la anemia y déficit de hierro con recuento sanguíneo completo, concentración sérica de ferritina y Sat-T para todos los pacientes con IC | I | C |
| No se recomienda el tratamiento de la anemia con estimuladores de la eritropoyetina en la IC si no existen otras indicaciones para este tratamiento | III | B |
| Recomendaciones sobre el tratamiento de los pacientes con IC y apnea del sueño | ||
| No se recomienda la servoventilación adaptativa para pacientes con IC-FEr y ACS predominante, debido al aumento de la mortalidad cardiovascular y por cualquier causa | III | A |
| Recomendaciones sobre el tratamiento de los pacientes con IC y artritis | ||
| No se recomiendan los AINE ni los inhibidores de la COX-2 para pacientes con IC, ya que aumentan el riesgo de empeoramiento y hospitalización por IC | III | B |
| Recomendaciones sobre el tratamiento de los pacientes con IC y cáncer | ||
| Se recomienda que los pacientes con cáncer y riesgo de cardiotoxicidad aumentado, definido como antecedentes o factores de riesgo de ECV, cardiotoxicidad previa o exposición a fármacos cardiotóxicos, sean evaluados antes de iniciarse el tratamiento oncológico, preferiblemente por un cardiólogo con experiencia e interés en cardio-oncología | I | C |
| Recomendaciones sobre el tratamiento de los pacientes con IC y amiloidosis | ||
| Se recomienda el tafamidis para los pacientes con miocardiopatía por TTR hereditaria demostrada en pruebas genéticas y síntomas de NYHA I-II para mejorar los síntomas y reducir las hospitalizaciones y la muerte CV | I | B |
| Se recomienda el tafamidis para los pacientes con miocardiopatía por TTR hereditaria de tipo salvaje y síntomas de NYHA I-II para mejorar los síntomas y reducir las hospitalizaciones y la muerte CV | I | B |
ACM: asistencia circulatoria mecánica; ACOD: anticoagulantes orales de acción directa; ACS: apnea central del sueño; AINE: antiinflamatorios no esteroideos; ARA-II: antagonistas del receptor de la angiotensina II; ARM: antagonistas del receptor de mineralcortidoides; AV: auriculoventricular; AVK: antagonistas de la vitamina K; BCIA: balón de contrapulsación intraaórtico; BNP: péptido natriurético cerebral; BRI: bloqueo de rama izquierda; CHA2DS2-VASc: insuficiencia cardiaca, hipertensión, edad ≥ 75 (doble), diabetes, ictus (doble)-enfermedad vascular, edad 65-74 y sexo (mujer); CV: cardiovascular; DAI: desfibrilador automático implantable; DAV: dispositivo de asistencia ventricular; DM2: diabetes mellitus tipo 2; DPP-4: dipeptidil peptidasa 4; ECG: electrocardiograma; FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; HbA1c: glucohemoglobina; HBPM: heparina de bajo peso molecular; IC: insuficiencia cardiaca; IC-FEc: insuficiencia cardiaca con fracción de eyección conservada; IC-FElr: insuficiencia cardiaca con fracción de eyección ligeramente reducida; IC-FEr: insuficiencia cardiaca con fracción de eyección reducida; IECA: inhibidor de la enzima de conversión de la angiotensina; IM: infarto de miocardio; INRA: inhibidores de la neprilisina y el receptor de la angiotensina; iSGLT2: inhibidores del cotransportador de sodio-glucosa tipo 2; NT-proBNP: fracción N-terminal del propéptido natriurético cerebral; NYHA: clase funcional de la New York Heart Association; PaO2: presión parcial de oxígeno; QRS: ondas Q, R y S en el ECG; RMC: resonancia magnética; RQVA: reemplazo quirúrgico de válvula aórtica; Sat-T: saturación de transferrina; SpO2: saturación de oxígeno transcutánea; TAVI: implante percutáneo de válvula aórtica; TMO: tratamiento médico óptimo; TRC: terapia de resincronización cardiaca; TTR-CA: amiloidosis cardiaca por transtirretina; TTR: transtirretina; VD: ventrículo derecho; VI: ventrículo izquierdo.
aClase de recomendación.
bNivel de evidencia.
cLas referencias bibliográficas se listan en la sección 4.2 dedicada a este tema.
dPara los pacientes que puedan cumplir con un programa de ejercicio.
Los indicadores de calidad sirven para evaluar la calidad del servicio, que incluye los procesos de atención y los resultados clínicos995. También pueden servir como mecanismos para promover la adherencia a las recomendaciones de las guías de práctica clínica mediante la puesta en marcha de procesos de garantía de calidad y evaluaciones comparativas de los proveedores de atención sanitaria996. Como tales, el papel de estos indicadores para mejorar la calidad gana reconocimiento y atrae el interés de las autoridades sanitarias, las organizaciones profesionales, los administradores y la población general997.
La ESC es consciente de la necesidad de medir y reportar la calidad y los resultados de los cuidados cardiovasculares. Se ha publicado la metodología empleada para desarrollar los indicadores de calidad de la ESC997 y, hasta la fecha, se han elaborado varios paquetes de indicadores para una serie de enfermedades cardiovasculares998,999. Con el objetivo de promover iniciativas de mejora de la calidad, los indicadores de la ESC se incluyen en las GPC específicas de cada patología7,1000. Con este mismo propósito, los indicadores de calidad se integran en registros de la ESC, como el EURObservational Research Programme (EORP) y en el proyecto European Unified Registries On Heart Care Evaluation and Randomized Trials (EuroHeart)1001.
Para los pacientes con IC, los indicadores de calidad pueden ayudar a los proveedores de atención médica a aplicar las recomendaciones específicas de las guías y a la vez discriminar las oportunidades perdidas de las actuaciones médicas adecuadas. Además, los indicadores de calidad permiten captar la experiencia de los pacientes.
Para ello, y paralelamente a la elaboración de esta guía, se ha desarrollado un paquete de indicadores de calidad para la evaluación de la atención y los resultados de los pacientes con IC. Estos indicadores, junto con las especificaciones y el proceso de desarrollo, se han publicado en un artículo aparte y se resumen brevemente en la tabla 37.
19MATERIAL ADICIONALEl anexo de material adicional con texto, figuras y tablas adicionales a este documento solo está disponible en inglés y en las páginas web de European Heart Journal y la ESC a través del enlace www.escardio.org/guidelines.
20FILIACIONES DE LOS AUTORES Y MIEMBROS DEL GRUPO DE TRABAJOMarianna Adamo, Medical and Surgical Specialties, Radiological Sciences and Public, ASST Spedali Civili di Brescia, Brescia, Italia; Andreas Baumbach, Barts Heart Centre, Queen Mary University of London, Londres, Reino Unido; Michael Böhm, Klinik für Innere Medizin III, Saarland University, Homburg/Saar, Saarland, Alemania; Haran Burri, Cardiology, University Hospital of Geneva, Ginebra, Suiza; Jelena Čelutkienė, Clinic of Cardiac and Vascular Diseases, Vilnius University, Faculty of Medicine, Vilna, Lituania; Ovidiu Chioncel, Emergency Institute for Cardiovascular Diseases «Prof. Dr.C.C.Iliescu», University of Medicine Carol Davila, Bucarest, Rumanía; John G.F. Cleland, Robertson Centre for Biostatistics and Clinical Trials, Institute of Health & Wellbeing, Lanarkshire, Glasgow, Reino Unido; Andrew J.S. Coats, University of Warwick, Coventry, Warwick, Reino Unido; María G. Crespo-Leiro, Cardiología, Complexo Hospitalario Universitario A Coruña (CHUAC), CIBERCV, Universidade da Coruña (UDC), Instituto de Investigación Biomédica de A Coruña (INIBIC), A Coruña, España; Dimitrios Farmakis, University of Cyprus Medical School, Nicosia, Chipre; Roy S. Gardner, Scottish National Advanced Heart Failure Service, Golden Jubilee National Hospital, Clyderbank, Glasgow, Escocia, Reino Unido; Martine Gilard, Cardiology, Brest University, Brest, Francia; Stephane Heymans, Department of Cardiology, Maastricht University, CARIM School for Cardiovascular Diseases, Maastricht, Países Bajos; Arno W. Hoes, University Medical Center Utrecht, Utrecht, Países Bajos; Tiny Jaarsma, Department of Health, Medicine and Caring Science, Linköping University, Linköping, Suecia; Ewa A. Jankowska, Department of Heart Diseases, Wroclaw Medical University, Breslavia, Polonia; Mitja Lainscak, Division of Cardiology, General Hospital Murska Sobota, Murska Sobota, Eslovenia; Carolyn S.P. Lam, National Heart Centre Singapore and Duke-National University of Singapore, Singapur; Alexander R. Lyon, Department of Cardiology, Royal Brompton Hospital, Londres, Reino Unido; John J.V. McMurray, British Heart Foundation Cardiovascular Research Centre, University of Glasgow, Glasgow, Escocia, Reino Unido; Alexandre Mebazaa, Anesthesiology and Critical Care, Université de Paris - Hôpital Lariboisière, París, Francia; Richard Mindham, Reino Unido, ESC Patient Forum, Sophia Antipolis, Francia; Claudio Muneretto, Cardiothoracic Surgery, Asst Spedali Civili University of Brescia, Brescia, Italia; Massimo Francesco Piepoli, Cardiology, Guglielmo da Saliceto Hospital, AUSL Piacenza, Piacenza, Italia; Susanna Price, Cardiology & Adult Intensive Care Unit, Royal Brompton Hospital, Londres, Reino Unido; Giuseppe M.C. Rosano, IRCCS San Raffaele, Roma, Italia; Frank Ruschitzka, Department of Cardiology, University Hospital Zurich, Zurich, Suiza, y Anne Kathrine Skibelund, Dinamarca, ESC Patient Forum, Sophia Antipolis, Francia.
21ANEXOGrupo para la elaboración de documentos científicos de la ESC
Incluye a los revisores del documento y las sociedades de cardiología nacionales que forman parte de la ESC.
Revisores del documento: Rudolf A. de Boer (coordinador de revisión de GPC), (Países Bajos), P. Christian Schulze (coordinador de revisión de GPC) (Alemania), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Stamatis Adamopoulos (Grecia), Stefan D. Anker (Alemania), Elena Arbelo (España), Riccardo Asteggiano (Italia), Johann Bauersachs (Alemania), Antoni Bayés-Genís (España), Michael A. Borger (Alemania), Werner Budts (Bélgica), Maja Cikes (Croacia), Kevin Damman (Países Bajos), Victoria Delgado (Países Bajos), Paul Dendale (Bélgica), Polychronis Dilaveris (Grecia), Heinz Drexel (Austria), Justin Ezekowitz (Canadá), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Gerasimos Filippatos (Grecia), Alan Fraser (Reino Unido), Norbert Frey (Alemania), Chris P. Gale (Reino Unido), Finn Gustafsson (Dinamarca), Julie Harris (Reino Unido), Bernard Iung (Francia), Stefan Janssens (Bélgica), Mariell Jessup (Estados Unidos), Aleksandra Konradi (Rusia), Dipak Kotecha (Reino Unido), Ekatirini Lambrinou (Chipre), Patrizio Lancellotti (Bélgica), Ulf Landmesser (Alemania), Christophe Leclercq (Francia), Basil S. Lewis (Israel), Francisco Leyva (Reino Unido), Aleš Linhart (República Checa), Maja-Lisa Løchen (Noruega), Lars H. Lund (Suecia), Donna Mancini (Estados Unidos), Josep Masip (España), Davor Milicic (Croacia), Christian Mueller (Suiza), Holger Nef (Alemania), Jens-Cosedis Nielsen (Dinamarca), Lis Neubeck (Reino Unido), Michel Noutsias (Alemania), Steffen E. Petersen (Reino Unido), Anna Sonia Petronio (Italia), Piotr Ponikowski (Polonia), Eva Prescott (Dinamarca), Amina Rakisheva (Kazajstán), Dimitrios Richter (Grecia), Evgeny Schlyakhto (Rusia), Petar Seferovic (Serbia), Michele Senni (Italia), Marta Sitges (España), Miguel Sousa-Uva (Portugal), Carlo Gabriele Tocchetti (Italia), Rhian Touyz (Reino Unido), Carsten Tschoepe (Alemania) y Johannes Waltenberger (Alemania).
Sociedades nacionales de la ESC que participaron activamente en el proceso de revisión de la GPC ESC 2021 sobre el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica
Alemania: German Cardiac Society, Johann Bauersachs; Argelia: Algerian Society of Cardiology, Messaad Krim; Armenia: Armenian Cardiologists Association, Hamlet Hayrapetyan; Austria: Austrian Society of Cardiology, Deddo Moertl; Azerbayán: Azerbaijan Society of Cardiology, Isakh Mustafayev; Bélgica: Belgian Society of Cardiology, Michel Depauw; Bielorrusia: Belorussian Scientific Society of Cardiologists, Alena Kurlianskaya; Bosnia-Herzegovina: Association of Cardiologists of Bosnia and Herzegovina, Zumreta Kušljugić; Bulgaria: Bulgarian Society of Cardiology, Plamen Gatzov; Chipre: Cyprus Society of Cardiology, Petros Agathangelou; Croacia: Croatian Cardiac Society, Davor Milicic; Dinamarca: Danish Society of Cardiology, Brian Bridal Løgstrup; Egipto: Egyptian Society of Cardiology, Ahmed Magdy Mostafa; Eslovaquia: Slovak Society of Cardiology, Eva Goncalvesova; Eslovenia: Slovenian Society of Cardiology, Zlatko Fras; España: Sociedad Española de Cardiología, Javier Segovia; Estonia: Estonian Society of Cardiology, Tiina Uuetoa; Federación Rusa: Russian Society of Cardiology, Yury Lopatin; Finlandia: Finnish Cardiac Society, Johan Lassus; Francia: French Society of Cardiology, Damien Logeart; Georgia: Georgian Society of Cardiology, Zviad Kipiani; Grecia: Hellenic Society of Cardiology, Christina Chrysohoou; Hungría: Hungarian Society of Cardiology, Róbert Sepp; Irlanda: Irish Cardiac Society, Jim O’Neill; Islandia: Icelandic Society of Cardiology, Inga Jóna Ingimarsdóttir; Israel: Israel Heart Society, Israel Gotsman; Italia: Italian Federation of Cardiology, Massimo Iacoviello; Kazajistán: Association of Cardiologists of Kazakhstan, Amina Rakisheva; Kirguistán: Kyrgyz Society of Cardiology, Olga Lunegova; Kosovo (República de): Kosovo Society of Cardiology, Gani Bajraktari; Letonia: Latvian Society of Cardiology, Ginta Kamzola; Líbano: Lebanese Society of Cardiology, Tony Abdel Massih; Libia: Libyan Cardiac Society, Hisham Benlamin; Lituania: Lithuanian Society of Cardiology, Diana Žaliaduonytė; Luxemburgo: Luxembourg Society of Cardiology, Stephanie Noppe; Macedonia del Norte: North Macedonian Society of Cardiology, Elizabeta Srbinovska Kostovska; Malta: Maltese Cardiac Society, Alice Moore; Marruecos: Moroccan Society of Cardiology, Ahmed Bennis; Moldavia (República de): Moldovian Society of Cardiology, Eleonora Vataman; Montenegro: Montenegro Society of Cardiology, Aneta Boskovic; Noruega: Norwegian Society of Cardiology, Geeta Gulati; Países Bajos: Netherlands Society of Cardiology, Olivier C. Manintveld; Polonia: Polish Cardiac Society, Ewa Straburzyńska-Migaj; Portugal: Portuguese Society of Cardiology, José Silva-Cardoso; Reino Unido: British Cardiovascular Society, Ceri Davies; República Árabe Siria: Syrian Cardiovascular Association, Walid Bsata; República Checa: Czech Society of Cardiology, Vojtěch Melenovský; Rumanía: Romanian Society of Cardiology, Roxana Cristina Rimbas; San Marino: San Marino Society of Cardiology, Marina Foscoli; Serbia: Cardiology Society of Serbia, Sinisa Stojkovic; Suecia: Swedish Society of Cardiology, Krister Lindmark; Suiza: Swiss Society of Cardiology, Micha T. Maeder; Túnez: Tunisian Society of Cardiology and Cardio-Vascular Surgery, Leila Abid; Turquía: Turkish Society of Cardiology, Hakan Altay; Ucrania: Ukrainian Association of Cardiology, Leonid Voronkov, y Uzbekistán: Association of Cardiologists of Uzbekistan, Timur Abdullaev.
Comité de la ESC para la elaboración de guías de práctica clínica (GPC): Colin N. Baigent (coordinador) (Reino Unido), Magdy Abdelhamid (Egipto), Victor Aboyans (Francia), Sotiris Antoniou (Reino Unido), Elena Arbelo (España), Riccardo Asteggiano (Italia), Andreas Baumbach (Reino Unido), Michael A. Borger (Alemania), Jelena Čelutkienė (Lituania), Maja Cikes (Croacia), Jean-Philippe Collet (Francia), Volkmar Falk (Alemania), Laurent Fauchier (Francia), Chris P. Gale (Reino Unido), Sigrun Halvorsen (Noruega), Bernard Iung (Francia), Tiny Jaarsma (Suecia), Aleksandra Konradi (Rusia), Konstantinos C. Koskinas (Suiza), Dipak Kotecha (Reino Unido), Ulf Landmesser (Alemania), Basil S. Lewis (Israel), Ales Linhart (República Checa), Maja-Lisa Løchen (Noruega), Jens-Cosedis Nielsen (Dinamarca), Steffen E. Petersen (Reino Unido), Eva Prescott (Dinamarca), Lis Neubeck (Reino Unido), Amina Rakisheva (Kazajstán), Marta Sitges (España) y Rhian M. Touyz (Reino Unido).
Las filiaciones de los autores y miembros del Grupo de Trabajo se recogen en el anexo.La lista de miembros del Comité de la ESC para la elaboración de Guías de Práctica Clínica y los revisores de las sociedades nacionales se recoge en el anexo.Entidades de la ESC que han participado en la elaboración de este documento:Asociaciones: Association for Acute CardioVascular Care (ACVC), Association of Cardiovascular Nursing & Allied Professions (ACNAP), European Association of Cardiovascular Imaging (EACVI), European Association of Preventive Cardiology (EAPC), European Association of Percutaneous Cardiovascular Interventions (EAPCI), European Heart Rhythm Association (EHRA) y Heart Failure Association (HFA).Consejos: Council of Cardio-Oncology, Council on Basic Cardiovascular Science y Council on Valvular Heart Disease.Grupos de Trabajo: Cardiopatías Congénitas en el Adulto, Farmacoterapia Cardiovascular, Medicina Cardiovascular Reparadora y Regenerativa, Cirugía Cardiovascular, e-Cardiología, Enfermedades Miocárdicas y Pericárdicas, y Función Miocárdica.Foro de pacientesEl contenido de esta GPC de la ESC se publica exclusivamente para uso personal y educativo. No se autoriza su uso comercial. No se autoriza la traducción o reproducción de ningún fragmento de esta guía sin la autorización escrita de la ESC. La autorización se solicitará por escrito a Oxford University Press, editorial de European Heart Journal y representante autorizado de la ESC para estas cuestiones (journals.permissions@oxfordjournals.org).Descargo de responsabilidad. Esta guía recoge la opinión de la ESC y se ha elaborado tras el estudio minucioso de los datos y la evidencia disponibles hasta la fecha. La ESC no es responsable en caso de que exista alguna contradicción, discrepancia o ambigüedad entre la GPC de la ESC y cualquier otra recomendación oficial o GPC publicada por autoridades relevantes de la sanidad pública, particularmente en lo que se refiere al buen uso de la atención sanitaria y las estrategias terapéuticas. Se espera que los profesionales de la salud tengan en consideración esta GPC a la hora de tomar decisiones clínicas, así como al implementar estrategias médicas preventivas, diagnósticas o terapéuticas. No obstante, esta guía no anula la responsabilidad individual de cada profesional al tomar las decisiones oportunas relativas a cada paciente, de acuerdo con dicho paciente y, cuando fuera necesario, con su tutor o representante legal. Además, las GPC de la ESC no eximen al profesional médico de su obligación ética y profesional de consultar y considerar atentamente las recomendaciones y GPC actualizadas emitidas por autoridades sanitarias competentes. Es también responsabilidad del profesional verificar la normativa y la legislación sobre fármacos y dispositivos médicos a la hora de prescribirlos. El artículo se publica simultáneamente en European Heart Journal y European Journal of Heart Failure. © The European Society of Cardiology 2021. Reservados todos los derechos. Los artículos son idénticos a excepción de algunas diferencias estilísticas y ortográficas relativas al estilo de cada revista. Para la solicitud de autorizaciones, contacte con: journals.permissions@oxfordjournals.org.Las declaraciones de conflicto de intereses de todos los expertos que participaron en la elaboración de esta guía se recogen en un informe publicado simultáneamente en el material adicional. Este informe también está disponible en la página web de la ESC (www.escardio.org/guidelines). El material adicional incluye información sobre los antecedentes y una discusión detallada de los datos que han servido de base para la elaboración de la guía, y solo está disponible online y en inglés en la página web de European Heart Journal. Palabras clave:Guía de práctica clínica • Insuficiencia cardiaca • Péptidos natriuréticos • Fracción de eyección • Diagnóstico • Farmacoterapia • Antagonistas neurohormonales • Terapia de resincronización cardiaca • Asistencia circulatoria mecánica • Trasplante • Arritmias • Comorbilidades • Hospitalización • Atención multidisciplinaria • Insuficiencia cardiaca avanzada • Insuficiencia cardiaca aguda