La ventilación no invasiva (VNI) es capaz de reducir la necesidad de intubación endotraqueal y la mortalidad de los pacientes con insuficiencia cardiaca aguda (ICA). Sin embargo, de muchos de los ensayos clínicos se ha excluido a los pacientes con ICA secundaria a síndrome coronario agudo o infarto agudo de miocardio (SCA-IAM). El objetivo de este estudio es comparar la efectividad de la VNI entre pacientes con ICA desencadenada por SCA-IAM y por otras causas.
MétodosEstudio prospectivo de cohortes, durante un periodo de 20 años, de todos los pacientes con ICA tratados con VNI ingresados en una unidad de cuidados intensivos. Se agrupó a los pacientes por la presencia o ausencia de SCA-IAM como causante del evento de ICA. Se definió el fracaso de la VNI por la necesidad de intubación endotraqueal o muerte.
ResultadosSe analizó a 1.009 pacientes, 403 (40%) con SCA-IAM y 606 (60%) con otras etiologías. La VNI fracasó en 61 casos (15,1%) del grupo de SCA-IAM y 64 (10,6%) del grupo sin SCA-IAM (p=0,031), sin diferencias en la mortalidad hospitalaria (el 16,6 y el 14,9%; p=0,478).
ConclusionesEl SCA-IAM como causa desencadenante de la ICA no influye en el pronóstico de los pacientes con insuficiencia respiratoria aguda que precisan asistencia respiratoria no invasiva.
Palabras clave
La afección respiratoria es muy común en pacientes con insuficiencia cardiaca aguda (ICA)1. El aumento de la presión hidrostática en la vasculatura pulmonar, secundario al aumento de la presión en la aurícula izquierda, causa mayor acumulación de líquido en los espacios alveolar y pleural2. Esto, a su vez, ocasiona una disminución de la distensibilidad pulmonar, un aumento del trabajo respiratorio y la aparición de hipoxemia aguda y, con frecuencia, hipercapnia3.
Entre los desencadenantes de la ICA más frecuentes, están el síndrome coronario agudo y el infarto agudo de miocardio (SCA-IAM), pues puede afectar a una tercera parte de los pacientes, e incluso más entre los pacientes con ICA de inicio reciente o de novo4. Es frecuente la insuficiencia cardiaca como complicación del IAM5 y es uno de los principales factores pronósticos de muerte6,7.
En las últimas décadas se han producido cambios importantes en la incidencia y la evolución de los pacientes con insuficiencia cardiaca gracias a la introducción de nuevos fármacos, la creación de unidades especiales de diagnóstico y seguimiento, y los avances tecnológicos relacionados con las técnicas de revascularización miocárdica, cirugía cardiaca, asistencia ventricular extracorpórea y trasplante cardiaco1. Sin embargo, el tratamiento de la ICA en urgencias o en la unidad de cuidados intensivos (UCI) se ha mantenido sin cambios. La aplicación de ventilación no invasiva (VNI) en la ICA se ha estudiado ampliamente8. En un metanálisis reciente9, la aplicación de VNI redujo la necesidad de intubación y la mortalidad hospitalaria en comparación con la oxigenoterapia convencional. Con todo, en algunos ensayos clínicos se ha excluido a los pacientes con SCA-IAM. En consecuencia, la recomendación de VNI para pacientes con edema pulmonar cardiogénico agudo no puede aplicarse a pacientes con SCA10. Además, la ICA desencadenada por SCA-IAM se ha relacionado con un peor pronóstico, aunque los resultados de los estudios son contradictorios11–18.
Se plantea la hipótesis de que los pacientes con ICA por SCA-IAM tratados con VNI podrían tener un peor pronóstico. El objetivo principal de este estudio es analizar el fracaso de la VNI, definido como la necesidad de intubación o la muerte en la UCI de en pacientes con ICA con y sin SCA-IAM. Los objetivos secundarios son comparar la mortalidad hospitalaria y anual entre esos 2 grupos.
MÉTODOSPacientesEn este estudio de cohortes se estudió prospectivamente a todos los pacientes consecutivos ingresados con diagnóstico de ICA y tratados con VNI en una UCI de 18 camas de un hospital universitario. Se estudió a los pacientes ingresados entre enero de 1997 y diciembre de 2017. El estudio fue aprobado por el comité de ética del centro.
Se incluyó a los pacientes cuando se cumplían los siguientes criterios: a) criterios clínicos: disnea (frecuencia respiratoria> 30 respiraciones por minuto o actividad de los músculos respiratorios accesorios o respiración paradójica abdominal), exploración física (crepitantes bilaterales acompañados o no de sibilancias o auscultación de un tercer ruido cardiaco), ortopnea, insuficiencia respiratoria aguda grave o crónica sobre aguda (PaO2/FiO2 < 250mmHg o acidosis respiratoria —pH arterial <7,35 con PaCO2> 45mmHg—), y b) confirmación de congestión pulmonar (al menos 2 de los siguientes: signos de congestión pulmonar en una prueba de imagen torácica, 3 o más líneas B en la ecografía torácica en 2 áreas torácicas de cada hemitórax, elevación de la presión capilar pulmonar> 18mmHg por cateterismo cardiaco derecho, aumento del líquido total en los pulmones mediante análisis del contorno de la onda de pulso y termodilución, signos ecocardiográficos de elevación de las presiones de llenado ventricular y elevación importante de la fracción aminoterminal del propéptido natriurético cerebral por encima de los valores normales según la edad del paciente). Los criterios de exclusión fueron los considerados habitualmente19.
El episodio de ICA se clasificó según su etiología como secundario a SCA-IAM o por otra causa. El diagnóstico de SCA-IAM se estableció según los criterios vigentes en el momento del ingreso20–22. Durante los primeros años del estudio, los pacientes se clasificaron en infarto de miocardio sin onda Q e infarto de miocardio con onda Q. Estos pacientes fueron reclasificados posteriormente como SCA sin elevación del segmento ST e infarto de miocardio con elevación del segmento ST, o indeterminados (presencia de marcapasos o bloqueo completo de la rama izquierda del haz de His). Dos médicos de cuidados intensivos con amplia experiencia en pacientes coronarios evaluaron todos los electrocardiogramas y, en caso de duda, decidía la opinión de un tercer intensivista. El diagnóstico de IAM requería la corroboración del cardiólogo que atendió al paciente en la sala de ingresos.
La ICA de novo se definió como la ausencia de antecedentes de insuficiencia cardiaca23.
El tratamiento de los pacientes con ICA siguió la guía de práctica clínica vigente en el momento del ingreso hospitalario. El centro donde se realizó el estudio no contaba con laboratorio de cateterismo cardiaco y las pruebas coronarias se realizaron en el centro de referencia que se encuentra a 10km de distancia. El traslado se realizaba en ambulancia medicalizada con disponibilidad de VNI y personal médico y de enfermería con formación previa en este tratamiento. Entre 1997 y 1999, la intervención de aquellos pacientes que precisaban coronariografía urgente se realizaba durante la mañana del día de ingreso (8.00-15.00) o al día siguiente si ingresaban después de las 15.00. A partir del año 2000, la disponibilidad de coronariografía urgente se amplió a las 24h al día todos los días del año. Los estudios de coronariografía se definieron como inmediatos o primarios cuando se realizaban en el momento del diagnóstico de IAM con elevación del segmento ST (IAMCEST) o pospuestos si se realizaban al menos 24 h después del diagnóstico. El tratamiento de la ICA se basó principalmente en el uso de vasodilatadores y diuréticos del asa, ambos en perfusión continua. Todos los pacientes recibieron morfina por vía intravenosa para reducir la ansiedad y la disnea y mejorar la adaptación a la VNI, excepto aquellos con deterioro del nivel de conciencia. La dobutamina y el levosimendán se restringieron a los pacientes que no respondían al tratamiento inicial y mostraban una fracción de eyección del ventrículo izquierdo (FEVI) reducida en la ecografía cardiaca. A todos los pacientes se les realizó una ecocardiografía a pie de cama en las primeras 24 h de estancia en la UCI.
Protocolo de ventilación no invasivaLa VNI se realizó mediante ventiladores no invasivos específicos (ventilador BiPAP ST-D y ventilador VISION de Respironic Inc., Estados Unidos, y ventilador V60 de Phillips Respironic, Estados Unidos), utilizando presión positiva binivel en las vías respiratorias, como se había publicado anteriormente19. La superficie de contacto elegida en primer lugar fue la mascarilla facial, y la mascarilla facial nasal o total se utilizó cuando el paciente presentaba complicaciones relacionadas con la superficie de contacto. La VNI se iniciaba con una presión inspiratoria positiva en la vía aérea ≥ 12 cmH2O, con incrementos de 2-3 cmH2O si el paciente la toleraba y según la respuesta clínica, sin superar los 25 cmH2O. La presión espiratoria positiva inicialmente era de 5 cmH2O, y se iba aumentando de a 1-2 cmH2O para mejorar la hipoxemia o la comodidad del paciente. Si se utilizaba la modalidad de presión positiva continua en la vía aérea (PPCVA), por intolerancia a la modalidad binivel, se utilizaba una presión positiva continua de 7 cmH2O, con posibilidad de elevarla hasta 15 cmH2O. La fracción inspirada de oxígeno (FiO2) administrada fue la necesaria para alcanzar una SpO2 del 92%. Desde 2012 se ha utilizado la oxigenoterapia a alto flujo mediante cánula nasal para los pacientes que no toleran la VNI o para facilitar la retirada gradual, mientras se alternan los 2 dispositivos de terapia respiratoria.
Eficacia de la ventilación no invasivaSe asumió el fracaso de la VNI cuando el paciente mostraba un deterioro de los parámetros de intercambio gaseoso o empeoramiento de los síntomas y signos de insuficiencia respiratoria a pesar de la optimización de la configuración de la VNI que condujera a la intubación o la muerte durante la estancia en la UCI o durante las primeras 24h en planta tras el alta de la UCI, sin recuperación del proceso respiratorio que motivó la necesidad de asistencia ventilatoria no invasiva. En caso de fracaso de la VNI, se intubaba al paciente y se lo conectaba a ventilación mecánica invasiva, según los criterios publicados con anterioridad19.
MedicionesAl inicio del tratamiento con VNI se recogieron variables demográficas, clínicas y de laboratorio. Como en otros estudios, para cuantificar la comorbilidad de los pacientes, se utilizó el índice de comorbilidad de Charlson, se evaluó el grado de disfunción multiorgánica mediante el Sequential Organ index Failure Assessment (SOFA), que se calculaba a diario, y se obtuvo la gravedad de la enfermedad calculando el índice Simplified Acute Physiology Score II (SAPS II)14,19. La anemia se definió como una concentración de hemoglobina <12g/l en mujeres y <13g/l en varones. La localización del SCA-IAM se clasificó en anterior, inferior o indeterminado según las alteraciones mostradas en el electrocardiograma y la ecocardiografía. Los SCA-IAM de localización lateral se incluyeron en el grupo inferior o anterior, según la afección de estas regiones cardiacas. Las determinaciones de los marcadores de daño cardiaco cambiaron con el tiempo; se utilizó el valor de la fracción MB de la creatincinasa durante los primeros 5 años del estudio y posteriormente la troponina I. Se realizó un seguimiento de los pacientes hasta 1 año después del ingreso para analizar la mortalidad y los posibles reingresos.
Análisis estadísticoLas variables cualitativas se muestran como frecuencias absolutas y relativas, y las comparaciones entre ellas se realizaron mediante la prueba de la χ2 de Pearson o la prueba de Fisher. Las variables cuantitativas se expresan como media±desviación estándar o mediana [intervalo intercuartílico], y las comparaciones entre grupos independientes se realizaron mediante la prueba de la t de Student o la prueba de la U de Mann-Whitney si la variable no seguía una distribución normal. La prueba de la t de Student se utilizó con los datos relacionados para analizar las variables cuantitativas medidas antes y después del inicio de la VNI. Las medidas de asociación analizadas fueron las odds ratio (OR) con sus intervalos de confianza del 95% (IC95%). Los cambios por año se evaluaron mediante análisis de supervivencia y comparación entre grupos mediante análisis de Cox. Se realizó un análisis de propensión para datos emparejados por el método del «vecino más cercano» en relación 1:1, con las variables de emparejamiento: edad, sexo, SAPS II, SOFA inicial, índice de Charlson y presencia de orden de no intubar. Todos los análisis se realizaron mediante contraste bilateral y se consideró significativo un valor de p ≤ 0,05. El análisis se realizó con el programa SPSS 25.0 (IBM, Estados Unidos) y R versión 3.4.0 (R Foundation for Statistical Computing Platform).
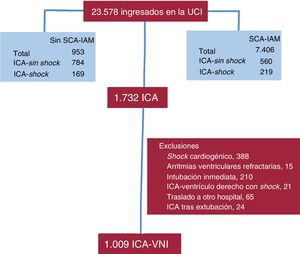
RESULTADOSDurante el periodo de estudio ingresaron en la UCI 7.406 pacientes con SCA-IAM, de los que 779 sufrían ICA. Además, hubo 953 ingresos por ICA sin SCA-IAM. Se evaluó a un total de 1.732 pacientes con ICA; Se excluyó a 723 por diferentes motivos y finalmente se analizó a 1.009 pacientes con ICA (figura 1).
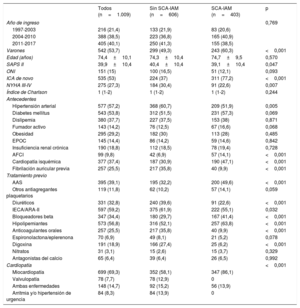
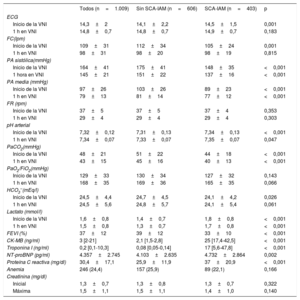
Las principales características de los pacientes se muestran en la tabla 1. Hubo un ligero predominio del sexo masculino (53,7%), con mayor número de varones en el grupo SCA-IAM. Sin embargo, la edad (media, 74 años) y el índice de comorbilidad no fueron diferentes en los 2 grupos. La puntuación SAPS II fue ligeramente superior en el grupo sin IAM. Entre los pacientes con SCA-IAM predominó la ICA de novo. Entre los antecedentes, la hipertensión y la fibrilación auricular previa fueron más frecuentes en el grupo sin infarto, mientras que los antecedentes familiares y la cardiopatía isquémica previa fueron más comunes en el grupo con SCA-IAM.
Variables demográficas y clínicas, antecedentes y tratamiento previo
| Todos (n=1.009) | Sin SCA-IAM (n=606) | SCA-IAM (n=403) | p | |
|---|---|---|---|---|
| Año de ingreso | 0,769 | |||
| 1997-2003 | 216 (21,4) | 133 (21,9) | 83 (20,6) | |
| 2004-2010 | 388 (38,5) | 223 (36,8) | 165 (40,9) | |
| 2011-2017 | 405 (40,1) | 250 (41,3) | 155 (38,5) | |
| Varones | 542 (53,7) | 299 (49,3) | 243 (60,3) | <0,001 |
| Edad (años) | 74,4±10,1 | 74,3±10,4 | 74,7±9,5 | 0,570 |
| SAPS II | 39,9±10,4 | 40,4±10,4 | 39,1±10,4 | 0,047 |
| ONI | 151 (15) | 100 (16,5) | 51 (12,1) | 0,093 |
| ICA de novo | 535 (53) | 224 (37) | 311 (77,2) | <0,001 |
| NYHA III-IV | 275 (27,3) | 184 (30,4) | 91 (22,6) | 0,007 |
| Índice de Charlson | 1 (1-2) | 1 (1-2) | 1 (1-2) | 0,244 |
| Antecedentes | ||||
| Hipertensión arterial | 577 (57,2) | 368 (60,7) | 209 (51,9) | 0,005 |
| Diabetes mellitus | 543 (53,8) | 312 (51,5) | 231 (57,3) | 0,069 |
| Dislipemia | 380 (37,7) | 227 (37,5) | 153 (38) | 0,871 |
| Fumador activo | 143 (14,2) | 76 (12,5) | 67 (16,6) | 0,068 |
| Obesidad | 295 (29,2) | 182 (30) | 113 (28) | 0,485 |
| EPOC | 145 (14,4) | 86 (14,2) | 59 (14,6) | 0,842 |
| Insuficiencia renal crónica | 190 (18,8) | 112 (18,5) | 78 (19,4) | 0,728 |
| AFCI | 99 (9,8) | 42 (6,9) | 57 (14,1) | <0,001 |
| Cardiopatía isquémica | 377 (37,4) | 187 (30,9) | 190 (47,1) | <0,001 |
| Fibrilación auricular previa | 257 (25,5) | 217 (35,8) | 40 (9,9) | <0,001 |
| Tratamiento previo | ||||
| AAS | 395 (39,1) | 195 (32,2) | 200 (49,6) | <0,001 |
| Otros antiagregantes plaquetarios | 119 (11,8) | 62 (10,2) | 57 (14,1) | 0,059 |
| Diuréticos | 331 (32,8) | 240 (39,6) | 91 (22,6) | <0,001 |
| IECA/ARA-II | 597 (59,2) | 375 (61,9) | 222 (55,1) | 0,032 |
| Bloqueadores beta | 347 (34,4) | 180 (29,7) | 167 (41,4) | <0,001 |
| Hipolipemiantes | 573 (56,8) | 316 (52,1) | 257 (63,8) | <0,001 |
| Anticoagulantes orales | 257 (25,5) | 217 (35,8) | 40 (9,9) | <0,001 |
| Espironolactona/eplerenona | 70 (6,9) | 49 (8,1) | 21 (5,2) | 0,078 |
| Digoxina | 191 (18,9) | 166 (27,4) | 25 (6,2) | <0,001 |
| Nitratos | 31 (3,1) | 15 (2,6) | 15 (3,7) | 0,329 |
| Antagonistas del calcio | 65 (6,4) | 39 (6,4) | 26 (6,5) | 0,992 |
| Cardiopatía | <0,001 | |||
| Miocardiopatía | 699 (69,3) | 352 (58,1) | 347 (86,1) | |
| Valvulopatía | 78 (7,7) | 78 (12,9) | 0 | |
| Ambas enfermedades | 148 (14,7) | 92 (15,2) | 56 (13,9) | |
| Arritmia y/o hipertensión de urgencia | 84 (8,3) | 84 (13,9) | 0 | |
AAS: ácido actilsalicílico; AFCI: antecedentes familiares de cardiopatía isquémica; ARA-II: antagonista del receptor de la angiotensina II; EPOC: enfermedad pulmonar obstructiva crónica; ICA: insuficiencia cardiaca aguda; IECA: inhibidores de la enzima de conversión de la angiotensina; NYHA: clase funcional de la New York Heart Association; ONI: orden de no intubar; SAPS: Simplified Acute Physiology Score; SCA-IAM: síndrome coronario agudo-infarto agudo de miocardio.
Los valores expresan n (%) o media±desviación estándar.
En el grupo con SCA-IAM, 186 pacientes (46,2%) tenían IAMCEST; 207 (51,4%), IAM sin elevación del segmento ST, y 10 (2,5%) no tenían atribución. La localización más frecuente del infarto fue la anterior (320 casos, 79,4%), seguida de la inferior (75 casos, 18,6%); 8 casos (2%) no tenían localización atribuida. Se realizó coronariografía en 369 pacientes (91,6%); en 133 (36%), la angiografía fue inmediata. Otros 20 pacientes (13,1%) recibieron fibrinolisis sistémica. El vaso culpable del SCA-IAM fue la arteria principal izquierda en 43 casos (11,7%), la arteria descendente anterior en 214 (58%), la arteria circunfleja en 49 (13,3%) y la arteria coronaria derecha en 63 casos (17,1%).
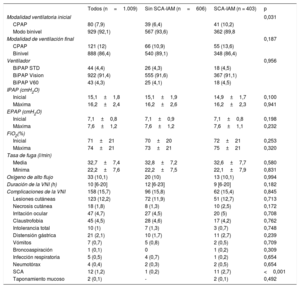
Medidas fisiológicasLos parámetros respiratorios, hemodinámicos y neurológicos antes y después de 1 h de VNI se presentan en la tabla 2. Los valores iniciales mostraron mayores presión arterial y frecuencia cardiaca en el grupo sin SCA-IAM con menor pH y mayor PaCO2, así como peor estado neurológico. También hubo diferencias en los valores de bicarbonato y lactato arterial de los 2 grupos, con cifras más bajas de bicarbonato y más altas de lactato en el grupo con SCA-IAM. Aunque estadísticamente significativas, estas diferencias no fueron clínicamente relevantes. En ambos grupos, todas las variables mejoraron significativamente en el momento de la terapia ventilatoria (todos, p <0,001), excepto el pH arterial y el bicarbonato sérico en el grupo de SCA-IAM y el bicarbonato sérico en el grupo sin SCA-IAM. La FEVI media de los pacientes analizados mostró mayor afección en el grupo SCA-IAM.
Variables neurológicas, hemodinámicas, respiratorias y de las pruebas analíticas
| Todos (n=1.009) | Sin SCA-IAM (n=606) | SCA-IAM (n=403) | p | |
|---|---|---|---|---|
| ECG | ||||
| Inicio de la VNI | 14,3±2 | 14,1±2,2 | 14,5±1,5 | 0,001 |
| 1 h en VNI | 14,8±0,7 | 14,8±0,7 | 14,9±0,7 | 0,183 |
| FC(lpm) | ||||
| Inicio de la VNI | 109±31 | 112±34 | 105±24 | 0,001 |
| 1 h en VNI | 98±31 | 98±20 | 98±19 | 0,815 |
| PA sistólica(mmHg) | ||||
| Inicio de la VNI | 164±41 | 175±41 | 148±35 | <0,001 |
| 1 hora en VNI | 145±21 | 151±22 | 137±16 | <0,001 |
| PA media (mmHg) | ||||
| Inicio de la VNI | 97±26 | 103±26 | 89±23 | <0,001 |
| 1 h en VNI | 79±13 | 81±14 | 77±12 | <0,001 |
| FR (rpm) | ||||
| Inicio de la VNI | 37±5 | 37±5 | 37±4 | 0,353 |
| 1 h en VNI | 29±4 | 29±4 | 29±4 | 0,303 |
| pH arterial | ||||
| Inicio de la VNI | 7,32±0,12 | 7,31±0,13 | 7,34±0,13 | <0,001 |
| 1 h en VNI | 7,34±0,07 | 7,33±0,07 | 7,35±0,07 | 0,047 |
| PaCO2(mmHg) | ||||
| Inicio de la VNI | 48±21 | 51±22 | 44±18 | <0,001 |
| 1 h en VNI | 43±15 | 45±16 | 40±13 | <0,001 |
| PaO2/FiO2(mmHg) | ||||
| Inicio de la VNI | 129±33 | 130±34 | 127±32 | 0,143 |
| 1 h en VNI | 168±35 | 169±36 | 165±35 | 0,066 |
| HCO3–(mEq/l) | ||||
| Inicio de la VNI | 24,5±4,4 | 24,7±4,5 | 24,1±4,2 | 0,026 |
| 1 h en VNI | 24,5±5,6 | 24,8±5,7 | 24,1±5,4 | 0,061 |
| Lactato (mmol/l) | ||||
| Inicio de la VNI | 1,6±0,8 | 1,4±0,7 | 1,8±0,8 | <0,001 |
| 1 h en VNI | 1,5±0,8 | 1,3±0,7 | 1,7±0,8 | <0,001 |
| FEVI (%) | 37±12 | 39±12 | 33±10 | <0,001 |
| CK-MB (ng/ml) | 3 [2-21] | 2,1 [1,5-2,8] | 25 [17,4-42,5] | <0,001 |
| Troponina I (ng/ml) | 0,2 [0,1-10,3] | 0,08 [0,05-0,14] | 17 [5,6-47,8] | <0,001 |
| NT-proBNP (pg/ml) | 4.357±2.745 | 4.103±2.635 | 4.732±2.864 | 0,002 |
| Proteína C reactiva (mg/dl) | 30,4±17,1 | 25,9±11,9 | 37±20,9 | <0,001 |
| Anemia | 246 (24,4) | 157 (25,9) | 89 (22,1) | 0,166 |
| Creatinina (mg/dl) | ||||
| Inicial | 1,3±0,7 | 1,3±0,8 | 1,3±0,7 | 0,322 |
| Máxima | 1,5±1,1 | 1,5±1,1 | 1,4±1,0 | 0,140 |
CK-MB: fracción MB de la creatincinasa; ECG: electrocardiograma; FC: frecuencia cardiaca; FEVI: fracción de eyección del ventrículo izquierdo; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; HCO3–: bicarbonato; NT-proBNP: fracción aminoterminal del prpéptido natriurético cerebral; PA: presión arterial; PaCO2: presión parcial de dióxido de carbono; PaO2: presión parcial de oxígeno; SCA-IAM: síndrome coronario agudo-infarto agudo de miocardio; VNI: ventilación no invasiva.
Los valores expresan media±desviación estándar o mediana [intervalo intercuartílico].
Se realizó ecocardiografía a 939 pacientes (con SCA-IAM 403 y sin SCA-IAM 536), determinación de CK-MB a 94 pacientes (con SCA-IAM 28 y sin SCA-IAM 66); troponina I a 915 pacientes (con SCA-IAM 375 y sin SCA-IAM 540), proteína C reactiva a 860 pacientes (con SCA-IAM 351 y sin SCA-IAM 509) y NT-proBNP a 736 pacientes (con SCA-IAM 293 y sin SCA-IAM 443).
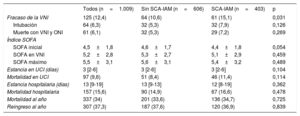
Al inicio de la asistencia ventilatoria, más pacientes con SCA-IAM recibieron presión positiva continua en la vía aérea (CPAP) (tabla 3). Todas las demás variables analizadas fueron semejantes entre los 2 grupos. Aunque la VNI duró más para los pacientes sin SCA-IAM, esta diferencia no fue estadísticamente significativa. Ni el número de pacientes con complicaciones ni la mayoría de ellos individualmente mostraron diferencias entre los 2 grupos. Solo 1 complicación, el dolor de causa coronaria, fue más frecuente en los pacientes con SCA-IAM durante el periodo de VNI.
Configuraciones ventilatorias
| Todos (n=1.009) | Sin SCA-IAM (n=606) | SCA-IAM (n = 403) | p | |
|---|---|---|---|---|
| Modalidad ventilatoria inicial | 0,031 | |||
| CPAP | 80 (7,9) | 39 (6,4) | 41 (10,2) | |
| Modo binivel | 929 (92,1) | 567 (93,6) | 362 (89,8 | |
| Modalidad de ventilación final | 0,187 | |||
| CPAP | 121 (12) | 66 (10,9) | 55 (13,6) | |
| Binivel | 888 (86,4) | 540 (89,1) | 348 (86,4) | |
| Ventilador | 0,956 | |||
| BiPAP STD | 44 (4,4) | 26 (4,3) | 18 (4,5) | |
| BiPAP Vision | 922 (91,4) | 555 (91,6) | 367 (91,1) | |
| BiPAP V60 | 43 (4,3) | 25 (4,1) | 18 (4,5) | |
| IPAP (cmH2O) | ||||
| Inicial | 15,1±1,8 | 15,1±1,9 | 14,9±1,7 | 0,100 |
| Máxima | 16,2±2,4 | 16,2±2,6 | 16,2±2,3 | 0,941 |
| EPAP (cmH2O) | ||||
| Inicial | 7,1±0,8 | 7,1±0,9 | 7,1±0,8 | 0,198 |
| Máxima | 7,6±1,2 | 7,6±1,2 | 7,6±1,1 | 0,232 |
| FiO2(%) | ||||
| Inicial | 71±21 | 70±20 | 72±21 | 0,253 |
| Máxima | 74±21 | 73±21 | 75±21 | 0,320 |
| Tasa de fuga (l/min) | ||||
| Media | 32,7±7,4 | 32,8±7,2 | 32,6±7,7 | 0,580 |
| Mínima | 22,2±7,6 | 22,2±7,5 | 22,1±7,9 | 0,831 |
| Oxígeno de alto flujo | 33 (10,1) | 20 (10) | 13 (10,1) | 0,994 |
| Duración de la VNI (h) | 10 [6-20] | 12 [6-23] | 9 [6-20] | 0,182 |
| Complicaciones de la VNI | 158 (15,7) | 96 (15,8) | 62 (15,4) | 0,845 |
| Lesiones cutáneas | 123 (12,2) | 72 (11,9) | 51 (12,7) | 0,713 |
| Necrosis cutánea | 18 (1,8) | 8 (1,3) | 10 (2,5) | 0,172 |
| Irritación ocular | 47 (4,7) | 27 (4,5) | 20 (5) | 0,708 |
| Claustrofobia | 45 (4,5) | 28 (4,6) | 17 (4,2) | 0,762 |
| Intolerancia total | 10 (1) | 7 (1,3) | 3 (0,7) | 0,748 |
| Distensión gástrica | 21 (2,1) | 10 (1,7) | 11 (2,7) | 0,239 |
| Vómitos | 7 (0,7) | 5 (0,8) | 2 (0,5) | 0,709 |
| Broncoaspiración | 1 (0,1) | 0 | 1 (0,2) | 0,309 |
| Infección respiratoria | 5 (0,5) | 4 (0,7) | 1 (0,2) | 0,654 |
| Neumotórax | 4 (0,4) | 2 (0,3) | 2 (0,5) | 0,654 |
| SCA | 12 (1,2) | 1 (0,2) | 11 (2,7) | <0,001 |
| Taponamiento mucoso | 2 (0,1) | - | 2 (0,1) | 0,492 |
CPAP: presión positiva continua en la vía aérea; EPAP: presión espiratoria positiva en la vía aérea; FiO2: fracción inspiratoria de oxígeno; IPAP: presión inspiratoria positiva en la vía aérea; SCA: síndrome coronario agudo; SCA-IAM: síndrome coronario agudo-infarto agudo de miocardio; VNI: ventilación no invasiva.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
Ni la puntuación inicial del índice SOFA ni las puntuaciones posteriores durante la VNI o la estancia en la UCI fueron diferentes entre los grupos (tabla 4). Aunque el fracaso de la VNI (necesidad de intubación o muerte durante la VNI con orden de no intubar), la mortalidad en la UCI, en el hospital y a 1 año fueron ligeramente superiores en el grupo con SCA-IAM, estas diferencias no fueron estadísticamente significativas. Hubo 101 muertes (80,8%) de pacientes con fracaso de la VNI y 56 (6,3%) de pacientes con VNI satisfactoria (p <0,001). La relación entre el fracaso de la VNI y la mortalidad hospitalaria se observó en pacientes tanto con (OR=73,501; IC95%, 33,364-161,918) como en pacientes sin SCA-IAM (OR=57,474; IC95%, 28,284-116,786).
Evolución de los pacientes
| Todos (n=1.009) | Sin SCA-IAM (n=606) | SCA-IAM (n=403) | p | |
|---|---|---|---|---|
| Fracaso de la VNI | 125 (12,4) | 64 (10,6) | 61 (15,1) | 0,031 |
| Intubación | 64 (6,3) | 32 (5,3) | 32 (7,9) | 0,126 |
| Muerte con VNI y ONI | 61 (6,1) | 32 (5,3) | 29 (7,2) | 0,269 |
| Índice SOFA | ||||
| SOFA inicial | 4,5±1,8 | 4,6±1,7 | 4,4±1,8 | 0,054 |
| SOFA en VNI | 5,2±2,8 | 5,3±2,7 | 5,1±2,9 | 0,459 |
| SOFA máximo | 5,5±3,1 | 5,6±3,1 | 5,4±3,2 | 0,489 |
| Estancia en UCI (días) | 3 [2-6] | 3 [2-6] | 3 [2-6] | 0,104 |
| Mortalidad en UCI | 97 (9,6) | 51 (8,4) | 46 (11,4) | 0,114 |
| Estancia hospitalaria (días) | 13 [9-19] | 13 [9-13] | 12 [8-19] | 0,362 |
| Mortalidad hospitalaria | 157 (15,6) | 90 (14,9) | 67 (16,6) | 0,478 |
| Mortalidad al año | 337 (34) | 201 (33,6) | 136 (34,7) | 0,725 |
| Reingreso al año | 307 (37,3) | 187 (37,6) | 120 (36,9) | 0,839 |
ONI: orden de no intubar; SCA-IAM: síndrome coronario agudo-infarto agudo de miocardio; SOFA: Sequential Organ Failure Assessment; UCI: unidad de cuidados intensivos; VNI: ventilación no invasiva.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
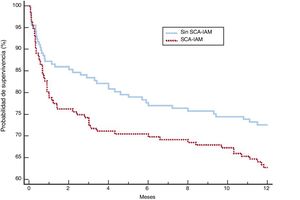
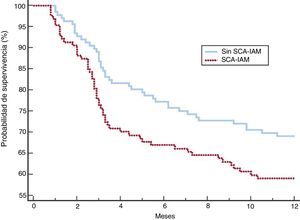
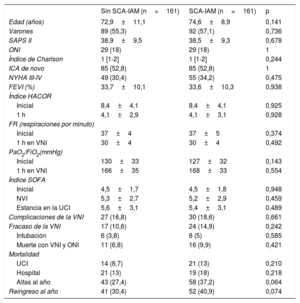
Después del ajuste, los 2 grupos de pacientes mostraron una distribución más equilibrada de las variables (tabla 5). Aunque las complicaciones, el fracaso de la VNI, la mortalidad en la UCI y la mortalidad hospitalaria fueron más frecuentes en el grupo con SCA-IAM, estas diferencias no fueron significativas. El mayor riesgo de fracaso de la VNI en el grupo de SCA-IAM fue del 4,3% (IC95%, –2,3% a 2,4%) y el de muerte hospitalaria, del 5% (IC95%, –2,3% a 2,5%). La mortalidad al año (figura 2) mostró una hazard ratio ajustada de 1,456 (IC95%, 0,986-2,152) en el grupo de SCA-IAM (p=0,059). El reingreso hospitalario por año se muestra en la figura 3. La hazard ratio ajustada de reingreso en el grupo de SCA-IAM fue 1,467 (IC95%, 0,977-2,201) (p=0,062).
Comparación de las características demográficas y clínicas y la evolución en los 2 grupos de pacientes de los grupos emparejados por análisis de propensión
| Sin SCA-IAM (n=161) | SCA-IAM (n=161) | p | |
|---|---|---|---|
| Edad (años) | 72,9±11,1 | 74,6±8,9 | 0,141 |
| Varones | 89 (55,3) | 92 (57,1) | 0,736 |
| SAPS II | 38,9±9,5 | 38,5±9,3 | 0,678 |
| ONI | 29 (18) | 29 (18) | 1 |
| Índice de Charlson | 1 [1-2] | 1 [1-2] | 0,244 |
| ICA de novo | 85 (52,8) | 85 (52,8) | 1 |
| NYHA III-IV | 49 (30,4) | 55 (34,2) | 0,475 |
| FEVI (%) | 33,7±10,1 | 33,6±10,3 | 0,938 |
| Índice HACOR | |||
| Inicial | 8,4±4,1 | 8,4±4,1 | 0,925 |
| 1 h | 4,1±2,9 | 4,1±3,1 | 0,928 |
| FR (respiraciones por minuto) | |||
| Inicial | 37±4 | 37±5 | 0,374 |
| 1 h en VNI | 30±4 | 30±4 | 0,492 |
| PaO2/FiO2(mmHg) | |||
| Inicial | 130±33 | 127±32 | 0,143 |
| 1 h en VNI | 166±35 | 168±33 | 0,554 |
| Índice SOFA | |||
| Inicial | 4,5±1,7 | 4,5±1,8 | 0,948 |
| NVI | 5,3±2,7 | 5,2±2,9 | 0,459 |
| Estancia en la UCI | 5,6±3,1 | 5,4±3,1 | 0,489 |
| Complicaciones de la VNI | 27 (16,8) | 30 (18,6) | 0,661 |
| Fracaso de la VNI | 17 (10,6) | 24 (14,9) | 0,242 |
| Intubación | 6 (3,8) | 8 (5) | 0,585 |
| Muerte con VNI y ONI | 11 (6,8) | 16 (9,9) | 0,421 |
| Mortalidad | |||
| UCI | 14 (8,7) | 21 (13) | 0,210 |
| Hospital | 21 (13) | 19 (18) | 0,218 |
| Altas al año | 43 (27,4) | 58 (37,2) | 0,064 |
| Reingreso al año | 41 (30,4) | 52 (40,9) | 0,074 |
FEVI: fracción de eyección del ventrículo izquierdo; FiO2: fracción inspiratoria de oxígeno; FR: frecuencia respiratoria; HACOR: escala de predicción de fracaso de la VNI [H: frecuencia cardiaca; A: acidosis; C: conciencia; O: oxigenación; R: frecuencia respiratoria]; ICA: insuficiencia cardiaca aguda; NYHA: clase funcional de la New York Heart Association; ONI: orden de no intubar; PaO2: presión parcial de oxígeno; SAPS: Simplified Acute Physiology Score; SCA-IAM: síndrome coronario agudo-infarto agudo de miocardio; SOFA: Sequential Organ Failure Assessment; UCI: unidad de cuidados intensivos; VNI: ventilación no invasiva.
Los valores expresan n (%), media±desviación estándar o mediana [intervalo intercuartílico].
En esta gran serie de pacientes con ICA tratados con VNI, la presencia de IAM no mostró un peor pronóstico que la ICA por otras causas.
La importancia de la ICA en los pacientes hospitalizados tras un IAM está determinada por 2 factores: por un lado, su elevada incidencia y, por otro, su peor pronóstico24,25. La presencia de SCA-IAM como desencadenante de un episodio de ICA es muy variable. En nuestro estudio, el 5,4% de los pacientes ingresados con SCA-IAM presentaban ICA que requirió VNI, muy por encima del 0,4% de los pacientes con IAMCEST tratados con VNI en la base de datos de la American National Inpatient Sample26. En el 40% de nuestros pacientes con ICA, esta se relacionó con la presencia de IAM, valor semejante al 32% comunicado por el estudio FINN-AKVA11. Tanto en estudios observaciones como en estudios aleatorizados en pacientes con ICA tratados con VNI, que incluyeron a pacientes con IAM, la prevalencia de SCA-IAM como causa del episodio fue muy variable, pues osciló entre el 17,227 y el 72,9%17 en los estudios observacionales y entre el 5,528 y el 70,4%29 en estudios aleatorizados. Se ha establecido claramente un peor pronóstico en pacientes con IAM que presentan ICA6,26. Más controvertido es si el SCA-IAM que desencadena el episodio de ICA se asocia con peor pronóstico que otros desencadenantes. Tarvasmäki et al. 11 comunicaron mayor mortalidad hospitalaria en el estudio finlandés Finn-AKVA en pacientes con ICA por IAM, pero no hubo una gran diferencia en la mortalidad a 5 años entre los 2 grupos. En un estudio realizado durante 11 años, Figueras et al.12 estudiaron a 806 pacientes con edema agudo de pulmón cardiogénico: la mortalidad hospitalaria no fue diferente entre los pacientes con y sin enfermedad coronaria, aunque a los 4 años la mortalidad fue mayor en el primer grupo. Entre los pacientes con ICA tratados con VNI, los resultados continúan siendo contradictorios. En una serie de 29 pacientes con edema pulmonar tratados con VNI, esta fue satisfactoria en los 5 casos con IAM27. Sin embargo, Rustherholz et al. mostraron que la presencia de IAM estaba relacionada con el fracaso de la VNI. En nuestra serie, el grupo con SCA-IAM tuvo un aumento considerable de fracasos de la VNI y mayor mortalidad en la UCI, hospitalaria y al año, pero sin alcanzar significación estadística, algo parecido a los resultados de Lazzeri et al.16. En ese estudio, la mortalidad en la UCI fue especialmente alta, el 38,5% de los pacientes con IAM y del 30,8% de los del grupo sin infarto, muy por encima de la mortalidad en nuestro estudio (el 11,4 y el 8,4% respectivamente), probablemente por la inclusión de pacientes con shock cardiogénico. Otros estudios han comunicado esta falta de asociación entre SCA y mayor mortalidad. En una serie de 118 pacientes con ICA tratados con VNI, como pacientes con shock cardiogénico, la presencia de IAM como causa de insuficiencia cardiaca no se relacionó con un peor pronóstico17. Yamamoto et al.15 realizaron un estudio retrospectivo en 206 pacientes con edema agudo de pulmón tratados con VNI, 53 de ellos con IAM. Aunque las tasas de intubación endotraqueal y de mortalidad en la UCI y hospitalaria fueron mayores en el grupo con IAM, las diferencias no alcanzaron significación estadística15. Para analizar con mayor precisión la relación entre la presencia de SCA-IAM y un peor resultado, se realizó el emparejamiento mediante análisis de puntuación de propensión. Esto produjo 2 grupos de pacientes con variables de pronóstico más equilibradas. Si bien la tasa de fracaso de la VNI, la mortalidad hospitalaria y al año y los reingresos hospitalarios fueron más frecuentes en el grupo con SCA-IAM, las diferencias entre los 2 grupos no alcanzaron significación estadística. El término fracaso de la VNI utilizado en este estudio es un objetivo combinado de necesidad de intubación o muerte en la UCI o en planta en pacientes sin resolución del episodio de ICA. Con esta definición se intentó evitar el sesgo que originan los pacientes con orden de no intubar, para quienes se descarta la intubación30. La ausencia de resolución del episodio de ICA es un factor de mal pronóstico en pacientes con o sin limitación del esfuerzo terapéutico14,17,29.
Al analizar las características de los pacientes con y sin SCA-IAM, numerosas variables mostraron diferencias entre los 2 grupos. Nuestra serie mostró mayor porcentaje de varones en el grupo con SCA-IAM, dato que también se observó en otras series de casos, pero sin alcanzar significación estadística11,15,16. Entre los antecedentes clínicos, el antecedente de insuficiencia cardiaca aguda o crónica fue más frecuente en pacientes sin SCA-IAM, lo que confiere una peor clase funcional de la New York Heart Association. Este dato, así como un mayor porcentaje de pacientes con antecedentes de fibrilación auricular crónica, ha sido comunicado por otros autores11. En relación con las variables fisiológicas respiratorias, los pacientes sin SCA-IAM presentaron valores de PaCO2 más altos y pH más bajo, con una frecuencia respiratoria y una tasa de oxigenación semejantes. Esto podría estar relacionado con un mayor porcentaje de pacientes con ICA que con crónica en este grupo de pacientes. Los pacientes con SCA mostraron un valor de FEVI considerablemente menor. La FEVI media de los pacientes analizados fue del 37%, semejante a la que muestra la serie de Yamamoto et al.15 y claramente inferior a la de los pacientes del registro FINN-AKVA11. Estas diferencias pueden explicarse por la menor gravedad de los pacientes estudiados. En el estudio FINN-AKVA, solo el 24% de los pacientes requirieron asistencia respiratoria no invasiva11.
No está claro cuál es la modalidad ventilatoria ideal para pacientes con ICA. Tanto la aplicación de CPAP como la presión de soporte o el modo binivel se han utilizado ampliamente. Los estudios aleatorizados que compararon las 2 modalidades no mostraron diferencias en las tasas de intubación endotraqueal o de mortalidad9. En este estudio, la modalidad utilizada inicialmente fue binivel, que se cambió a modalidad CPAP en presencia de molestias o intolerancia; en estudios de otros autores15, la modalidad inicial fue la CPAP, que se cambió a VNI en ausencia de mejoría clínica. La respuesta más rápida a la terapia con VNI en comparación con la CPAP con una mejora precoz de los síntomas clínicos puede considerarse un factor importante cuando se utiliza una u otra modalidad de asistencia no invasiva, así como el ingreso del paciente en la UCI31. Las complicaciones relacionadas con la VNI fueron parecidas en los 2 grupos. Las complicaciones relacionadas con la VNI son frecuentes y están relacionadas con su duración14. La duración, los valores de los ajustes y el grado de fugas a través de la máscara no fueron diferentes entre los 2 grupos. Solo el nuevo dolor isquémico fue más frecuente en el grupo con SCA-IAM.
Puntos fuertes y débilesEste estudio tiene algunos puntos fuertes y débiles. Se trata de un gran estudio de cohortes prospectivo de pacientes con ICA seguidos durante 1 año que analizó numerosas variables clínicas y fisiológicas. Se realizó en el mundo real e incluyó a todos los pacientes consecutivos tratados con VNI. Además, el estudio incluyó un análisis de propensión para especificar más la relación entre la presencia de SCA-IAM y los resultados de los pacientes.
Un punto débil de este estudio es que se trata de un estudio observacional y, por lo tanto, propenso a numerosos sesgos a la hora de evaluar los resultados de la eficacia de la técnica ventilatoria. También se llevó a cabo durante un largo periodo, con los consiguientes cambios en algunas de las definiciones de las enfermedades analizadas; sin embargo, se ha intentado superar este punto débil mediante la homogeneización de los pacientes y el análisis de los datos registrados. Además, el largo periodo de estudio motiva variaciones en las características sociodemográficas, clínicas y de evolución de los pacientes, que pueden analizarse en futuros trabajos. Este estudio se realizó en una UCI con amplia experiencia en VNI, tanto en enfermedades cardiacas como pulmonares, con personal médico y de enfermería perfectamente formado, además de contar con una amplia gama de aparatos, ventiladores e interfaces que pueden afectar a la extrapolación de los resultados a otras áreas con menos experiencia o recursos. Por último, a pesar de la gran cantidad de variables recopiladas, es posible que se hayan omitido algunas variables importantes. A pesar de las limitaciones mencionadas, creemos que los resultados son perfectamente válidos.
CONCLUSIONESLa presencia de SCA-IAM como causa de ICA no influyó en la evolución de los pacientes con insuficiencia respiratoria aguda que requirieron asistencia respiratoria no invasiva. Las complicaciones derivadas de la VNI no fueron más frecuentes en los pacientes con SCA-IAM.
- –
La VNI es una estrategia importante en el tratamiento de la insuficiencia cardiaca aguda, pues reduce la necesidad de intubación endotraqueal y la mortalidad. Con frecuencia el SCA-IAM es el desencadenante de un episodio de ICA. La mayoría de los ensayos clínicos que evaluaron el papel de la VNI excluyeron a los pacientes con ICA desencadenada por SCA-IAM. El papel de la VNI en el tratamiento de la ICA en pacientes con SCA-IAM-SCA no se ha estudiado bien.
- –
La presencia de SCA-IAM como causa de ICA no confiere peor pronóstico a los pacientes con ICA que requieren asistencia respiratoria no invasiva. La mortalidad y el reingreso hospitalario al año se relacionaron con la presencia de SCA-IAM. Las complicaciones derivadas de la VNI no fueron más frecuentes en los pacientes con SCA-IAM.
Todos los autores han contribuido a la conceptualización del estudio, el tratamiento de los datos, el análisis formal, la investigación, la metodología, la validación, la redacción y la revisión. A. Carrillo-Alcaraz también contribuyó a la administración, el software y la supervisión del proyecto.
CONFLICTO DE INTERESESNinguno.