La congestión desempeña un papel fundamental en la patogénesis, la presentación y el pronóstico de la insuficiencia cardiaca y es un objetivo terapéutico importante. Sin embargo, su gravedad y su distribución por órganos y compartimentos varían mucho entre los pacientes, lo que ilustra la complejidad de este fenómeno. Aunque los síntomas y signos clínicos son útiles para evaluar la congestión y controlar el estado del volumen en un paciente individual, tienen poca sensibilidad y no permiten fenotipificar la congestión. Esto conduce a la incertidumbre diagnóstica y dificulta la toma de decisiones terapéuticas. En este artículo se ofrece una visión general actualizada de los biomarcadores circulantes, las modalidades de imagen (es decir, la ecografía cardiaca y extracardiaca) y las técnicas invasivas que podrían ayudar a los clínicos a identificar los diferentes perfiles de congestión y guiar la estrategia de tratamiento para esta población diversa de pacientes de alto riesgo con insuficiencia cardiaca.
Palabras clave
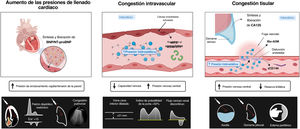
Tradicionalmente, la congestión en la insuficiencia cardiaca (IC) se ha considerado un concepto hemodinámico, definido como el aumento de las presiones de llenado centrales que con frecuencia provocan o son la consecuencia de la acumulación de líquidos en los compartimentos intra y extravascular1,2. Sin embargo, la congestión no es sinónimo de hipervolemia, ya que el aumento de la presión intracardiaca no siempre se asocia con la expansión total de la volemia y viceversa3.
La congestión y la acumulación de líquidos en la IC son el resultado de distintos mecanismos e interacciones complejas. La disfunción cardiaca provoca un aumento de la presión retrógrada y la redistribución del volumen. Además, conduce a la activación neurohormonal para mantener un volumen circulatorio efectivo y una presión de perfusión de órganos adecuada4. Estas respuestas biológicas causan avidez de sodio y agua por parte de los riñones, lo cual agrava y perpetúa la hipervolemia. Aunque la expansión total de la volemia se ha considerado clásicamente una afección homogénea, simple y pasiva, la evidencia actual respalda el papel de la acumulación de líquidos como un proceso complejo, heterogéneo y dinámico que modifica el curso natural de los síndromes de IC5,6.
FENOTIPOS DE CONGESTIÓNLa interacción compleja, heterogénea y dinámica entre los compartimentos de los líquidos intersticial e intravascular es una de las principales razones que explican la amplia variabilidad de la distribución y gravedad de la congestión/acumulación de líquidos entre los pacientes con IC.
Congestión intravascularEl aumento de las presiones de llenado centrales es una característica esencial de la mayoría de las descompensaciones de la IC1. Aunque esta elevación de las presiones de llenado se ha considerado clásicamente una consecuencia de la expansión total de la volemia y la incapacidad del corazón deteriorado de alojar y distribuir la volemia central, los cambios en la función de la capacidad venosa sistémica y pulmonar también desempeñan un papel fundamental y no reconocido en la regulación de la hemodinámica central.
El sistema venoso puede almacenar grandes cantidades de líquidos (aproximadamente, el 70% de la volemia total), principalmente distribuido en la vasculatura esplácnica de baja resistencia y alta capacidad (que almacena hasta el 20-30% de la volemia total, sin estrés). Sin embargo, este sistema de «reservorio venoso» contiene grandes cantidades de receptores adrenérgicos α1 y α2, lo que los convierte en altamente sensibles a la estimulación por parte del sistema nervioso simpático7. Por tanto, el deterioro de la capacidad de almacenamiento o el aumento del tono simpático pueden provocar un cambio de volumen casi instantáneo de los vasos esplácnicos a la circulación central, lo que conduce a aumentos en la precarga sin cambios en la volemia total8. Varios estudios han establecido una mala correlación entre las presiones intracardiacas y la medición directa de la volemia circulante o el cambio de peso, lo que contradice el concepto de que la retención de sodio y agua son los únicos impulsores de los aumentos de la presión de llenado3,9–11.
Congestión de tejidos/hipervolemiaLa retención de líquidos conduce a un aumento progresivo y sostenido de las presiones hidrostáticas en el compartimento vascular. Junto con otros factores, como la permeabilidad vascular y las fuerzas de Starling entre el plasma y el intersticio, una parte de la hipervolemia se desplaza hacia el compartimento intersticial debido a la filtración capilar neta12. A causa del notable aumento de la función linfática13, el líquido intersticial se drena inicialmente de manera eficiente, sin acumulación de líquidos. Sin embargo, cuando el flujo linfático alcanza una meseta, la tasa de trasudado desde los capilares hacia el intersticio excede la capacidad linfática y los líquidos comienzan a acumularse en el espacio intersticial14. Varios mecanismos pueden provocar la desregulación linfática en pacientes con IC. Entre ellos, la disminución del drenaje linfático debido a una elevación de la presión venosa central (PVC), la alteración de la integridad y la distensibilidad de los vasos linfáticos, la disfunción de la válvula linfática, la alteración de la linfodinámica renal y la inadaptación de la linfangiogénesis contribuyen a la acumulación de líquido intersticial15. Es importante destacar que el intersticio comprende una red de glucosaminoglucanos (GAG), colágeno y fibras de elastina que intentan mantener la estructura intersticial y actúan como amortiguadores, ya que la mayoría de las moléculas del agua y los cationes, como el sodio en el espacio intersticial, se unen a estos GAG14. Sin embargo, la saturación de GAG a largo plazo y el aumento de la permeabilidad debido a diversas afecciones, como diabetes o inflamación, alterarán la integridad de esta red y provocarán la congestión tisular.
EVALUACIÓN DE LA CONGESTIÓN INTRAVASCULAREvaluación invasivaLa congestión o el aumento de las presiones de llenado de los ventrículos derecho e izquierdo es una característica distintiva de la IC descompensada16. El cateterismo cardiaco derecho es el método más preciso para evaluar la elevación de las presiones de llenado cardiaco midiendo directamente la presión de la aurícula derecha (PAD) y la presión de enclavamiento arterial pulmonar. Las altas presiones de llenado constantes generalmente preceden a las hospitalizaciones por IC y se ha sugerido el implante de dispositivos con sensores de presión en la arteria pulmonar (que controlan las presiones de la arteria pulmonar) para reducir las hospitalizaciones por IC17. Aunque se considera el método de referencia para diagnosticar la congestión intravascular18, el uso habitual de la evaluación invasiva es limitado debido a su complejidad técnica, coste elevado y disponibilidad. Además, la utilidad clínica de los tratamientos guiados por la presión debe evaluarse más ampliamente. Por ejemplo, en el contexto de la enfermedad aguda, la adición del cateterismo de la arteria pulmonar para guiar el tratamiento descongestivo no afectó a la mortalidad general y a la hospitalización en el estudio ESCAPE19.
De manera similar a las mediciones invasivas de presión de llenado cardiaco, el estado y la composición de la volemia también se pueden cuantificar con el analizador de la volemia (AV) aprobado clínicamente (BVA100TM, Daxor Corporation, EE. UU.), que utiliza como método de referencia la técnica de dilución del indicador con un marcador de albúmina marcada con yodo-131 para ofrecer una medición cuantitativa de la volemia total, el volumen plasmático y el volumen eritrocítico20. Curiosamente, los datos preliminares sugieren una desconexión entre las presiones intracardiacas y la medición directa de la volemia circulante utilizando esta tecnología3,10, y destaca el concepto de que la congestión es el producto de una interacción distinta entre la presión y el volumen cardiovasculares.
Síntomas y signosPresión venosa yugularEl aumento de la presión venosa yugular se considera uno de los signos físicos más valiosos que indican un aumento de las presiones de llenado centrales21. Sin embargo, su estimación precisa es difícil y hay una variabilidad interobservadores considerable22. Como consecuencia, la precisión notificada de la estimación de la PVC de las venas yugulares varía entre el 43 y el 79%23.
Ortopnea y clinodisneaLa posición supina aumenta la circulación sanguínea venosa desde las extremidades inferiores y los reservorios venosos, lo que puede aumentar el retorno venoso y elevar las presiones venosas y capilares pulmonares, y favorecer el agravamiento de los síntomas de disnea en posición supina. Además, el empeoramiento de la disnea al inclinarse hacia adelante se asocia con un aumento de la PAD, la presión de enclavamiento arterial pulmonar y otras características de congestión intravascular24.
Tercer ruido cardiacoEl tercer ruido cardiaco es el resultado del llenado rápido del ventrículo izquierdo (VI) diastólico y la brusca desaceleración de la circulación sanguínea auriculoventricular. Cuanto mayor sea el flujo de llenado transmitral y más pronunciado el llenado rápido, mayor será la desaceleración del llenado del VI y más probable será que se genere un tercer ruido cardiaco25. Por consiguiente, el tercer ruido cardiaco es un marcador indirecto del llenado diastólico restrictivo y, por tanto, del aumento de las presiones de llenado del VI. Muestra una alta especificidad, pero baja sensibilidad y también requiere experiencia clínica.
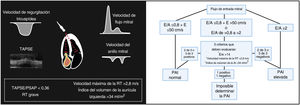
Evaluación ecográficaEcocardiografíaPresiones de llenado del lado izquierdoLa American Society of Echocardiography y la European Society of Cardiovascular Imaging han elaborado un algoritmo paso a paso para calcular las presiones de llenado, especialmente la presión auricular izquierda. Estos algoritmos integran las velocidades de entrada de onda pulsada mitral, la velocidad anular mitral (e’), la relación E/e’, la velocidad máxima del chorro de regurgitación tricuspídea (RT) y el índice de volumen máximo de la aurícula izquierda (figura 1)26. Este algoritmo ha demostrado una precisión general del 87% en las estimaciones de las presiones del VI, con un beneficio progresivo cuando se combina con la evaluación clínica27. Sin embargo, aunque este algoritmo funciona mejor al estimar las presiones de llenado del VI en individuos con IC y fracción de eyección del VI (FEVI) reducida, todavía se asocia con el pronóstico en aquellos individuos con fracción de eyección del VI conservada28.
Evaluación no invasiva de la presión de llenado cardiaco. La presión de llenado ventricular izquierdo elevada se define como una proporción E/A ≥2, o si E/A es <2, al menos 2 de los 3 parámetros mostrados deben estar por encima de los valores de corte. Los marcadores indirectos de la función del ventrículo derecho (VD), como el TAPSE y la relación TAPSE/presión sistólica de la arteria pulmonar (PSAP), y la gravedad de la regurgitación tricuspídea son marcadores no invasivos del aumento de las presiones de llenado del lado derecho. AI, aurícula izquierda; E/A, velocidad diastólica temprana mitral/proporción de velocidad diastólica auricular; E/e′, velocidad diastólica temprana mitral/proporción de velocidad e′ diastólica temprana media; PAD, presión de la aurícula izquierda; RT, regurgitación tricuspídea.
Los marcadores indirectos de la función del ventrículo derecho (VD), como el desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE) o la relación entre el TAPSE y la presión sistólica de la arteria pulmonar como un marcador global no invasivo del acoplamiento arterial pulmonar con el VD, están fuertemente asociados con el pronóstico29,30. La RT funcional es la consecuencia final del desacoplamiento arterial pulmonar del VD, la hipertensión pulmonar o la disfunción del VD que conduce a la hipervolemia, la congestión sistémica y un deterioro adicional del VD31. Hay 2 puntos importantes respecto a los parámetros ecocardiográficos del lado derecho en la IC. En primer lugar, la interacción entre ellos mejora la estratificación del riesgo. Los pacientes con desacoplamiento arterial pulmonar del VD y RT importante corren mayor riesgo de eventos después de un episodio de descompensación de la IC y están asociados con características de congestión sistémica grave32,33. En segundo lugar, parece que el valor predictivo y el impacto clínico de estos parámetros son mayores en pacientes con IC y FEVI conservada que en aquellos con FEVI reducida33. En la FEVI conservada, la disfunción cardiaca derecha-hipertensión pulmonar es un fenotipo establecido que se caracteriza por congestión sistémica grave y un mal pronóstico que comúnmente supera las características de la disfunción cardiaca izquierda. En cambio, en la FEVI reducida, la disfunción cardiaca derecha puede ser un marcador indirecto de IC avanzada.
Evaluación de la congestión extracardiaca con ecografía a pie de cama
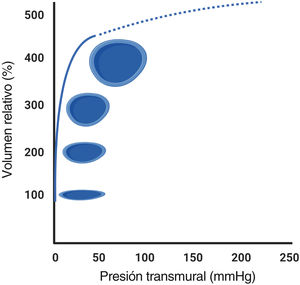
El diagrama de presión-volumen de una vena muestra que la distensibilidad es extremadamente alta en el rango de presión baja (figura 2). En otras palabras, las venas sin estrés pueden admitir volúmenes sanguíneos relativamente grandes con una pequeña intensificación de presión (reservorios sanguíneos funcionales). Sin embargo, la dilatación adicional del radio de la vena debido a la hipervolemia y las alteraciones del tono venoso por estimulación del músculo liso (vasoconstricción mediada simpáticamente) finalmente alcanzará los límites superiores de la capacidad venosa sistémica (capacidad amortiguadora máxima), lo que provocará un rápido aumento de las presiones venosas y la tensión de la pared (venas estresadas) sin un aumento adicional del área luminal de la vena (dilatación máxima) (figura 2). Sin embargo, el estudio de los componentes fisiológicos del sistema venoso de los seres humanos es invasivo y un reto técnico, lo que limita su aplicabilidad clínica. Por tanto, hay un mayor interés en la búsqueda de alternativas no invasivas para estimar la capacidad venosa.
Distensibilidad del sistema venoso. A presiones transmurales bajas, la distensibilidad aparente es extremadamente alta cuando la vena se vuelve completamente redondeada (línea continua). Sin embargo, a presiones transmurales no fisiológicamente altas, la distensibilidad es bastante baja (línea discontinua).
La ecografía a pie de cama ha surgido recientemente como un instrumento diagnóstico prometedor junto a la cabecera del enfermo para evaluar la congestión extracardiaca de órganos/vascular y controlar el tratamiento descongestivo. La ecografía a pie de cama es una prueba limitada, centrada y en tiempo real que consiste en la evaluación centrada en los vasos centrales (vena cava inferior [VCI] y vena yugular), el compartimento abdominal (venas hepática, porta y renal) y los pulmones para detectar hallazgos ecográficos que puedan ayudar al médico a controlar indirectamente la volemia venosa, la capacidad venosa y la congestión pulmonar. En el se presenta una descripción detallada sobre cómo se debe hacer una ecografía a pie de cama.
Vasos centralesVena cava inferiorLa VCI es un vaso de conducto grande muy distensible que transfiere sangre de los órganos que se encuentran por debajo del diafragma al lado derecho del corazón. Básicamente, la VCI es una prolongación anatómica de la aurícula derecha (AD). Así pues, cuando la PAD aumenta, transfiere sangre retrógradamente a la VCI y modifica su tamaño y colapsabilidad.
Aunque varios estudios han demostrado una correlación moderada entre el diámetro de la VCI y su colapsabilidad con la PAD34,35, estos parámetros producen resultados más precisos cuando se usan para discriminar entre PVC normales y bajas (diámetro de la VCI<2,1cm y colapso>50%) y PVC elevadas (diámetro de la VCI>2,1cm con <50% de colapso)34. En otras palabras, las dimensiones y la colapsabilidad de la VCI pueden detectar una PAD elevada, pero no son lo suficientemente precisas para estimar los valores de la PAD. Además, aunque los cambios en el diámetro y la colapsabilidad de la VCI han demostrado ser útiles para controlar la respuesta diurética36,37 y estratificar el riesgo38,39, se necesitan más estudios para establecer si un enfoque guiado por la VCI es más efectivo que la atención habitual en la IC aguda (ICA)40.
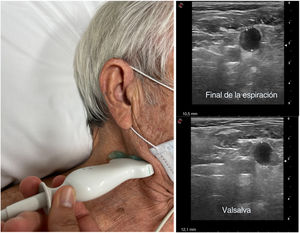
Ecografía de la vena yugular internaEl diámetro de la vena yugular interna (VYI) en individuos sanos y pacientes euvolémicos es pequeño (∼0,10-0,15cm), pero aumenta varias veces durante la maniobra de Valsalva (generalmente hasta ∼1cm). En pacientes con PAD elevada o congestión intravascular, el diámetro de la VYI aumenta en reposo, lo que genera una reducción de la proporción de VYI. Se considera anormal una proporción de la VJI<4 (la proporción puede disminuir <2 en casos de congestión grave) (figura 3) y predice peores resultados, independientemente de los valores de los péptidos natriuréticos41,42.
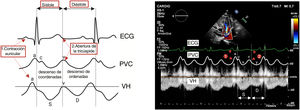
Compartimento abdominalVenas hepáticasLas venas hepáticas (VH) drenan en la AD a través de la VCI. Por tanto, los patrones de flujo de las VH se correlacionan estrechamente con los cambios de presión en la AD (de manera análoga al trazado del pulso venoso yugular) (figura 4). La forma de onda normal de las VH es trifásica con 4 componentes: una onda A retrógrada (sístole auricular), una onda S anterógrada (sístole ventricular), una onda V de transición (onda de transición de llenado auricular excesivo) y una onda D anterógrada (diástole ventricular) 34.
Hay un predominio sistólico en el flujo de las VH en individuos con presiones de la AD bajas o normales; en cambio, este predominio sistólico se pierde cuando aumenta la PAD20. En pacientes con disfunción del VD o RT hemodinámicamente importante, hay una inversión de la proporción de onda S a=onda D (S<D) o, incluso, una onda S retrógrada como consecuencia de la regurgitación de la sangre en la AD y la incapacidad del ventrículo deteriorado para desplazar el anillo tricuspídeo hacia la punta del corazón. Sin embargo, aunque la RT y la disfunción del VD comúnmente coexisten, la onda S no se vuelve retrógrada en ausencia de RT grave. Por tanto, se debe realizar una ecografía detallada si la señal Doppler de las VH muestra una onda S retrógrada43.
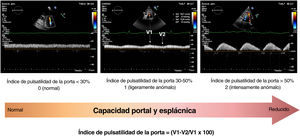
Vena portaLas alteraciones del flujo venoso porta se han propuesto como marcador de congestión venosa y disfunción del VD44–47. Dada su presión de perfusión relativamente baja (aproximadamente, 10mmHg), la entrada del flujo porta es muy sensible a las elevaciones de las presiones de salida (anterógradas) del lado derecho del corazón. Por tanto, cuando se eleva la PAD (como en la IC del lado derecho) y se alcanza la capacidad máxima de amortiguación de la VCI, las variaciones de presión en la AD durante el ciclo cardiaco se transmiten al sistema porta, con lo que aumenta la pulsatilidad del flujo porta (índice de pulsatilidad de la porta [IPP]>30%) (figura 5). De manera similar, las reducciones de la capacidad venosa esplácnica a causa de la activación simpática también pueden contribuir a las alteraciones del flujo de entrada portal como consecuencia del cambio de volumen (autotransfusión) de los vasos del reservorio esplácnico. Curiosamente, los hallazgos preliminares sugieren que el IPP es muy dinámico y mejora considerablemente con los diuréticos48. Aunque se necesitan más estudios para confirmar la utilidad de la evaluación del flujo venoso portal mediante ecografía Doppler en la IC, prevemos que podría aportar información valiosa a los protocolos actualmente establecidos como la VCI y la ecografía pulmonar (EP).
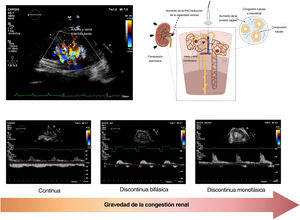
Ecografía venosa renalLa elevación de la PVC y la presión intraabdominal se transmiten retrógradamente y ocasionan un aumento de la presión hidrostática intersticial y tubular en el riñón encapsulado. Recientemente, las técnicas ecográficas para evaluar la circulación sanguínea renal han demostrado la utilidad de la evaluación mediante Doppler de onda pulsada para identificar la congestión renal49,50. En condiciones normales, las venas intrarrenales presentan un flujo continuo independiente de la función renal. Sin embargo, las venas intrarrenales se vuelven menos distensibles cuando aumenta la PVC y amortiguan el flujo continuo con un patrón discontinuo. Los aumentos adicionales de la PVC pueden conducir, en última instancia, a una fase de flujo único en diástole (patrón de flujo venoso intrarrenal monofásico [FVIM]), en que la circulación venosa renal puede depender exclusivamente del llenado del VD51 (figura 6).
Dada la asociación entre el FVIM y las PVC, algunos pueden sostener que un patrón de FVIM alterado es simplemente una medida alternativa que indica una PVC elevada. Sin embargo, puesto que los riñones son órganos encapsulados, la circulación venosa renal no depende exclusivamente de la PVC, sino también de factores extrínsecos que pueden ejercer compresión extrarrenal (p. ej., ascitis, edema visceral, congestión de la circulación esplácnica). Además, el FVIM podría verse interrumpido debido a las reducciones mediadas simpáticamente de las capacidades venosas sistémica e intrarrenal, independientemente de otros parámetros que indiquen un aumento de las presiones de llenado cardiaco. De hecho, un elevado número de pacientes admitidos con ICA presentan patrones de FVIM discontinuo en el momento del ingreso52, lo que se correlaciona claramente con los resultados clínicos, independientemente de los factores de pronóstico convencionales, como la PVC51,53. Curiosamente, los datos preliminares sugieren que los patrones de FVIM son dinámicos y pueden cambiar con el tratamiento descongestivo52,54, lo que abriría una nueva vía para la ecografía venosa renal como marcador potencial para el diagnóstico y la orientación del tratamiento. Sin embargo, se necesitan más estudios para dilucidar si una estrategia terapéutica basada en el patrón de FVIM junto con otros hallazgos relacionados con la congestión venosa derivados de la ecocardiografía Doppler se asocia con mejores resultados clínicos en pacientes con IC.
Biomarcadores circulantesPéptidos natriuréticosLos péptidos natriuréticos cerebrales (BNP) y los propéptidos natriuréticos cerebrales aminoterminales (NT-proBNP) son marcadores útiles para el diagnóstico y la estratificación del riesgo de los síndromes de IC55,56. Ambos son reconocidos marcadores indirectos del aumento de las presiones de llenado izquierdo y de la presión de enclavamiento arterial pulmonar en pacientes con IC55,57. Sin embargo, su utilidad para evaluar y clasificar la acumulación de líquidos y la congestión tisular es limitada. Por ejemplo, la isquemia y la fibrilación auricular están asociadas con un aumento de la tensión de la pared ventricular sin estar relacionadas con la congestión necesariamente55. Del mismo modo, otros factores, como la edad, el índice de masa corporal y la función renal influyen considerablemente en los niveles plasmáticos de los péptidos natriuréticos (PN)55. Por tanto, es fundamental tener en cuenta estos factores al interpretar los niveles de los PN.
En general, las mayores reducciones de los niveles de PN a lo largo del tiempo identifican a los pacientes con mejor pronóstico. Por ejemplo, en la ICA se ha establecido una disminución de más del 30% en los PN como punto de corte para identificar la mejoría clínica y hemodinámica55. Sin embargo, aunque existe una relación clara entre las presiones de llenado cardiaco y el pronóstico, los cambios en los PN pueden mostrar solo una relación débil o moderada con los marcadores indirectos de la descongestión en la ICA14.
ST2 solubleEl factor 2 de supresión de la tumorogenicidad (ST2) soluble es un miembro de la superfamilia de receptores tipo Toll/interleucina 158. La forma circulante soluble (sST2) ha demostrado ser un marcador valioso para la estratificación del riesgo en la IC aguda o crónica59,60. Como marcador de congestión, sST2 se correlaciona claramente con los indicadores ecocardiográficos de IC61 del lado derecho y las presiones de enclavamiento venoso central y pulmonar medidas invasivamente62. Más recientemente, sST2 también se ha identificado como un marcador indirecto de la resistencia diurética63. Los mecanismos que se encuentran detrás de la regulación al alza de sST2 en la ICA al parecer están relacionados con la liberación periférica de citocinas proinflamatorias por parte de las células endoteliales vasculares activadas y los pulmones en respuesta a la congestión hemodinámica y la inflamación64,65. Sin embargo, se necesitan más estudios para evaluar el papel exacto de este biomarcador como marcador indirecto de la congestión y la utilidad de la evaluación en serie para controlar y guiar la descongestión.
CD146Un grupo de diferenciación 146 (CD146) es una glucoproteína expresada en células endoteliales, células de músculo liso y pericitos en todo el árbol vascular66. Esta proteína interactúa con varios ligandos y media las funciones pleiotrópicas en la homeostasis de los vasos66. D146 se sobreexpresa en los síndromes de ICA y se asocia con inflamación, lesión vascular y disfunción endotelial67,68.
Se han notificado niveles más altos de CD146 en pacientes con ICA y marcadores clínicos indirectos de la congestión69. Un estudio de estrés venoso periférico realizado inflando un manguito de presión sobre las venas del antebrazo provocó un aumento rápido y pronunciado en la circulación de CD146 en el brazo congestionado70. Estos datos sugieren que CD146 podría ser potencialmente un biomarcador fiable de la congestión venosa. Sin embargo, la evidencia que respalda la asociación de este biomarcador con otros parámetros de congestión y su utilidad clínica para caracterizar el perfil de congestión es limitada.
EVALUACIÓN DE LA CONGESTIÓN TISULARLa sobrecarga de volumen suele ser un fenómeno más gradual resultante de la avidez de sodio y agua en el túbulo renal, un desequilibrio entre las presiones hidrostática y oncótica del compartimento intravascular e intersticial, y la reducción de la reserva linfática.
Signos y síntomasCongestión tisular sistémicaLas ascitis y el edema periférico generalmente indican acumulación de líquido intersticial/del tercer espacio. El edema periférico ofrece un alto grado de especificidad en el diagnóstico de la congestión tisular. Sin embargo, su sensibilidad es baja18 ya que otras comorbilidades, como la insuficiencia venosa, la insuficiencia renal y la hipoalbuminemia, también pueden contribuir a su presencia. Del mismo modo, los derrames serosos también se encuentran en otras afecciones, aparte de la IC.
Congestión del tejido pulmonarLas principales manifestaciones de la congestión del tejido pulmonar son los estertores y el derrame pleural. Sin embargo, su precisión discriminatoria al estimar la congestión en la IC es limitada y su ausencia no excluye la congestión pulmonar en pacientes con IC71.
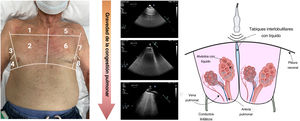
Evaluación ecográficaEcografía pulmonarLa EP es un método cuantitativo, sencillo y rápido para identificar y cuantificar el líquido pulmonar extravascular. En un pulmón oxigenado en condiciones normales, la línea pleural (línea A) será la única estructura que se puede visualizar con EP. Las líneas A se visualizan como líneas hiperecogénicas, delgadas y horizontales que se mueven con la respiración debido al deslizamiento de la pleura visceral y parietal durante el ciclo respiratorio. En pacientes en que se sospecha o se ha confirmado la IC, el aumento del agua pulmonar extravascular y el engrosamiento de los tabiques interlobulillares debido al edema crean artefactos de reverberación vertical conocidos como «líneas B» (figura 7). Cuando estas líneas B son numerosas, se fusionan y forman zonas confluyentes, que identifican zonas de edema alveolar (figura 7). La EP ya se utiliza ampliamente para el diagnóstico y el pronóstico en diferentes contextos de IC72–74. Además, parece que el número y la ubicación de las líneas B son dinámicos y cambian rápidamente después del tratamiento descongestivo, lo que las convierte en un marcador atractivo para controlar la descongestión pulmonar.
No obstante, deben tenerse en cuenta algunas advertencias cuando se usan la EP en la práctica clínica diaria. En primer lugar, las líneas B son solo una expresión de la pérdida de oxigenación pulmonar. Por consiguiente, la EP no distingue entre la naturaleza del líquido (trasudado o exudado), la causa del engrosamiento del tabique interlobulillar (fibrosis o edema) o el mecanismo responsable de la trasudación del líquido desde el vaso hasta el intersticio (aumento de la presión hidrostática o de la permeabilidad vascular). Por tanto, la EP siempre debe interpretarse en el contexto clínico adecuado y además de otros marcadores clínicos y bioquímicos. En segundo lugar, los valores de corte óptimos para la estratificación del riesgo en diferentes contextos clínicos deben definirse en estudios prospectivos mayores. Por último, aunque hay pequeños estudios controlados que sugieren la utilidad clínica del tratamiento de guía75, se necesitan ensayos aleatorizados mayores para demostrar que el tratamiento guiado por EP es seguro, mejora los síntomas y la calidad de vida, y los resultados a largo plazo.
Biomarcadores circulantesAntígeno carbohidrato 125El antígeno carbohidrato 125 (CA125) es una glucoproteína de alto peso molecular codificada por el gen MUC16 en los seres humanos76. Se expresa en la superficie de las células serosas como una proteína unida a membrana y se libera a la circulación en una forma soluble76. Este biomarcador se utiliza ampliamente para controlar los cánceres de ovario76. Sin embargo, CA125 también se regula al alza en otros cánceres y afecciones benignas relacionadas con la expansión del volumen76. Se desconoce el desencadenante exacto de la regulación al alza de CA125. Sin embargo, se sugiere que los principales podrían ser la activación de las células mesoteliales en respuesta a la presión hidrostática elevada, el estrés mecánico y los estímulos inflamatorios76. La evidencia acumulada respalda la asociación entre los niveles de CA125 circulante y los parámetros de congestión e hipervolemia, especialmente los indicadores de congestión tisular/derrames serosos76. Por ejemplo, en un gran estudio con pacientes con ICA, la existencia de derrame pleural, la gravedad de la RT y el edema periférico fueron factores que guardaban una relación muy estrecha con los niveles de CA12577. Además, pequeños estudios recientes también respaldan la asociación de esta glucoproteína con la congestión venosa renal y las presiones intraabdominales elevadas en pacientes con ICA78,79.
Este biomarcador tiene algunas propiedades notables. En primer lugar, los cambios en el CA125 guardan una relación muy estrecha con la gravedad de la enfermedad y los resultados clínicos, especialmente durante las primeras semanas después de un episodio de empeoramiento de la IC (fase de transición)76,80. Un estudio longitudinal de 946 pacientes consecutivos dados de alta por ICA mostró que la trayectoria a largo plazo representada por las medidas repetidas de CA125 predijo la mortalidad a largo plazo (bajo riesgo cuando el biomarcador descendía y alto riesgo cuando permanecía elevado o aumentaba durante el seguimiento)81. En segundo lugar, los niveles de CA125 circulante no se modifican sustancialmente por la edad, función renal, etiología isquémica, fibrilación auricular o fracción de eyección del VI76. Estas propiedades ventajosas sugieren una utilidad clínica en toda la variedad de pacientes con IC y en el control de la evolución de la enfermedad. Además, 2 pequeños ensayos clínicos aleatorizados muestran el potencial de este biomarcador para guiar el tratamiento diurético en pacientes con un episodio reciente de empeoramiento de la IC82,83. En CHANCE-HF, 380 pacientes con una descompensación reciente de la IC y CA125 ≥35 U/ml fueron asignados aleatoriamente a cuidados básicos frente al tratamiento guiado por CA125. En el grupo CA125, el ajuste ascendente o descendente de los diuréticos fue más frecuente, lo que se tradujo en una reducción de las hospitalizaciones por IC a 1 año82.
Para interpretar correctamente los niveles de CA125 en la IC, se deben destacar algunos aspectos. En primer lugar, hay un intervalo de tiempo entre el inicio de la congestión y la regulación al alza y liberación de CA125 (efecto retardado). Por consiguiente, es más probable que los pacientes con hipervolemia de larga duración presenten niveles plasmáticos de CA125 circulante elevados. Por ejemplo, en pacientes con un inicio más agudo (de minutos a horas), aquellos con redistribución predominantemente intravascular quizá no mostrarán ninguna regulación al alza de CA12576. En segundo lugar, CA125 tiene una semivida de circulación prolongada (7-12 días)76. Por tanto, la evaluación en serie de CA125 para controlar la descongestión se debe hacer en las primeras semanas y no durante los primeros días de descompensación76.
Adrenomedulina bioactivaSe cree que la adrenomedulina (ADM) mantiene la integridad vascular y la función de barrera de permeabilidad84. En la IC, la evidencia actual indica la utilidad de la forma bioactiva de la ADM (bio-ADM) como indicador de la congestión y la acumulación de líquidos85. Por ejemplo, la bio-ADM se asocia con certeza con la gravedad de la puntuación de congestión clínica en pacientes con ICA86. Además, en pacientes con IC y FEVI reducida avanzada y estable, la bio-ADM se correlacionó claramente con marcadores indirectos de presiones intravasculares altas (presión de enclavamiento capilar pulmonar, PAD media y NT-proBNP)87. Del mismo modo, otros estudios indicaron que la bio-ADM también se correlaciona con otros marcadores indirectos de la congestión tisular (CA125 o edema)86,88. Por tanto, se sugiere que la bio-ADM puede reflejar la evaluación integrada de los tipos de congestión vascular y tisular como un marcador de la permeabilidad vascular. Curiosamente, en pacientes con signos clínicos de congestión residual 7 días después del ingreso hospitalario, los niveles de bio-ADM fueron altos antes de iniciar el tratamiento y continuaron elevados durante esta primera semana de hospitalización89. Sin embargo, el papel de este biomarcador para controlar y guiar el tratamiento diurético requiere una evaluación más detenida y profunda.
CÓMO INTEGRAR ESTAS TÉCNICAS: UN ENFOQUE PRÁCTICO MULTIPARAMÉTRICOPasar de la evaluación clínica tradicional a un enfoque más integral y multiparamétrico (figura 8) puede permitirnos perfilar mejor la gravedad y distribución de la congestión. Además, la integración de técnicas de imagen y biomarcadores circulantes junto con la historia clínica y la exploración física puede mejorar la precisión diagnóstica del estado de congestión, revelando el fenotipo de congestión predominante. Por tanto, proponemos un enfoque integrador utilizando PN, CA125 y bio-ADM como biomarcadores circulantes y la EP y la ecografía venosa como técnicas de imagen (figura 9A). Los pacientes pueden clasificarse según su distribución regional (es decir, pulmonar y sistémica) y compartimental (es decir, intravascular y tisular) de la congestión. Por ejemplo, imaginamos 2 situaciones extremas. Por una parte, los pacientes con IC del lado derecho pueden tener un inicio clínico más gradual, con una distribución de la congestión sistémica predominante, con niveles plasmáticos elevados de CA125 y bio-ADM como marcadores indirectos de congestión tisular y evidencia ecográfica de capacidad venosa reducida (es decir, VCI dilatada, índice de pulsatilidad portal>30% y flujo venoso intrarrenal discontinuo). Por otra parte, aquellos con una IC predominantemente del lado izquierdo pueden tener una presentación clínica más aguda con congestión pulmonar evaluada por EP, niveles plasmáticos de PN más altos y E/e’ ≥15 como marcadores indirectos del aumento de las presiones de llenado del lado izquierdo y parámetros de CA125, bio-ADM y ecografía venosa normales o ligeramente anómalos. Entremedio, encontraremos varios grados de superposición que también pueden cambiar con el tiempo (figura 9B). La identificación del fenotipo de congestión predominante y los cambios a lo largo del tiempo por este enfoque multiparamétrico pueden permitir: a) la detección temprana de la congestión subclínica; b) un control más preciso del estado de congestión, y c) una mejor toma de decisiones sobre el tratamiento que conduzca a un contexto de medicina de mayor precisión. Respecto a las implicaciones terapéuticas, proponemos que los pacientes con congestión predominantemente intravascular puedan beneficiarse más de la modulación del tono vascular que de estrategias descongestivas agresivas. En cambio, aquellos con congestión tisular o sobrecarga de volumen predominante pueden reunir las condiciones para un enfoque diurético más intensivo mientras se mantiene el relleno vascular. Se justifican más estudios para probar estos últimos supuestos.
A: distribución regional y compartimental bidimensional (2D) de la congestión mediante exploración física, biomarcadores circulantes y técnicas de imagen. B: el gráfico tiene 3 ejes, que hacen referencia a niveles crecientes de congestión pulmonar y congestión sistémica, por lo que se reconocen los diferentes pasos de la distribución compartimental (congestión intravascular y tisular). Esta representación es, en realidad, la versión tridimensional (3D) del gráfico 2D presentado en el panel A. Este enfoque conceptual 3D proporciona coordenadas de congestión, categorizando así todas las dimensiones de la congestión a la vez. En el ejemplo que se presenta en este caso, el paciente tiene predominantemente congestión sistémica (puntuación de 7/10), pero también una cantidad moderada de congestión pulmonar (puntuación de 5/10). En el eje de ordenadas, puede observarse que el paciente tiene congestión intravascular y está en transición hacia la congestión tisular. Bio-ADM, forma bioactiva de la adrenomedulina; CA125, antígeno carbohidrato 125; VCI, vena cava inferior; VI, ventrículo izquierdo; EP, ecografía pulmonar; NT-proBNP, propéptido natriurético cerebral aminoterminal; PEAP, presión de enclavamiento de la arteria pulmonar; IPP, índice de pulsatilidad de la porta; POCUS, ecografía a pie de cama.
La evaluación precisa de la congestión continúa siendo un reto en la práctica clínica diaria. La evaluación clínica tradicional tiene limitaciones e inconvenientes fundamentales. Un enfoque multiparamétrico que incluya técnicas de imagen generalmente disponibles y biomarcadores circulantes puede mejorar su caracterización y optimizar los tratamientos extenuantes.
FINANCIACIÓNEste trabajo contó con el apoyo del Instituto de Salud Carlos III y los fondos del CIBER de Enfermedades Cardiovasculares (16/11/00420 y 16/11/00403).
CONTRIBUCIÓN DE LOS AUTORESTodos los autores cumplen con cada una de las siguientes características definidas por el Comité Internacional de Editores de Revistas Médicas en los criterios de autoría de artículos científicos:
- –
Contribuciones sustanciales a la idea o diseño de la obra; o la obtención, análisis o interpretación de los datos para la obra.
- –
Redacción de la obra o revisión crítica de un importante contenido intelectual.
- –
Aprobación final de la versión que se publicará; y
- –
Acuerdo para asumir responsabilidad por todos los aspectos del estudio, garantizando que las cuestiones respecto a la exactitud o integridad de cualquier parte de la obra serán adecuadamente investigadas y abordadas.
M. Fudim declara subvenciones o contratos de los National Institutes of Health y la American Heart Association y honorarios de asesoría de Daxor, Axon Therapies, BSC y Bodyport. N. Girerd declara pagos u honorarios por conferencias, presentaciones, agencia de conferenciantes, redacción de originales o actos de formación de AstraZeneca, Bayer, Boehringer-Ingelheim, Roche Diagnostics, Novartis, Vifor y Lilly. J.L. Górriz declara honorarios por conferencias de AstraZeneca, Boehringer-Ingelheim, Novonordisk y apoyo para asistir a reuniones o viajes de Vifor. A. Bayés-Genís comunica honorarios por conferencias o asesorías de Abbot, AstraZeneca, Boehringer-Ingelheim, Roche Diagnostics, Novartis y Vifor. Todos los demás autores declaran no tener ningún conflicto de intereses.