El pronóstico de los pacientes con cardiopatía congénita e hipertensión arterial pulmonar (HTP) está estrechamente relacionado con la función del ventrículo derecho (VD). Los parámetros de ecocardiografía bidimensional como la deformación miocárdica o el índice de remodelado VD telesistólico (IRVDTS) han surgido para cuantificar la función del VD.
MétodosSe estudió de forma prospectiva a 30 paciente de edad 48± 12 años con shunt pretricuspídeo e HTP para investigar la precisión de diversos parámetros ecocardiográficos de estudio de la función del VD (extrusión sistólica del anillo tricúspide, velocidad sistólica pico del anillo tricúspide, ratio de duración sistodiastólica del VD, área de la aurícula derecha, cambio de área fraccional del ventrículo derecho, deformación miocárdica global del ventrículo derecho e IRVDTS) respecto a la fracción de eyección del ventrículo derecho medida por resonancia cardiaca.
ResultadosEn 13 pacientes (43,3%) se observó una fracción de eyección del VD <45%. La deformación longitudinal global del VD (ρ [coeficiente de correlación de Spearman] = −0,75, p=0,001; R2=0,58, p=0,001), área de la aurícula derecha (ρ=−0,74, p <0,0001; R2=0,56, p <0,0001); IRVDTS (ρ=−0,64, p < 0,0001; R2=0,47, p <0,0001), ratio de duración sistodiastólica (ρ=−0,62, p=0,0004; R2=0,47, p <0,0001) y cambio de área fraccional del VD (ρ=0,48, p=0,01; R2=0,37, p <0,0001) se correlacionaron con la fracción de eyección del VD. La deformación longitudinal global del VD, IRVDTS y área de la aurícula derecha fueron predictores de fracción de eyección <45% con la mayor área bajo la curva (0,88; IC95%, 0,71-1,00; 0,88; IC95%, 0,76-1,00 y 0,89; IC95%, 0,77-1,00, respectivamente). Una deformación longitudinal global del VD> −16%, IRVDTS ≥ 1,7 y un área de la aurícula derecha ≥ 22 cm2 predijeron una fracción de eyección del VD <45% con una sensibilidad y especificidad del 87,5 y 85,7%; 76,9 y 88,3%; 92,3 y 82,4%, respectivamente.
ConclusionesIRVDTS, área de la aurícula derecha y deformación longitudinal del VD fueron importantes marcadores de disfunción VD en pacientes con shunt pretricuspídeo e HTP.
Palabras clave
La hipertensión arterial pulmonar (HAP) es una complicación de las cardiopatías congénitas (CC) no corregidas o reparadas recientemente1. La HAP en pacientes con CC (HAP-CC) se asocia a un aumento de la mortalidad, en especial cuando hay un síndrome de Eisenmenger2. Los pacientes con HAP-CC tienen una esperanza de vida inferior a la de los pacientes sin HAP3. Aunque la supervivencia parece ser mejor que la observada en la HAP idiopática, la mortalidad continúa siendo alta, en especial en los pacientes con un shunt pretricuspídeo4. De hecho, la insuficiencia cardiaca se da con más frecuencia de lo que se observa en los pacientes con un shunt postricuspídeo, debido a los niveles diferentes de adaptación del ventrículo derecho (VD)5. El seguimiento de estos pacientes requiere una evaluación de la función del VD. La resonancia magnética cardiaca (RMC) se considera el patrón de referencia para la cuantificación del volumen y la función del VD, y se ha demostrado su exactitud en la evaluación del pronóstico de la HAP6. En la HAP-CC, la RMC proporciona una amplia variedad de datos anatómicos y funcionales, pero su uso sistemático se ve limitado por las dificultades de disponibilidad y coste7. La ecocardiografía transtorácica se emplea de manera habitual para el diagnóstico y el seguimiento8. Algunos parámetros ecocardiográficos de desarrollo reciente, como la deformación (strain) o el índice de remodelado ventricular derecho telesistólico (IRVDTS), son nuevas opciones para evaluar la función y el remodelado del VD. El IRVDTS ha surgido recientemente como marcador pronóstico sencillo, reproducible y potente para los adultos con HAP idiopática, por conectivopatías, fármacos o tóxicos o de carácter familiar9. En la HAP-CC, no disponemos de recomendaciones relativas a qué parámetro ecocardiográfico de la función del VD conviene utilizar.
El objetivo principal de este estudio fue determinar la fiabilidad de los parámetros ecocardiográficos de la función del VD, incluida la deformación del VD y el IRVDTS, para detectar la disfunción del VD, en comparación con el patrón de referencia que es la fracción de eyección del VD (FEVD) medida mediante RMC en una cohorte prospectiva de pacientes con shunt pretricuspídeo e HAP.
MÉTODOSA lo largo de 1 año, se incluyó prospectivamente a 30 pacientes con HAP y shunt pretricuspídeo (comunicación interauricular o anomalía parcial del retorno venoso pulmonar). Se practicó a los pacientes una RMC, una ecocardiografía y un cateterismo cardiaco derecho en un plazo de 2 días. El diseño del estudio fue aprobado por un comité de ética de investigación externo (RCB-2018-A00332-53). Todos los pacientes dieron su consentimiento informado por escrito. La HAP se clasificó como síndrome de Eisenmenger, como HAP con un shunt sistémico-pulmonar prevalente o como HAP después de la corrección del defecto. La HAP se definió por una presión arterial pulmonar media ≥ 20mmHg, una resistencia vascular pulmonar ≥ 3 UW y una presión auricular izquierda o presión arterial pulmonar enclavada ≤ 15mmHg10. Se determinó la clase funcional de la New York Heart Association-Organización Mundial de la Salud. Se calcularon las siguientes puntuaciones de riesgo para cada paciente: Puntuación REVEAL 2.011 y puntuación Right Heart ()12.
Resonancia magnética cardiacaSe realizaron exploraciones de imagen con RMC utilizando un aparato Magnet Discovery MR 450 w de 1,5 Tesla (General Electric Healthcare, Estados Unidos). Se obtuvieron imágenes de video funcionales en proyecciones de eje corto y eje largo, con el empleo de secuencias de precesión libre en estado estable, aguantando la respiración, que abarcaron desde la base hasta el vértice cardiaco (tiempo de repetición=4,1/ tiempo de eco=1,9, ángulo de giro (flip)=15°). El posprocesamiento se llevó a cabo con el programa informático Arterys (Arterys, Estados Unidos) para la medición de los volúmenes telediastólico y telesistólico y las fracciones de eyección del VD y del ventrículo izquierdo (VI). La función sistólica VI normal se definió como una fracción de eyección VI ≥ 57%13. La dilatación del VD se definió como un volumen telediastólico VD> 112ml/m2 en las mujeres y> 121ml/m2 en los varones13.
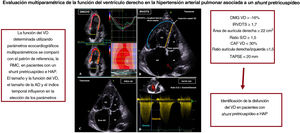
EcocardiografíaLas exploraciones de ecocardiografía transtorácica las realizaron con un aparato Vivid E95 GE (GE Healthcare Vingmed Ultrasound, Noruega) utilizando un método estandarizado8,14 2 especialistas en cardiología que no conocían los resultados de la RMC. Se determinaron los parámetros cardiacos derechos convencionales a lo largo de 3 ciclos: desplazamiento sistólico del plano del anillo tricuspídeo (TAPSE) en modo M15; velocidad sistólica de la válvula tricúspide mediante Doppler tisular; ratio de duración sistodiastólica (ratio S/D) definido como el ratio entre el tiempo de regurgitación tricuspídea sistólico y diastólico16,17; y dilatación de la aurícula derecha definida como un área auricular derecha telesistólica> 18cm2 (figura 1). La dilatación del VD se definió como un área telediastólica del VD> 11,7cm2/m2 en las mujeres y> 12,6cm2/m2 en los varones18. Se observó la presencia de derrame pericárdico. Se determinaron también otros parámetros adicionales de la función global del VD: cambio de área fraccional (CAF) del VD15 y deformación miocárdica global del VD (DMGVD, medida con el empleo de la exploración de imagen con rastreo de marcas (speckle-tracking)19. Se ubicaron manualmente los puntos de referencia del tabique, lateral y apical del VD, en una proyección apical de 4 cámaras modificada. La función automática de imagen rastreó automáticamente 6 segmentos desde la parte basal del tabique hasta el vértice, aplicando un ajuste manual en caso necesario. El IRVDTS se definió como el cociente de longitud lateral/altura septal) (figura 1)9.
Figura central. Parámetros ecocardiográficos que predicen la disfunción del ventrículo derecho. La deformación miocárdica global del ventrículo derecho (DMGVD) se registra en una proyección apical de cuatro cámaras, y se rastrean automáticamente 6 segmentos miocárdicos. El índice de remodelado ventricular derecho telesistólico (IRVDTS) es un cociente sencillo de la longitud lateral/altura septal telesistólicas. La longitud lateral se mide desde el anillo tricuspídeo lateral hasta el punto de inserción del VD en el tabique interventricular (TIV). La altura septal es una línea recta que va del anillo tricuspídeo septal a la inserción del VD en el TIV. El área de la AD se traza manualmente en telesístole. La ratio de duración sistodiastólica (ratio S/D) se define como la ratio de duración de la insuficiencia tricuspídea en la sístole respecto a la diástole. Obsérvese la gran comunicación interauricular (flecha roja) y la dilatación del corazón derecho. AD, aurícula derecha; AI, aurícula izquierda; HAP, hipertensión arterial pulmonar; RMC, resonancia magnética cardiaca; TAPSE, desplazamiento sistólico del plano del anillo tricuspídeo; VD, ventrículo derecho; VI, ventrículo izquierdo. Esta figura se muestra a todo color solo en la versión electrónica del artículo.
El cateterismo cardiaco derecho se llevó a cabo siguiendo un protocolo estandarizado, bajo anestesia local, en el paciente con respiración espontánea sin apoyo de oxígeno20. El consumo de oxígeno se midió directamente con el empleo de un dosel. Se aplicó el método de Fick para determinar el gasto cardiaco pulmonar, el ratio del gasto cardiaco pulmonar respecto al sistémico y la resistencia vascular pulmonar, expresada en unidades Wood.
Análisis estadísticoLas variables continuas se expresan en forma de media±desviación estándar o de mediana [rango intercuartílico], según proceda. Se evaluó el carácter normal o no de la distribución con la prueba de Shapiro-Wilk. Se realizaron comparaciones de las mediciones obtenidas en los pacientes con una FEVD <45% frente a ≥ 45%. Se utilizó la prueba de t para datos emparejados cuando las variables tenían una distribución normal, y se verificó la homogeneidad de la varianza mediante la prueba de Levene. En los demás casos, se utilizó la prueba de Mann-Whitney no paramétrica. Los datos cualitativos se compararon con una prueba de X2 o una prueba exacta de Fisher. La coincidencia entre los resultados de la RMC y los parámetros ecocardiográficos se investigó mediante la evaluación de sus relaciones lineales. La fuerza de las correlaciones se evaluó mediante la prueba de Spearman y se presentó mediante el valor de ρ. Se presenta el coeficiente de Pearson para los gráficos de correlación y el valor de ρ para las asociaciones ordenadas monotónicas. Se elaboraron las curvas de características operativas del receptor (ROC) para cada variable ecocardiográfica pertinente, respecto a la FEVD, y se presentó el valor del área bajo la curva (AUC). Se determinó el valor con mejor capacidad de discriminación para proporcionar la mejor situación de sensibilidad y especificidad de la variable para diversos umbrales de FEVD13,21. Los parámetros ecocardiográficos de interés investigados fueron los 4 marcadores pronósticos descritos en los pacientes con síndrome de Eisenmenger: área auricular derecha, ratio de área auricular derecha/auricular izquierda, ratio S/D y TAPSE22. Se determinaron también parámetros ecocardiográficos bidimensionales de la función del VD, incluida la DMGVD, el CAFVD y el IRVDTS9. Para evaluar la reproducibilidad interobservadores de las determinaciones del IRVDTS, se realizó un análisis de regresión lineal y una determinación del sesgo medio con el análisis de Bland-Altman. Para todos los análisis, se eligió un umbral de significación estadística de α=0,05. Los parámetros de mayor interés se combinaron en una puntuación no ponderada para un análisis exploratorio. Los análisis estadísticos se realizaron con el programa informático Stata, versión 11.2 (StataCorp, Estados Unidos).
RESULTADOSPoblación de pacientesSe incluyó en el estudio a 30 pacientes (tabla 1). Las mediciones de parámetros de RMC y de cateterismo se muestran en la tabla 2. La HAP era grave, según indican los valores de presión arterial pulmonar media de 50±13mmHg y de resistencia vascular pulmonar de 9,4 UW [5,1-15,0].
Características de los pacientes en la situación inicial
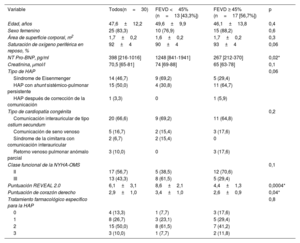
| Variable | Todos(n=30) | FEVD <45% (n=13 [43,3%]) | FEVD ≥ 45% (n=17 [56,7%]) | p |
|---|---|---|---|---|
| Edad, años | 47,6±12,2 | 49,6±9,9 | 46,1±13,8 | 0,4 |
| Sexo femenino | 25 (83,3) | 10 (76,9) | 15 (88,2) | 0,6 |
| Área de superficie corporal, m2 | 1,7±0,2 | 1,6±0,2 | 1,7±0,2 | 0,3 |
| Saturación de oxígeno periférica en reposo, % | 92±4 | 90±4 | 93±4 | 0,06 |
| NT Pro-BNP, pg/ml | 398 [216-1016] | 1248 [841-1941] | 267 [212-370] | 0,02* |
| Creatinina, μmol/l | 70,5 [65-81] | 74 [69-88] | 65 [63-78] | 0,1 |
| Tipo de HAP | 0,06 | |||
| Síndrome de Eisenmenger | 14 (46,7) | 9 (69,2) | 5 (29,4) | |
| HAP con shunt sistémico-pulmonar persistente | 15 (50,0) | 4 (30,8) | 11 (64,7) | |
| HAP después de corrección de la comunicación | 1 (3,3) | 0 | 1 (5,9) | |
| Tipo de cardiopatía congénita | 0,2 | |||
| Comunicación interauricular de tipo ostium secundum | 20 (66,6) | 9 (69,2) | 11 (64,8) | |
| Comunicación de seno venoso | 5 (16,7) | 2 (15,4) | 3 (17,6) | |
| Síndrome de la cimitarra con comunicación interauricular | 2 (6,7) | 2 (15,4) | 0 | |
| Retorno venoso pulmonar anómalo parcial | 3 (10,0) | 0 | 3 (17,6) | |
| Clase funcional de la NYHA-OMS | 0,1 | |||
| II | 17 (56,7) | 5 (38,5) | 12 (70,6) | |
| III | 13 (43,3) | 8 (61,5) | 5 (29,4) | |
| Puntuación REVEAL 2.0 | 6,1±3,1 | 8,6±2,1 | 4,4±1,3 | 0,0004* |
| Puntuación de corazón derecho | 2,9±1,0 | 3,4±1,0 | 2,6±0,9 | 0,04* |
| Tratamiento farmacológico específico para la HAP | 0,8 | |||
| 0 | 4 (13,3) | 1 (7,7) | 3 (17,6) | |
| 1 | 8 (26,7) | 3 (23,1) | 5 (29,4) | |
| 2 | 15 (50,0) | 8 (61,5) | 7 (41,2) | |
| 3 | 3 (10,0) | 1 (7,7) | 2 (11,8) |
FEVD, fracción de eyección del ventrículo derecho; HAP, hipertensión arterial pulmonar; NYHA-WHO, New York Heart Association-Organización Mundial de la Salud.
Los valores se expresan en forma de número (%), media±desviación estándar o mediana [rango intercuartílico].
Parámetros de resonancia magnética cardiovascular y parámetros hemodinámicos según la fracción de eyección del ventrículo derecho
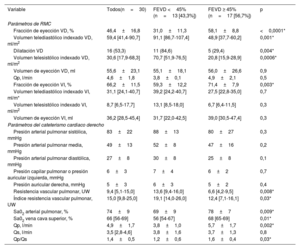
| Variable | Todos(n=30) | FEVD <45% (n=13 [43,3%]) | FEVD ≥ 45% (n=17 [56,7%]) | p |
|---|---|---|---|---|
| Parámetros de RMC | ||||
| Fracción de eyección VD, % | 46,4±16,8 | 31,0±11,3 | 58,1±8,8 | <0,0001* |
| Volumen telediastólico indexado VD, ml/m2 | 59,4 [41,4-90,7] | 91,1 [86,7-107,4] | 48,9 [37,7-60,2] | 0,001* |
| Dilatación VD | 16 (53,3) | 11 (84,6) | 5 (29,4) | 0,004* |
| Volumen telesistólico indexado VD, ml/m2 | 30,6 [17,9-68,3] | 70,7 [51,9-76,5] | 20,8 [15,9-28,9] | 0,0006* |
| Volumen de eyección VD, ml | 55,6±23,1 | 55,1±18,1 | 56,0±26,6 | 0,9 |
| Qp, l/min | 4,6±1,8 | 3,8±0,1 | 4,9±2,1 | 0,5 |
| Fracción de eyección VI, % | 66,2±11,5 | 59,3±12,2 | 71,4±7,9 | 0,003* |
| Volumen telediastólico indexado VI, ml/m* | 31,1 [24,1-40,7] | 39,2 [24,2-40,7] | 27,5 [22,8-35,0] | 0,7 |
| Volumen telesistólico indexado VI, ml/m2 | 8,7 [6,5-17,7] | 13,1 [8,5-18,0] | 6,7 [6,4-11,5] | 0,3 |
| Volumen de eyección VI, ml | 36,2 [28,5-45,4] | 31,7 [22,0-42,5] | 39,0 [30,5-47,4] | 0,3 |
| Parámetros del cateterismo cardiaco derecho | ||||
| Presión arterial pulmonar sistólica, mmHg | 83±22 | 88±13 | 80±27 | 0,3 |
| Presión arterial pulmonar media, mmHg | 49±13 | 52±8 | 47±16 | 0,2 |
| Presión arterial pulmonar diastólica, mmHg | 27±8 | 30±8 | 25±8 | 0,1 |
| Presión capilar pulmonar o presión auricular izquierda, mmHg | 6±3 | 7±4 | 6±2 | 0,7 |
| Presión auricular derecha, mmHg | 5±3 | 6±3 | 5±2 | 0,4 |
| Resistencia vascular pulmonar, UW | 9,4 [5,1-15,0] | 13,6 [9,4-16,0] | 6,6 [4,2-9,5] | 0,008* |
| Índice resistencia vascular pulmonar, UW | 15,0 [9,8-25,0] | 19,1 [14,0-26,0] | 12,4 [7,1-16,1] | 0,03* |
| Sa02 arterial pulmonar, % | 74±9 | 69±9 | 78±7 | 0,009* |
| Sa02 vena cava superior, % | 66 [56-69] | 56 [54-67] | 68 [65-69] | 0,01* |
| Qp, l/min | 4,9±1,7 | 3,8±1,0 | 5,7±1,7 | 0,002* |
| Qs, l/min | 3,5 [2,8-4,6] | 3,8±1,6 | 3,7±1,3 | 0,8 |
| Qp/Qs | 1,4±0,5 | 1,2±0,6 | 1,6±0,4 | 0,03* |
FEVD, fracción de eyección del ventrículo derecho; Qp, gasto pulmonar; Qs, gasto sistémico; RMC, resonancia magnética cardiaca; UW, unidad Wood; VD, ventrículo derecho; VI, ventrículo izquierdo.
Los valores se expresan en forma de número (%), media±desviación estándar, mediana [rango intercuartílico].
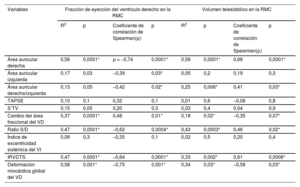
La media de FEVD obtenida mediante la RMC fue de 46,4±16,8%, y 13 pacientes (43,3%) tenían una FEVD <45%. Los pacientes con una FEVD <45% tenían una puntuación de riesgo más elevada (REVEAL 2.0, p=0,0004 y puntuación de corazón derecho p=0,04), una mayor resistencia vascular pulmonar (p=0,008), un volumen telediastólico y telesistólico del VD superiores (p=0,001; p=0,0006) y una aurícula derecha más grande (p=0,0001). Ocho pacientes con disfunción del VI tenían también una disfunción del VD (p <0,05). La saturación de oxígeno periférica estaba correlacionada con la FEVD (ρ=0,39, p=0,03; R2=0,20, p <0,01). En la tabla 3 se presenta la comparación entre la FEVD determinada mediante la RMC y los parámetros ecocardiográficos. Las correlaciones de Spearman entre los parámetros ecocardiográficos, la FEVD-RMC y los volúmenes telesistólicos en la RMC se presentan en la tabla 4, y el análisis de regresión lineal se muestra en la figura 2 y en la figura 3.
Parámetros ecocardiográficos según la fracción de eyección del ventrículo derecho
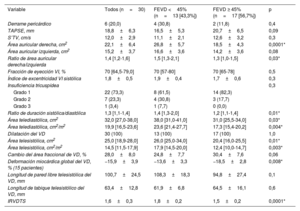
| Variable | Todos (n=30) | FEVD <45% (n=13 [43,3%]) | FEVD ≥ 45% (n=17 [56,7%]) | p |
|---|---|---|---|---|
| Derrame pericárdico | 6 (20,0) | 4 (30,8) | 2 (11,8) | 0,4 |
| TAPSE, mm | 18,8±6,3 | 16,5±5,3 | 20,7±6,5 | 0,09 |
| S’TV, cm/s | 12,0±2,9 | 11,1±2,1 | 12,6±3,2 | 0,3 |
| Área auricular derecha, cm2 | 22,1±6,4 | 26,8±5,7 | 18,5±4,3 | 0,0001* |
| Área auricular izquierda, cm2 | 15,2±3,7 | 16,6±3,6 | 14,2±3,6 | 0,08 |
| Ratio de área auricular derecha/izquierda | 1,4 [1,2-1,6] | 1,5 [1,3-2,1] | 1,3 [1,0-1,5] | 0,03* |
| Fracción de eyección VI, % | 70 [64,5-79,0] | 70 [57-80] | 70 [65-78] | 0,5 |
| Índice de excentricidad VI sistólica | 1,8±0,5 | 1,9±0,4 | 1,7±0,6 | 0,3 |
| Insuficiencia tricuspídea | 0,3 | |||
| Grado 1 | 22 (73,3) | 8 (61,5) | 14 (82,3) | |
| Grado 2 | 7 (23,3) | 4 (30,8) | 3 (17,7) | |
| Grado 3 | 1 (3,4) | 1 (7,7) | 0 (0,0) | |
| Ratio de duración sistólica/diastólica | 1,3 [1,1-1,4] | 1,4 [1,3-2,0] | 1,2 [1,1-1,4] | 0,01* |
| Área telediastólica, cm2 | 32,0 [27,0-38,0] | 38,0 [31,0-41,0] | 31,0 [25,5-34,0] | 0,03* |
| Área telediastólica, cm2/m2 | 19,9 [16,5-23,6] | 23,6 [21,4-27,7] | 17,3 [15,4-20,2] | 0,004* |
| Dilatación del VD | 30 (100) | 13 (100) | 17 (100) | 1,0 |
| Área telesistólica, cm2 | 25,0 [18,9-28,0] | 26,0 [25,0-34,0] | 20,4 [16,0-25,5] | 0,01* |
| Área telesistólica, cm2/m2 | 14,5 [11,5-17,9] | 17,9 [14,5-20,0] | 12,4 [10,0-14,7] | 0,003* |
| Cambio del área fraccional de VD, % | 28,0±8,0 | 24,8±7,7 | 30,4±7,6 | 0,06 |
| Deformación miocárdica global del VD, % (15 pacientes) | −15,9±3,9 | −13,6±3,3 | −18,5±2,8 | 0,008* |
| Longitud de pared libre telesistólica del VD, mm | 100,7±24,5 | 108,3±18,3 | 94,8±27,4 | 0,1 |
| Longitud de tabique telesistólico del VD, mm | 63,4±12,8 | 61,9±6,8 | 64,5±16,1 | 0,6 |
| IRVDTS | 1,6±0,3 | 1,8±0,2 | 1,5±0,2 | 0,0001* |
FEVD, fracción de eyección del ventrículo derecho; IRVDTS, índice de remodelado ventricular derecho telesistólico; S’TV, velocidad sistólica de la válvula tricúspide; TAPSE, desplazamiento sistólico del plano del anillo tricuspídeo; VD, ventrículo derecho; VI, ventrículo izquierdo.
Los valores se expresan en forma de número (%) media±desviación estándar o mediana [rango intercuartílico]
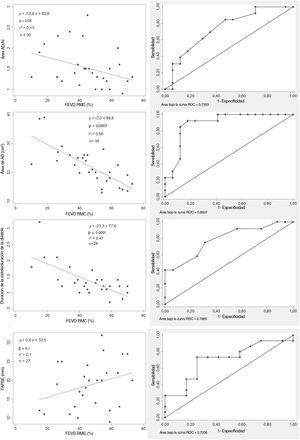
Relaciones entre los parámetros ecocardiográficos y la fracción de eyección del ventrículo derecho derivada de la RMC
| Variables | Fracción de eyección del ventrículo derecho en la RMC | Volumen telesistólico en la RMC | ||||||
|---|---|---|---|---|---|---|---|---|
| R2 | p | Coeficiente de correlación de Spearman(ρ) | p | R2 | p | Coeficiente de correlación de Spearman(ρ) | p | |
| Área auricular derecha | 0,56 | 0,0001* | ρ = −0,74 | 0,0001* | 0,56 | 0,0001* | 0,68 | 0,0001* |
| Área auricular izquierda | 0,17 | 0,03 | −0,39 | 0,03* | 0,05 | 0,2 | 0,19 | 0,3 |
| Área auricular derecha/izquierda | 0,13 | 0,05 | −0,42 | 0,02* | 0,25 | 0,006* | 0,41 | 0,03* |
| TAPSE | 0,10 | 0,1 | 0,32 | 0,1 | 0,01 | 0,6 | −0,06 | 0,8 |
| S’TV | 0,15 | 0,05 | 0,20 | 0,3 | 0,03 | 0,4 | 0,04 | 0,9 |
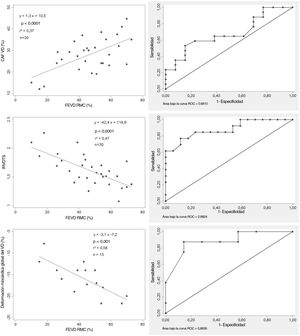
| Cambio del área fraccional del VD | 0,37 | 0,0001* | 0,48 | 0,01* | 0,18 | 0,02* | −0,35 | 0,07* |
| Ratio S/D | 0,47 | 0,0001* | −0,62 | 0,0004* | 0,43 | 0,0003* | 0,46 | 0,02* |
| Índice de excentricidad sistémica del VI | 0,06 | 0,3 | −0,35 | 0,1 | 0,02 | 0,5 | 0,20 | 0,4 |
| IRVDTS | 0,47 | 0,0001* | −0,64 | 0,0001* | 0,33 | 0,002* | 0,61 | 0,0006* |
| Deformación miocárdica global del VD | 0,58 | 0,001* | −0,75 | 0,001* | 0,34 | 0,03* | −0,58 | 0,03* |
FEVD, fracción de eyección del ventrículo derecho; IRVDTS, índice de remodelado ventricular derecho telesistólico; Ratio S/D, ratio de duración sistodiastólica; RMC, resonancia magnética cardiaca; S’TV, velocidad sistólica de la válvula tricúspide; TAPSE, desplazamiento sistólico del plano del anillo tricuspídeo; VD, ventrículo derecho; VI, ventrículo izquierdo.
R2 indica coeficiente de determinación mediante análisis de regresión lineal con su grado de significación. ρ indica coeficiente de correlación de Spearman con su grado de significación.
Parámetros ecocardiográficos convencionales y FEVD. Correlaciones entre los parámetros ecocardiográficos y la FEVD (imágenes de la izquierda). Curva ROC (imágenes de la derecha): el área de la aurícula derecha ≥ 22cm2 (sensibilidad 92,3%; especificidad 82,4%), el ratio S/D ≥ 1,5 (sensibilidad 41,5%, especificidad 70,6%), la TAPSE <20mm (sensibilidad 73,3%, especificidad 75%) y el ratio de aurícula derecha/aurícula izquierda≥ 1,5 (sensibilidad 61,5%; especificidad 70,6%) identificaban la disfunción del VD. AD, aurícula derecha; AI, aurícula izquierda; AUC, área bajo la curva; FEVD, fracción de eyección del ventrículo derecho; ratio AD/AI, ratio de área auricular derecha/izquierda; Ratio S/D, ratio de duración sistodiastólica; RMC, resonancia magnética cardiaca; TAPSE, desplazamiento sistólico del plano del anillo tricuspídeo; VD, ventrículo derecho.
Parámetros ecocardiográficos multidimensionales y FEVD. Correlaciones entre los parámetros ecocardiográficos y la FEVD (imágenes de la izquierda). Curvas ROC (imágenes de la derecha): la DMGVD> −16% (sensibilidad 87,5%; especificidad 85,7%), el IRVDTS ≥ 1,7 (sensibilidad 76,9%; especificidad 88,3%) y el CAFVD <30% (sensibilidad 58,8%; especificidad 76,9%) predecían la disfunción del VD. AUC, área bajo la curva; CAFVD, cambio de área fraccional del ventrículo derecho; DMGVD, deformación miocárdica global del ventrículo derecho; FEVD, fracción de eyección del ventrículo derecho; IRVDTS, índice de remodelado ventricular derecho telesistólico; RMC, resonancia magnética cardiaca.
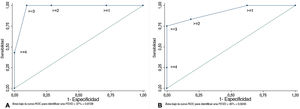
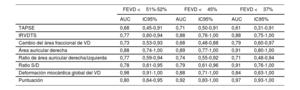
En las curvas ROC, la DMGVD, el IRVDTS y el área de la aurícula derecha fueron los parámetros que mostraron un valor más alto del AUC para identificar la FEVD <45% (AUC=0,88, IC95%, 0,71-1,00; AUC=0,88, IC95%, 0,76-1,00 y AUC=0,89, IC95%, 0,77-1,00, respectivamente). La ratio de aurícula derecha/aurícula izquierda, la ratio de S/D, la TAPSE y el CAFVD mostraron un valor de AUC regular (AUC=0,74, IC95%, 0,55-0,92; AUC=0,79, IC95%, 0,61-0,96; AUC=0,71, IC95%, 0,50-0,91 y AUC=0,68, IC95%, 0,48-0,88). Los valores con mejor capacidad discriminatoria para predecir la FEVD <45% fueron la DMGVD> −16% (sensibilidad 87,5% y especificidad 85,7%); el IRVDTS ≥ 1,7 (sensibilidad 76,9% y especificidad 88,3%); el CAFVD <30% (sensibilidad 58,8% y especificidad 76,9%); el área de la aurícula derecha ≥ 22cm2 (sensibilidad 92,3% y especificidad 82,4%); el ratio de aurícula derecha/aurícula izquierda ≥ 1,5 (sensibilidad 61,5% y especificidad 70,6%); el ratio S/D ≥ 1,5 (sensibilidad 41,7% y especificidad 93,8%) y la TAPSE <20mm (sensibilidad 73,3% y especificidad 75,0%) (figura 1, figura 2, y figura 3). El AUC de los parámetros ecocardiográficos para la predicción de la FEVD <37%21, la FEVD <45% y la FEVD ≤ 51 en las mujeres o ≤ 52 en los varones13 se indican en la tabla 5. Se creó una puntuación asignando 1 punto si el IRVDTS era ≥ 1,7, si el CAFVD era <30%, si el área de la aurícula derecha era ≥ 22cm2 y si el ratio S/D era ≥ 1,5. Esta puntuación estaba correlacionada con la FEVD (ρ=−0,74, p <0,0001; R2=0,64, p <0,0001). El AUC para identificar un valor de FEVD <37%21 fue de 0,97; IC95%, 0,93-1,00. Una puntuación ≥ 3 tenía una sensibilidad del 100% y una especificidad del 90,5% para identificar una FEVD <37% (figura 4A). El AUC para identificar una FEVD <45% fue de 0,92; IC95%, 0,83-1,00. Una puntuación ≥ 3 tenía una sensibilidad del 75% y una especificidad del 100% para identificar una FEVD <37% (figura 4B).
Curva de características operativas del receptor de los parámetros ecocardiográficos*
| FEVD <51%-52% | FEVD <45% | FEVD <37% | ||||
|---|---|---|---|---|---|---|
| AUC | IC95% | AUC | IC95% | AUC | IC95% | |
| TAPSE | 0,68 | 0,45-0,91 | 0,71 | 0,50-0,91 | 0,61 | 0,31-0,91 |
| IRVDTS | 0,77 | 0,60-0,94 | 0,88 | 0,76-1,00 | 0,88 | 0,75-1,00 |
| Cambio del área fraccional de VD | 0,73 | 0,53-0,93 | 0,68 | 0,48-0,88 | 0,79 | 0,60-0,97 |
| Área auricular derecha | 0,88 | 0,74-1,00 | 0,89 | 0,77-1,00 | 0,91 | 0,80-1,00 |
| Ratio de área auricular derecha/izquierda | 0,77 | 0,59-0,94 | 0,74 | 0,55-0,92 | 0,71 | 0,48-0,94 |
| Ratio S/D | 0,78 | 0,61-0,95 | 0,79 | 0,61-0,96 | 0,91 | 0,76-1,00 |
| Deformación miocárdica global del VD | 0,98 | 0,91-1,00 | 0,88 | 0,71-1,00 | 0,84 | 0,63-1,00 |
| Puntuación | 0,80 | 0,64-0,95 | 0,92 | 0,83-1,00 | 0,97 | 0,93-1,00 |
AUC, área bajo la curva; IC95%, intervalo de confianza del 95%; FEVD, fracción de eyección del ventrículo derecho; IRVDTS, índice de remodelado ventricular derecho telesistólico; Ratio S/D, ratio de duración sistodiastólica; TAPSE, desplazamiento sistólico del plano del anillo tricuspídeo; VD, ventrículo derecho.
Se creó una puntuación asignando 1 punto si el IRVDTS era>=1,7, si el CAFVD era <30%, si el área de la aurícula derecha era ≥ 22cm2 y si el ratio S/D era ≥ 1,5. El AUC para la predicción de una FEVD <37% fue de 0,97; IC95%, 0,93-1,00. Una puntuación ≥ 3 tenía una sensibilidad del 100% y una especificidad del 90,5% para identificar una FEVD <37% (A). El AUC para identificar una FEVD <45% fue de 0,92; IC95%, 0,83-1,00. Una puntuación ≥ 3 tenía una sensibilidad del 75% y una especificidad del 100% para identificar una FEVD <37% (B). AUC: área bajo la curva; CAFVD, cambio de área fraccional del ventrículo derecho; FEVD: fracción de eyección del ventrículo derecho; IC95%: intervalo de confianza del 95%; IRVDTS: índice de remodelado ventricular derecho; S/D: ratio de duración sistodiastólico telesistólico.
La reproducibilidad interobservadores de los parámetros de IRVDTS fue buena, con un coeficiente de variación del 4,4% y un sesgo medio de 0,02±0,25 (). El sesgo tendía a ser mayor en los valores más altos del IRVDTS.
Relación del IRVDTS con la puntuación de riesgoEl IRVDTS mostró una correlación significativa con la puntuación de corazón derecho (p=0,008) pero no con la puntuación REVEAL 2.0.
Viabilidad de la determinación de los parámetros ecocardiográficos del VDSe pudo determinar el IRVDTS y todos los parámetros convencionales en la totalidad de los pacientes. El CAFVD se determinó satisfactoriamente en el 96,7% de los casos. Por lo que respecta a la DMGVD, los segmentos del VD no se detectaron automáticamente en 11 pacientes (36,7%).
DISCUSIÓNEste estudio prospectivo de un solo centro, realizado en 30 pacientes con HAP secundaria a un shunt pretricuspídeo comparó los parámetros ecocardiográficos de función y remodelado del VD con la RMC. El CAFVD, el ratio S/D, el área de la aurícula derecha y el IRVDTS fueron los parámetros de mayor interés para evaluar la función del VD. Una puntuación que combina el IRVDTS, el área de la aurícula derecha, el ratio S/D y el CAFVD mostró una intensa correlación con la FEVD y predijo claramente la FEVD <37%, un umbral que se ha demostrado que es pertinente para la estratificación del riesgo en la HAP21. Nuestros resultados respaldan el interés del IRVDTS9 para evaluar la función del VD en los pacientes con HAP-CC. Existen pocos datos sobre la evaluación ecocardiográfica del VD en la HAP-CC, debido principalmente a la heterogeneidad de los defectos cardiacos5,22,23. Hasta donde nosotros sabemos, no hay ningún estudio que haya evaluado los parámetros ecocardiográficos de la función del VD en comparación con el patrón de referencia de la FEVD-RMC en pacientes con HAP-CC, como sí se ha hecho para otras CC24. Moceri et al.22 propusieron una puntuación pronóstica ecocardiográfica basándose en una cohorte grande pero heterogénea, formada por 181 pacientes con síndrome de Eisenmenger. El punto fuerte de este estudio fue demostrar que los parámetros ecocardiográficos convencionales, por ejemplo la TAPSE <15mm, el ratio S/D ≥ 1,5, el área de la aurícula derecha ≥ 25cm2 y el ratio aurícula derecha/aurícula izquierda ≥ 1,5 predecían la mortalidad. Sin embargo, no se dispuso de RMC y tan solo 29 pacientes (16%) tenían un shunt pretricuspídeo22.
Evaluación ecocardiográfica convencional del VDLa TAPSE es un parámetro independiente potente, sencillo y ampliamente utilizado, que está correlacionado con la FEVD en los pacientes con HAP15,25. En la HAP-CC, la TAPSE se asocia a un resultado adverso y se utiliza como parámetro pronóstico22,23. Sin embargo, se ha sugerido que tan solo los cambios seriados de la TAPSE predecían la mortalidad en esa población26. En nuestro estudio, la TAPSE no mostró una correlación significativa con la FEVD. No obstante la TAPSE <20mm predecía una disfunción del VD. Este estudio ilustra algunas limitaciones de la TAPSE. Aunque no parece verse influenciada por el tipo de shunt en los pacientes con síndrome de Eisenmenger5, la presencia de un shunt izquierda-derecha persistente y, por consiguiente, una precarga del VD, en la mitad de nuestros pacientes puede haber influido en nuestros resultados. Además, la TAPSE es un marcador de la función del VD longitudinal. No refleja ni el remodelado del VD ni la función transversal del VD, que están deteriorados en los pacientes con un shunt pretricuspídeo27.
Dado que el VD presenta una disfuncionalidad progresiva en la HAP-CC, la duración de la sístole aumenta mientras que la diástole se acorta. Una ratio S/D más alta refleja un tiempo de eyección del VD prolongado para un volumen de eyección dado, y un peor rendimiento global del VD. Así pues, el ratio S/D es una herramienta sencilla para evaluar la función del VD y se asocia a un peor pronóstico en la HAP-CC16,17. El ratio S/D se pudo determinar en todos los pacientes, ya que siempre tenían una insuficiencia tricuspídea. Fue significativamente mayor en los pacientes con disfunción del VD, con una intensa correlación con la FEVD-RMC. Un ratio S/D ≥ 1,5 predijo la disfunción VD en nuestro estudio. Este valor de corte se había asociado anteriormente a la mortalidad22.
Otros parámetros que se ha descrito que predicen la mortalidad en el síndrome de Eisenmenger son la dilatación de la aurícula derecha evaluada mediante el área de la aurícula derecha o el ratio de área de aurícula derecha/aurícula izquierda22. Se trata de marcadores sencillos y fiables de la disfunción diastólica del VD relacionados con la hipertrofia y el engrosamiento de la pared del VD, que es la respuesta inicial a la HAP28. Un shunt de larga evolución a nivel auricular en los pacientes con un shunt pretricuspídeo contribuye a producir la dilatación de la aurícula derecha5. En nuestro estudio, el área de la aurícula derecha fue un buen marcador de la función del VD y el área de la aurícula derecha ≥ 22cm2 predijo la disfunción del VD. Este valor se aproxima al valor de corte de 25cm2 para el que se ha descrito una asociación con la mortalidad 22.
Valor incremental de la evaluación de la función del VD mediante ecocardiografía bidimensionalEl componente transversal de la función sistólica del VD parece reflejar mejor la contracción global15. El CAFVD es una forma bidimensional sencilla de evaluar tanto el componente longitudinal como el componente transversal de la contracción del VD y está correlacionado con la FEVD-RMC en la HAP15,29. En nuestro estudio, el CAFVD mostró una buena correlación con la FEVD-RMC. En comparación con otros tipos de HAP, los pacientes con síndrome de Eisenmenger y un shunt postricuspídeo presentan un mejor CAFVD, debido probablemente a la función transversal del VD preservada30. Por otro lado, el CAFVD parece estar más comprometido en los pacientes con un shunt pretricuspídeo, debido probablemente a la adaptación diferente y tardía del VD 5. De igual modo, en los pacientes con tetralogía de Fallot, caracterizada por una sobrecarga volumétrica y dilatación del VD, el CAFVD mostró una alta correlación con la FEVD-RMC, mientras que las variables unidimensionales como la TAPSE no mostraron esa correlación31. El CAFVD puede presentar errores de medición y su combinación con otros índices puede equilibrar esos errores.
De entre los parámetros bidimensionales, la determinación de la deformación utilizando la técnica de speckle-tracking permite medir la deformación regional y global del miocardio. El aumento de la tensión en la pared, secundario a una mayor poscarga, reduce el acortamiento miocítico y la deformación. Un mayor grosor de la pared del VD permitió una buena detección automática del miocardio con el método de speckle-tracking en los pacientes con HAP. No obstante, la viabilidad de la DMGVD se vio limitada por la dilatación del VD. En tales casos, no todos los segmentos del VD encajaban en el campo de la ecografía, como se ha observado anteriormente en pacientes con tetralogía de Fallot24. La comparación del rendimiento de la DMGVD con el de otros parámetros tiene, pues, la limitación de que la muestra es diferente y más pequeña. Además, se han identificado discrepancias en los métodos de medición19. En nuestra cohorte, incluimos la deformación del tabique interventricular como componente de la DMGVD, que refleja no solo el VD sino también la función contráctil del VI. Las guías actuales de ASE/EACVI sugieren un valor> −20% como umbral anormal para la deformación de la pared libre del VD en la población general8. Cuando fue posible determinar la DMGVD, mostró una correlación intensa con la FEVD en nuestra cohorte y un valor de corte de −16% predijo la disfunción del VD. En la HAP, la DMGVD mostró una asociación con la mortalidad19. Además, la RMC determinó que la deformación del VD estaba correlacionada con el acoplamiento arterial ventricular y la carga arterial32. El remodelado cardiaco es diferente en los pacientes con síndrome de Eisenmenger respecto al observado en otros tipos de HAP, con una deformación longitudinal del VD similar, pero con una mayor deformación transversal del VD33. Sin embargo, la deformación transversal del VD es menor en los pacientes con un shunt pretricuspídeo que en los que tienen un shunt postricuspídeo, lo cual sugiere una alteración de la función del eje corto del VD con un remodelado adverso del VD27. De hecho, el VD de los pacientes con un shunt postricuspídeo se enfrenta a presiones superiores desde el nacimiento, lo cual da lugar a una modificación de la orientación de las fibras miocárdicas al que se denomina también “fenotipo fetal”34.
Para evaluar la forma compleja del VD y su remodelado en los pacientes con HAP, recientemente se ha desarrollado el IRVDTS9. El IRVDTS incorpora tanto el componente longitudinal de la adaptación del VD como la dimensión telesistólica. Este índice, que se mide en telesístole, cuando la tensión de la pared del VD es máxima en la HAP, ha resultado ser un potente marcador pronóstico del empeoramiento clínico en los adultos con HAP9. En los niños, el IRVDTS aumentó en los pacientes con HAP, en comparación con los controles, y se asoció a las variables hemodinámicas35. El IRVDTS se pudo determinar en todos los pacientes y la reproducibilidad interobservadores fue muy buena, lo cual eliminó la dificultad de evaluar la pared libre del VD dilatado en la diástole. En nuestro estudio, el IRVDTS mostró una correlación intensa con la disfunción del VD. El IRVDTS fue mayor en el grupo de disfunción del VD y su valor medio situaba a nuestra población en la peor zona de adaptación del VD propuesta por Amsallem et al.9. Este índice no parece apropiado para el shunt postricuspídeo, en el que la presencia de una comunicación interventricular no permite una medición completa de la longitud del tabique.
Los pacientes con un shunt pretricuspídeo y una HAP tienen una fisiología y una adaptación del VD desfavorables, con una mayor mortalidad4,36. La HAP aparece en una fase de la vida posterior a la del shunt postricuspídeo, con un VD menos capaz de adaptarse a presiones más altas, y la disfunción del VD tiene valor pronóstico en estos pacientes4,36. Así pues, la evaluación ecocardiográfica bidimensional es crucial en esos pacientes para evaluar con exactitud la eficacia de los fármacos específicos para la HAP y para ofrecerles un programa de trasplante adaptado de ser necesario, que clásicamente se basa en un trasplante de corazón y pulmón, pero también en un trasplante pulmonar doble con cierre del shunt.
LimitacionesNuestro estudio realizado en un solo centro tiene varias limitaciones. En primer lugar, el número de pacientes fue relativamente bajo, ya que se seleccionó una cohorte de pacientes con shunt pretricuspídeo y HAP en los que se realizó una RMC y un cateterismo cardiaco derecho. Sin embargo, el estudio pudo evidenciar la existencia de relaciones significativas entre los marcadores ecocardiográficos y la función del VD. Además, hasta la fecha, no ha habido ningún estudio que haya comparado la función VD ecocardiográfica con el patrón de referencia de la RMC. No evaluamos la ecocardiografía tridimensional del VD en nuestro estudio, aunque era un método viable para evaluar la función del VD. Sin embargo, de manera similar a lo que ocurre con la DMGVD, la viabilidad de la ecocardiografía tridimensional es limitada en los pacientes con un VD dilatado y es una técnica que depende del operador, requiere capacitación y tiene una curva de aprendizaje31.
Al crear una puntuación multiparamétrica, es importante elegir índices complementarios y reproducibles. En nuestro análisis exploratorio, combinamos índices de tamaño y de función del VD, tamaño de la aurícula derecha e índices de tiempo. En el futuro, en una cohorte más amplia, podría desarrollarse una puntuación ponderada que combine los índices más reproducibles y predictivos para la práctica clínica, teniendo en cuenta la variabilidad técnica de la medición. Además, esta puntuación ponderada podría evaluarse con la predicción de los resultados.
CONCLUSIONESNuestro estudio demuestra que el IRVDTS, el área de la aurícula derecha y la DMGVD son marcadores potentes de la disfunción del VD en los pacientes con un shunt pretricuspídeo e HAP. Queda por estudiar el valor pronóstico de estos parámetros en esta población.
FINANCIACIÓNS. Hascoet: “Heart Failure Research Grant” de la Sociedad Francesa de Cardiología.
S. Hascoet y E. Valdeolmillos: “Research team Grant” de la Federación Francesa de Cardiología.
CONTRIBUCIÓN DE LOS AUTORESE. Fournier, M. Selegny, E. Valdeolmillos y S. Hascoet diseñaron el estudio, elaboraron la versión preliminar del manuscrito y revisaron el manuscrito. E. Fournier, M. Selegny, M.A. Isorni, A. Azarine y S. Hascoet participaron en la obtención de los datos. S. Hascoet realizó el análisis estadístico. M. Amsallem, F. Haddad, E. Belli, S. Cohen, D. Montani, J. Le Pavec, A. Azarine, E. Fadel, M. Humbert, O. Sitbon, X. Jais, L. Savale, J. Zoghbi y M. A. Isorni revisaron el manuscrito y participaron en la aprobación de la versión final del manuscrito.
CONFLICTO DE INTERESESNinguno.
- •
La hipertensión arterial pulmonar es una complicación temida, poco habitual, de la comunicación interauricular. La función del ventrículo derecho es un marcador pronóstico clave.
Se han desarrollado parámetros de ecocardiografía bidimensional para la evaluación del ventrículo derecho, como la deformación y el índice de remodelado. Sin embargo, se dispone de pocos datos sobre su rendimiento en esos pacientes.
- •
La deformación miocárdica global del ventrículo derecho, el índice de remodelado del ventrículo derecho telesistólico y el área de la aurícula derecha son los parámetros ecocardiográficos más fiables de la FEVD en los pacientes con un shunt pretricuspídeo y HAP.
- •
Los parámetros de ecocardiografía bidimensional podrán mejorar la estratificación del riesgo en estos pacientes.
Los autores agradecen a Florence Lecerf y a Antoinette Wolfe su contribución a este trabajo.