Comparar la farmacodinámica del policomprimido CNIC (atorvastatina 40mg, ramipril 10mg, ácido acetilsalicílico 100mg) sobre el colesterol unido a lipoproteínas de baja densidad (cLDL) y presión arterial sistólica (PAS) con los productos de referencia, atorvastatina y ramipril.
MétodosEstudio multicéntrico, aleatorizado, abierto, de 3 grupos paralelos, que comparó el efecto del policomprimido CNIC frente a ramipril 10mg y atorvastatina 40mg sobre la PAS y cLDL. Los objetivos coprimarios fueron las diferencias en las medias ajustadas de PAS 24h (mediante monitorización ambulatoria de PA) y el cLDL durante el estudio, mediante un modelo ANCOVA.
ResultadosDe los 241 pacientes en la población por protocolo, 84 recibieron policomprimido CNIC (grupo A), 84 atorvastatina (grupo B), y 73 ramipril (grupo C). La PAS se redujo de 139,3 (12,5) a 133,2 (12,9) mmHg en el grupo A y de 138,1 (11,9) a 134,0 (12,8) mmHg en el grupo C (diferencia media ajustada de PAS desde niveles basales 1,77mmHg (IC90%, −0,5–4,0) a favor del grupo A, sin alcanzar diferencias significativas. El cLDL se redujo en 33,9 (21,6) y 29,2 (25,8) mg/dl en los grupos A y B, respectivamente (diferencia media ajustada desde niveles basales para el descenso del cLDL del 7,0% (IC90%, 1,5–12,4), significativamente a favor del policomprimido). Los 3 tratamientos fueron bien tolerados.
ConclusionesLos resultados de este estudio descartan un efecto negativo de la interacción entre los componentes del policomprimido-CNIC sobre la PA. La reducción del cLDL fue mayor con el policomprimido-CNIC, sugiriendo un efecto sinérgico de los componentes.
Palabras clave
La enfermedad cardiovascular es la principal causa de muerte prematura de adultos en todo el mundo y supone más del 30% del total de muertes1. En las últimas décadas, se ha descrito una reducción de la mortalidad cardiovascular en los países desarrollados, lo cual subraya la importancia de la prevención secundaria2. Las guías internacionales indican que el tratamiento farmacológico cardioprotector más eficaz para la prevención secundaria incluye el uso de inhibidores de la enzima de conversión de la angiotensina (IECA), estatinas y ácido acetilsalicílico a dosis bajas3–5. Lamentablemente, solo alrededor del 50% de los pacientes con una enfermedad cardiovascular establecida en países de renta alta y hasta el 5% en los países de renta baja reciben un tratamiento a largo plazo con la medicación recomendada por las guías, consistente en fármacos para la reducción de la presión arterial (PA), estatinas y antiagregantes plaquetarios6. Además, el registro EUROASPIRE V ha mostrado recientemente que solo el 48 y el 29% de los pacientes con enfermedad coronaria alcanzan los objetivos de reducción de, respectivamente, la PA y el colesterol unido a lipoproteínas de baja densidad (cLDL)7. Por consiguiente, es imprescindible mejorar la consecución de los objetivos relativos a los factores de riesgo cardiovascular8,9.
Diversos estudios han puesto de manifiesto que la combinación de estatinas, fármacos antihipertensivos y ácido acetilsalicílico en un mismo comprimido facilita la consecución de los objetivos del tratamiento de la PA, el cLDL y la antiagregación plaquetaria simultáneamente, en comparación con lo que se observa con el tratamiento mediante 1 o 2 de esos fármacos10–14. En consecuencia, la combinación de estos 3 fármacos en un policomprimido podría ser una estrategia clave, aplicable a gran escala para contener la pandemia de enfermedad cardiovascular ateroesclerótica8,9. De hecho, las guías indican que se puede considerar el uso del policomprimido para mejorar la adherencia y el control de los factores de riesgo3–5,15,16.
El estudio de los policomprimidos en diversos ensayos clínicos (13 hasta la fecha, que incluyen a casi 10.000 pacientes) ha mostrado una mejora en el control de los factores de riesgo10,12,13. El policomprimido del Centro Nacional de Investigaciones Cardiovasculares (CNIC) contiene ácido acetilsalicílico en dosis baja, ramipril y atorvastatina17, y a pesar de que se ha demostrado la bioequivalencia del policomprimido respecto a los 3 fármacos administrados solos17, no se han publicado estudios que hayan evaluado las posibles interacciones entre los 3 componentes cuando se administran juntos en un policomprimido. El presente estudio tiene por objetivo evaluar las interacciones farmacodinámicas entre los componentes del policomprimido del CNIC por lo que respecta a la reducción del cLDL y la PA sistólica (PAS) en comparación con los productos de referencia usados en monoterapia.
MÉTODOSSe realizó un estudio multicéntrico, aleatorizado, abierto y con dosis repetidas, de 3 grupos paralelos con diseño de enriquecimiento de la muestra. El objetivo principal fue comparar las interacciones farmacodinámicas que se produjeran con el policomprimido del CNIC (efecto en la PAS y el cLDL) y los productos de referencia, es decir, la atorvastatina y el ramipril. Los objetivos secundarios fueron comparar los valores de PA diastólica (PAD), colesterol unido a lipoproteínas de alta densidad (cHDL), colesterol total y triglicéridos de los distintos grupos al final del estudio. Por último, se evaluó también la seguridad y la tolerabilidad de los medicamentos. Se inscribió a los pacientes en 41 centros/hospitales distintos de Estados Unidos.
Los principales criterios de inclusión fueron: personas de ambos sexos y edad ≥ 18 y <75 años, hipertensión en estadio 1 (PAS/PAD, 140-159/90-99mmHg) o hipertensión en estadio 2 (PAS/PAD, 160-179/100-109mmHg) y cLDL ≥ 100 mg/dl. Los principales criterios de exclusión fueron: índice de masa corporal> 35, PAS <140mmHg o PAD <90mmHg, hipertensión grave (PAS> 180mmHg y PAD> 110mmHg), cLDL <100mg/dl, triglicéridos ≥ 400 mg/dl y antecedentes de eventos cardiovasculares. El estudio se llevó a cabo cumpliendo los principios éticos de la Declaración de Helsinki aprobada por la World Medical Association en 1964 (y sus modificaciones posteriores) y fue aprobado por el comité de ética de investigación y la Food and Drug Administration antes de iniciarlo. Todos los participantes dieron su consentimiento informado por escrito tras una explicación detallada de los objetivos y el protocolo.
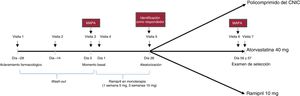
El diseño del estudio se presenta en la figura 1. El estudio constó de 3 fases consecutivas. La fase 1 consistió en un periodo de aclaramiento farmacológico de 4 semanas, seguido de un periodo de preinclusión de otras 4 semanas con ramipril en monoterapia (5mg de ramipril durante 1 semana y 10mg de ramipril durante 3 semanas), destinado a identificar a los pacientes con respuesta (fase 2). La respuesta de un paciente se definió como una disminución de la PAS ≥ 15mmHg después del periodo de preinclusión con ramipril (determinación realizada en la consulta). Solo se incluyó a los pacientes para quienes el investigador consideró segura la incorporación al periodo de aclaramiento farmacológico.
Los pacientes que mostraron respuesta al ramipril pasaron a la fase 3 del estudio, en la que se los aleatorizó en relación 1:1:1 a 1 de los 3 grupos de tratamiento durante 4 semanas: policomprimido del CNIC (ácido acetilsalicílico 100mg, atorvastatina 40mg y ramipril 10 mg), Altace (ramipril 10 mg) o Lipitor (atorvastatina 40 mg). Durante el estudio se supervisó la PA, y si un paciente tenía una PAS> 180mmHg o una PAD> 110mmHg (confirmada en 2 determinaciones), se le retiraba del estudio a criterio del investigador.
La determinación de la PA en la consulta se realizó al final del tratamiento con ramipril en monoterapia y la identificación de los pacientes con respuesta (visita 5, día 28±2 días). Esta determinación se basó en la media de 2 lecturas de la PA realizadas 2min después de que el paciente hubiera estado sentado durante 5min en un lugar tranquilo. La PAS para la evaluación de uno de los objetivos principales se determinó con la medición ambulatoria de la PA de 24 h basal (visita 3) y al final del estudio (visita 7). Los pacientes debían acudir al centro de estudio 24 h después de cada una de estas visitas para la retirada del dispositivo. Si fallaban las lecturas por razones técnicas, se realizaba una medición ambulatoria de la PA de 24 h adicional en un plazo de 24 a 72 h tras la visita programada. La medición ambulatoria de la PA de 24 h se realizó en un laboratorio central. Los procedimientos para el manejo correcto del dispositivo de monitorización ambulatoria de la PA de 24 h se detallaron en una guía específica.
Se calcularon los cambios del cLDL entre la situación inicial (visita 5) y el final del estudio (visita 7) con la fórmula de Friedewald.
El investigador realizó una supervisión cuidadosa de todos los posibles eventos adversos y adoptó las medidas clínicas necesarias para garantizar la seguridad de los participantes del estudio. Se registraron todos los eventos adversos, los eventos adversos graves y las muertes que tenían relación con el producto farmacéutico en investigación, así como los eventos adversos que motivaron el abandono prematuro del estudio.
Análisis estadísticoPartiendo del supuesto de una disminución mínima de la PAS de 15mmHg y una disminución media de 17,5mmHg ± una desviación estándar de 9mmHg y un cociente T/R real=1 (donde T es el tratamiento con el comprimido de la combinación cardiovascular a dosis fijas y R es el tratamiento con ramipril 10 mg), eran necesarios aproximadamente 80 participantes por grupo de tratamiento para mostrar que el intervalo de confianza del 90% (IC90%) estaba dentro del margen de equivalencia del 80 al 125%. Este número de participantes bastaba para demostrar la equivalencia farmacodinámica (disminución del cLDL) del comprimido de la combinación cardiovascular en dosis fijas y la atorvastatina en dosis de 40mg, con un margen de equivalencia absoluta de±6%.
Los datos cualitativos se presentan como frecuencia absoluta y relativa y las variables continuas, mediante media, mediana, desviación estándar, mínimo, máximo y número de pacientes con una observación. El análisis inferencial se limitó a las variables de presión arterial (PAS y PAD, determinación de la PA ambulatoria) y del perfil lipídico (cLDL, colesterol unido a lipoproteínas de muy baja densidad [cVLDL], cHDL, colesterol total y triglicéridos). Las demás variables se analizaron descriptivamente. Todas las pruebas estadísticas fueron bilaterales y se aplicaron utilizando un nivel de significación del 5%. Para las variables de PA y del perfil lipídico, se presentaron estimaciones de los efectos del tratamiento y el correspondiente IC90%.
Los objetivos farmacodinámicos principales de este estudio fueron el examen de las diferencias en los resultados de la media basal de PAS de 24 h ajustada mediante un modelo de ANCOVA (utilizando la determinación ambulatoria de la PA) entre la situación basal (visita 3) y la última visita (visita 7) del periodo de tratamiento, y la diferencia en las concentraciones de cLDL entre la basal (visita 5) y la de la última visita (visita 7) del periodo de tratamiento.
Mediante un análisis de covarianza que incluyó términos fijos para el tratamiento, el centro y con el valor inicial de PAS y de cLDL como covariables, se evaluaron las diferencias de los incrementos de PAS y cLDL entre los grupos después del tratamiento.
La equivalencia farmacodinámica entre el policomprimido del CNIC y la medicación de referencia se establecía si el IC90% del cociente obtenido para la diferencia en el cambio medio de la PAS de 24 h estaba dentro del intervalo de aceptación de 0,8 a 1,25.
Para el cLDL, el margen de equivalencia para la diferencia absoluta del cambio relativo entre la visita inicial y la final fue±6%.
Los objetivos secundarios de este estudio fueron el examen de la diferencia de los resultados ajustados de la PAD media de 24 h (mediante medición ambulatoria de la PA) entre la basal (visita 3) y la de la última visita (visita 7) del periodo de tratamiento, y la diferencia en los valores basales (visita 5) de cHDL, colesterol total y triglicéridos y los de la última visita (visita 7) del periodo de tratamiento. Todos los análisis se realizaron con el programa Statistical Analysis Software v9.2.
Formaron la población de análisis por protocolo todos los participantes aleatorizados con una buena adherencia (80-120%) a la medicación del estudio, de los que se disponía de al menos 1 determinación basal y otra posterior de los parámetros de valoración principales, PAS y cLDL, y que no tuvieron transgresiones importantes del protocolo. Se utilizó la población de análisis por protocolo para el análisis principal. Formaron la población de análisis de la seguridad todos los participantes que recibieron como mínimo 1 dosis del medicamento en investigación. Formaron la población de análisis por intención de tratar modificada todos los pacientes aleatorizados que recibieron como mínimo 1 dosis del medicamento en investigación y tenían una evaluación del objetivo principal posterior a la basal. Se utilizó la población de análisis por intención de tratar modificada para el análisis de sensibilidad destinado a descartar la influencia de la adherencia en los resultados.
Se elaboraron estadísticas de resumen y análisis de los objetivos farmacodinámicos principales y secundarios en la población de análisis por protocolo y la población de análisis por intención de tratar modificada. Los datos de seguridad y tolerabilidad presentados corresponden a la población de análisis de la seguridad.
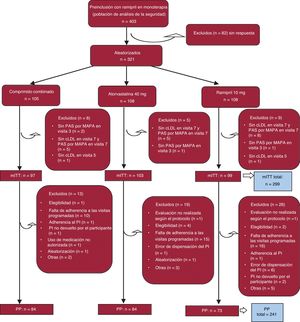
RESULTADOSEn la figura 2 se muestra el diagrama de flujo del estudio. Se incluyó en el estudio a un total de 403 participantes. De ellos, se incluyó a 321 en la aleatorización: 105 participantes al grupo con el policomprimido del CNIC, y 108 al grupo con atorvastatina 40mg y 108 al grupo con ramipril 10mg, que se incluyeron en el análisis de la seguridad. En la población de análisis por protocolo se incluyó a 241 participantes sin transgresiones importantes de protocolo y con una buena adherencia al tratamiento (80-120%), que fueron 84 del grupo con el policomprimido del CNIC, 84 del grupo con atorvastatina y 73 del grupo con ramipril. No se retiró del estudio a ningún paciente a causa de una hipertensión grave.
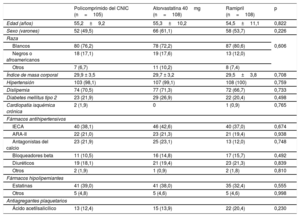
Las características demográficas y los tratamientos previos de la población para el análisis de la seguridad se resumen en la tabla 1. Los grupos de tratamiento estaban bien igualados. Los pacientes que presentaron una respuesta al ramipril en la fase de preinclusión mostraron una media de disminución de la PAS de 16,2±1,4mmHg (grupo con el policomprimido del CNIC), 19,6±12,9mmHg (grupo de atorvastatina) y 19,2±12,8mmHg (grupo de ramipril).
Características clínicas basales de la población del estudio (población para el análisis de la seguridad)
| Policomprimido del CNIC (n=105) | Atorvastatina 40mg (n=108) | Ramipril (n=108) | p | |
|---|---|---|---|---|
| Edad (años) | 55,2±9,2 | 55,3±10,2 | 54,5±11,1 | 0,822 |
| Sexo (varones) | 52 (49,5) | 66 (61,1) | 58 (53,7) | 0,226 |
| Raza | ||||
| Blancos | 80 (76,2) | 78 (72,2) | 87 (80,6) | 0,606 |
| Negros o afroamericanos | 18 (17,1) | 19 (17,6) | 13 (12,0) | |
| Otros | 7 (6,7) | 11 (10,2) | 8 (7,4) | |
| Índice de masa corporal | 29,9 ± 3,5 | 29,7 ± 3,2 | 29,5±3,8 | 0,708 |
| Hipertensión | 103 (98,1) | 107 (99,1) | 108 (100) | 0,759 |
| Dislipemia | 74 (70,5) | 77 (71,3) | 72 (66,7) | 0,733 |
| Diabetes mellitus tipo 2 | 23 (21,9) | 29 (26,9) | 22 (20,4) | 0,498 |
| Cardiopatía isquémica crónica | 2 (1,9) | 0 | 1 (0,9) | 0,765 |
| Fármacos antihipertensivos | ||||
| IECA | 40 (38,1) | 46 (42,6) | 40 (37,0) | 0,674 |
| ARA-II | 22 (21,0) | 23 (21,3) | 21 (19,4) | 0,938 |
| Antagonistas del calcio | 23 (21,9) | 25 (23,1) | 13 (12,0) | 0,748 |
| Bloqueadores beta | 11 (10,5) | 16 (14,8) | 17 (15,7) | 0,492 |
| Diuréticos | 19 (18,1) | 21 (19,4) | 23 (21,3) | 0,839 |
| Otros | 2 (1,9) | 1 (0,9) | 2 (1,8) | 0,810 |
| Fármacos hipolipemiantes | ||||
| Estatinas | 41 (39,0) | 41 (38,0) | 35 (32,4) | 0,555 |
| Otros | 5 (4,8) | 5 (4,6) | 5 (4,6) | 0,998 |
| Antiagregantes plaquetarios | ||||
| Ácido acetilsalicílico | 13 (12,4) | 15 (13,9) | 22 (20,4) | 0,230 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
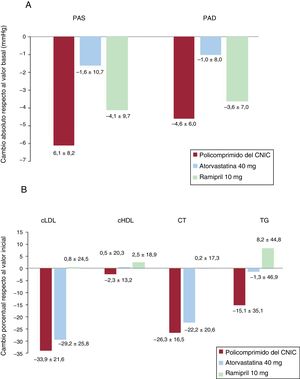
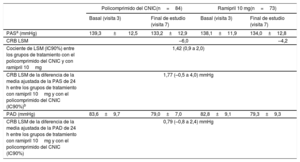
El cambio absoluto de la media ajustada de la PAS de 24 h respecto a la basal en el análisis de covarianza entre los participantes de los grupos de tratamiento con ramipril 10mg y con el policomprimido del CNIC fue de 1,77mmHg (–0,5 a 4,0), lo cual permite descartar la existencia de interacciones negativas de trascendencia clínica entre el ramipril y los demás componentes del policomprimido del CNIC. Los resultados mostraron una tendencia a una mayor reducción de la PAS (1,77mmHg) en el grupo con el policomprimido del CNIC que en el de ramipril solo (tabla 2). El cambio de la media ajustada de la PAD de 24 h respecto a la basal entre el grupo de ramipril 10mg y el del policomprimido del CNIC fue de 0,79 (–0,8 a 2,4). En la figura 3 se muestra el cambio absoluto de la PAS y la PAD al final del estudio.
Cambios en la presión arterial
| Policomprimido del CNIC(n=84) | Ramipril 10 mg(n=73) | |||
|---|---|---|---|---|
| Basal (visita 3) | Final de estudio (visita 7) | Basal (visita 3) | Final de estudio (visita 7) | |
| PASa (mmHg) | 139,3±12,5 | 133,2±12,9 | 138,1±11,9 | 134,0±12,8 |
| CRB LSM | –6,0 | –4,2 | ||
| Cociente de LSM (IC90%) entre los grupos de tratamiento con el policomprimido del CNIC y con ramipril 10mg | 1,42 (0,9 a 2,0) | |||
| CRB LSM de la diferencia de la media ajustada de la PAS de 24 h entre los grupos de tratamiento con ramipril 10mg y con el policomprimido del CNIC (IC90%)b | 1,77 (–0,5 a 4,0) mmHg | |||
| PAD (mmHg) | 83,6±9,7 | 79,0±7,0 | 82,8±9,1 | 79,3±9,3 |
| CRB LSM de la diferencia de la media ajustada de la PAD de 24 h entre los grupos de tratamiento con ramipril 10mg y con el policomprimido del CNIC (IC90%) | 0,79 (–0,8 a 2,4) mmHg | |||
CRB: cambio respecto al valor basal; IC90%: intervalo de confianza del 90%; LSM: media de mínimos cuadrados; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
A: cambios absolutos (media de mínimos cuadrados±desviación estándar) de la PAS/PAD. B: cambios porcentuales de los parámetros lipídicos respecto a los valores basales con el policomprimido del CNIC (n=84), la atorvastatina 40mg (n=84) y el ramipril 10mg (n=73). cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CT: colesterol total; PAD: presión arterial diastólica; PAS: presión arterial sistólica; TG: triglicéridos.
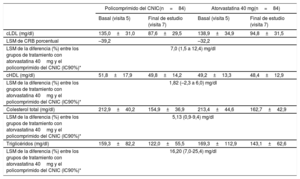
La media±desviación estándar del porcentaje de cambio del cLDL respecto al basal fue del 33,9±21,6% y el 29,2±25,8 en los grupos con el policomprimido del CNIC y con atorvastatina respectivamente. La media de mínimos cuadrados de la diferencia de cLDL en el cambio porcentual al final del tratamiento respecto a la situación inicial fue mayor, 7,0 [1,5-12,4] en el grupo del policomprimido, lo cual indica un efecto sinérgico entre los 2 componentes (ramipril y atorvastatina) del policomprimido del CNIC. Las reducciones de colesterol total y triglicéridos fueron también mayores en el grupo del policomprimido, lo cual indica un efecto sinérgico entre los componentes del policomprimido (media de mínimos cuadrados de la diferencia, 5,13 [0,9-9,4] y 16,20 [7,0-25,4] respectivamente). La diferencia entre los grupos en cuanto al cHDL fue menor (1,82 [–2,3 a 6,0]) (tabla 3). En la figura 3 se muestra el porcentaje de cambio de los parámetros lipídicos. Los resultados del análisis por intención de tratar fueron similares a los de la población de análisis por protocolo.
Cambios en los parámetros lipídicos
| Policomprimido del CNIC(n=84) | Atorvastatina 40 mg(n=84) | |||
|---|---|---|---|---|
| Basal (visita 5) | Final de estudio (visita 7) | Basal (visita 5) | Final de estudio (visita 7) | |
| cLDL (mg/dl) | 135,0±31,0 | 87,6±29,5 | 138,9±34,9 | 94,8±31,5 |
| LSM de CRB porcentual | –39,2 | –32,2 | ||
| LSM de la diferencia (%) entre los grupos de tratamiento con atorvastatina 40mg y el policomprimido del CNIC (IC90%)* | 7,0 (1,5 a 12,4) mg/dl | |||
| cHDL (mg/dl) | 51,8±17,9 | 49,8±14,2 | 49,2±13,3 | 48,4±12,9 |
| LSM de la diferencia (%) entre los grupos de tratamiento con atorvastatina 40mg y el policomprimido del CNIC (IC90%)* | 1,82 (–2,3 a 6,0) mg/dl | |||
| Colesterol total (mg/dl) | 212,9±40,2 | 154,9±36,9 | 213,4±44,6 | 162,7±42,9 |
| LSM de la diferencia (%) entre los grupos de tratamiento con atorvastatina 40mg y el policomprimido del CNIC (IC90%)* | 5,13 (0,9-9,4) mg/dl | |||
| Triglicéridos (mg/dl) | 159,3±82,2 | 122,0±55,5 | 169,3±112,9 | 143,1±62,6 |
| LSM de la diferencia (%) entre los grupos de tratamiento con atorvastatina 40mg y el policomprimido del CNIC (IC90%)* | 16,20 (7,0-25,4) mg/dl | |||
cHDL: colesterol unido a lipoproteínas de alta densidad; cLDL: colesterol unido a lipoproteínas de baja densidad; CRB: cambio porcentual respecto al valor basal; IC90%: intervalo de confianza del 90%; LSM: media de mínimos cuadrados.
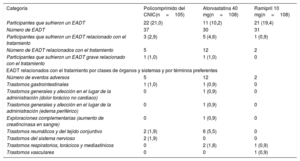
Por lo que respecta a la seguridad, 9 de los 321 participantes (2,8%) presentaron tras la aleatorización un total de 19 eventos adversos durante el tratamiento (EADT) relacionados con el tratamiento. En la tabla 4 se muestra el total de evenos adversos observados durante la fase de aleatorización en la población del análisis de la seguridad (la población del análisis de la seguridad se define como la formada por todos los pacientes aleatorizados que recibieron como mínimo 1 dosis de los medicamentos del estudio). Después de la aleatorización, el número de participantes con EADT relacionados con el tratamiento fue mayor en el grupo de atorvastatina 40mg (12; 11,1%) que en los del policomprimido combinado (5; 4,7%) y de ramipril 10mg (2; 1,8%). La mayor parte de los EADT fueron de poca intensidad. No hubo ninguna observación de interés en cuanto a los parámetros analíticos, las constantes vitales, la exploración física o el electrocardiograma. No se registró ninguna muerte durante el estudio.
Total de eventos adversos durante la fase de aleatorización en la población para el análisis de la seguridad
| Categoría | Policomprimido del CNIC(n=105) | Atorvastatina 40 mg(n=108) | Ramipril 10 mg(n=108) |
|---|---|---|---|
| Participantes que sufrieron un EADT | 22 (21,0) | 11 (10,2) | 21 (19,4) |
| Número de EADT | 37 | 30 | 31 |
| Participantes que sufrieron un EADT relacionado con el tratamiento | 3 (2,9) | 5 (4,6) | 1 (0,9) |
| Número de EADT relacionados con el tratamiento | 5 | 12 | 2 |
| Participantes que sufrieron un EADT grave relacionado con el tratamiento | 1 (1,0) | 1 (1,0) | 0 |
| EADT relacionados con el tratamiento por clases de órganos y sistemas y por términos preferentes | |||
| Número de eventos adversos | 5 | 12 | 2 |
| Trastornos gastrointestinales | 1 (1,0) | 1 (0,9) | 0 |
| Trastornos generales y afección en el lugar de la administración (dolor torácico no cardiaco) | 0 | 1 (0,9) | 0 |
| Trastornos generales y afección en el lugar de la administración (edema periférico) | 0 | 1 (0,9) | 0 |
| Exploraciones complementarias (aumento de creatincinasa en sangre) | 0 | 1 (0,9) | 0 |
| Trastornos reumáticos y del tejido conjuntivo | 2 (1,9) | 6 (5,5) | 0 |
| Trastornos del sistema nervioso | 2 (1,9) | 0 | 0 |
| Trastornos respiratorios, torácicos y mediastínicos | 0 | 2 (1,8) | 1 (0,9) |
| Trastornos vasculares | 0 | 0 | 1 (0,9) |
EADT: evento adverso durante el tratamiento.
Los EADT incluían a los participantes que recibieron la medicación del estudio. Los porcentajes se basan en todos los participantes a los que se dispensó la medicación en cada grupo de tratamiento para el tratamiento real recibido.
Salvo otra indicación, los valores expresan n (%) o media±desviación estándar.
Los resultados de nuestro estudio indican que puede descartarse la existencia de una interacción farmacocinética negativa entre los componentes del policomprimido (es decir, una disminución del efecto de reducción de la PA del ramipril a causa de una posible interacción con el ácido acetilsalicílico). Además, no se observaron diferencias significativas en el número total de participantes que presentaron EADT en el grupo con el policomprimido del CNIC en comparación con los grupos de ramipril y atorvastatina. Así pues, el policomprimido del CNIC debe considerarse al menos igual de seguro que los fármacos de referencia administrados solos.
Aunque los resultados de un estudio farmacocinético previo18 pusieron de manifiesto la bioequivalencia entre el policomprimido y los correspondientes componentes administrados solos, no se han presentado hasta ahora los resultados del estudio de interacción farmacodinámica. Se planteó la hipótesis de que el posible perjuicio en el efecto hipotensor se asociaba con los diferentes mecanismos de acción de los 2 componentes (IECA y ácido acetilsalicílico) en la producción de prostaglandinas. Por un lado, los IECA aumentan las concentraciones de bradicinina, con lo que fomentan la producción de prostaglandinas vasodilatadoras; por otro, el ácido acetilsalicílico inhibe la producción de prostaglandinas a través de su efecto en la actividad de la ciclooxigenasa19. Aunque algunos autores20 no han confirmado esta asociación negativa, otros apuntan a un efecto relacionado con la dosis al utilizar dosis medias a altas de ácido acetilsalicílico, pero no con las dosis bajas administradas de manera concomitante con los IECA21–23. Nosotros no observamos una interacción farmacodinámica negativa en nuestro estudio, aunque hubo una tendencia a una reducción más notable de la PAS en el grupo con el policomprimido del CNIC que en el grupo tratado con ramipril 10mg en monoterapia. Es de destacar que, tras la fase de preinclusión con ramipril, la disminución de la PAS fue menor en el grupo con el policomprimido del CNIC que en el de ramipril. Estas discrepancias podrían explicarse por las distintas técnicas de determinación utilizadas durante el estudio. Por último, 2 metanálisis realizados para evaluar las repercusiones de esta interacción descartaron la posibilidad de que el uso concomitante de los 2 medicamentos tuviera una influencia negativa en su capacidad de protección cardiovascular24,25.
Nuestros resultados también muestran una reducción más notable del cLDL, el colesterol total y los triglicéridos en el grupo con el policomprimido del CNIC que en el de atorvastatina 40mg, que es independiente de la adherencia a la medicación, ya que el análisis se realizó en la población de análisis por protocolo. Hasta donde sabemos, este es el primer estudio que muestra un posible efecto sinérgico de un IECA y una estatina, incluidos ambos en un policomprimido, por lo que respecta al cLDL. Aunque hay suficientes datos que demuestran que la combinación de una estatina con un IECA tiene un efecto sinérgico positivo en la actividad de protección cardiovascular (es decir, efectos beneficiosos en la función endotelial, la inflamación vascular, la resistencia a la insulina y la aparición, progresión y rotura de placas ateromatosas29–33), se dispone de pocos datos sobre los efectos de los IECA en las concentraciones de cLDL. Varios estudios han puesto de manifiesto que la combinación de una estatina con ciertos IECA reduce las concentraciones de cLDL32,33, aunque no se ha observado un efecto en estos parámetros34,35. Se ha demostrado que la angiotensina II aumenta el ARNm de la proteína 1 similar al C1 de Niemann-Pick (proteína NPC1L1, identificada como una molécula clave en la absorción de colesterol en el intestino) y las concentraciones de la proteína en las células Caco-2, que fue bloqueada por completo por un antagonista del receptor de tipo 1 de la angiotensina II36. Esta acción podría estar relacionada con el efecto observado en nuestro estudio. Sin embargo, el presente estudio se diseñó para evaluar la equivalencia farmacodinámica del policomprimido del CNIC con el componente solo, pero no el mecanismo de acción que subyace a la acción sinérgica observada. Así pues, serán necesarios nuevos estudios para esclarecer el mecanismo de acción de esta interesante observación. Por último, la diferencia en las concentraciones de cLDL en el grupo con el policomprimido del CNIC respecto a los demás grupos fue del 7%. Está claramente establecido que cada aumento al doble de la dosis de estatina reduce el cLDL en alrededor del 6%26–28. Por consiguiente, los resultados de este estudio indican que el uso de un policomprimido que contenga atorvastatina, ácido acetilsalicílico y ramipril sería equivalente a aumentar al doble la dosis de una estatina en monoterapia por lo que respecta a la reducción del cLDL, si bien deberá realizarse un estudio específico para evaluar esta equivalencia.
Este posible efecto sinérgico podría traducirse también en un efecto clínico relevante, dada la intensa relación existente entre la reducción del cLDL y la disminución de la frecuencia de eventos cardiovasculares. Así pues, se ha demostrado que cada 1 mmol/l de reducción del cLDL corresponde a una disminución del 20% en las muertes por enfermedad coronaria37.
Por último, no hubo diferencias entre el grupo con el policomprimido del CNIC y las correspondientes monoterapias en cuanto al número total de EADT. En consecuencia, el posible efecto sinérgico entre la atorvastatina y el ramipril no se traduce en un mayor riesgo de eventos adversos10,13.
LimitacionesEste estudio tiene ciertas limitaciones. El hecho de que no fuera un estudio a doble ciego y su diseño abierto podrían tener algunas repercusiones en los resultados. Además, no se incluyó en el análisis final a un 20% de los pacientes aleatorizados, lo cual podría considerarse también otra limitación del estudio, si bien la principal razón de este efecto es la transgresión de protocolo y no una falta de adherencia al tratamiento. Además, la población final de análisis por protocolo fue la prevista. Estas observaciones podrían minimizar la limitación antes mencionada. Será necesario un estudio aleatorizado y a doble ciego para confirmar los efectos sinérgicos del policomprimido del CNIC no solo en los factores de riesgo cardiovascular, sino también en la reducción de la frecuencia de eventos cardiovasculares.
CONCLUSIONESLos resultados de este estudio descartan un efecto negativo en la PA como consecuencia de la interacción entre los componentes incluidos en el policomprimido del CNIC. La reducción del cLDL fue mayor en el grupo con el policomprimido del CNIC, lo cual indica un efecto sinérgico de los componentes. Este efecto sinérgico no se tradujo en una mayor frecuencia de efectos adversos.
FINANCIACIÓNContent Ed Net Madrid (España) aportó ayuda editorial y de redacción, financiada por Ferrer Internacional S.A.
- –
Varios ensayos clínicos han demostrado la seguridad y la eficacia de los policomprimidos cardiovasculares en la prevención cardiovascular.
- –
El policomprimido del CNIC contiene ácido acetilsalicílico, ramipril y atorvastatina, y aunque se ha demostrado la bioequivalencia entre el policomprimido y los 3 fármacos administrados solos, no se han realizado estudios para evaluar sus posibles interacciones farmacodinámicas.
- –
Sin embargo, esta información es importante, dado que los datos sobre la posible interacción entre los diversos componentes cuando se administran por separado son contradictorios.
- –
Los resultados de este estudio descartan un efecto negativo en la presión arterial como consecuencia de la interacción entre los componentes incluidos en el policomprimido del CNIC.
- –
La reducción del cLDL fue mayor en el grupo con el policomprimido del CNIC, lo cual indica un efecto sinérgico de los componentes.
- –
Por consiguiente, no cabe prever que haya diferencias de efectividad o seguridad clínica cuando se administran los diversos componentes en forma de policomprimido.
J.R. González-Juanatey ha recibido pagos por conferencias de Ferrer. N. Oudovenko es empleada de Ferrer. Los demás autores no tienen nada que declarar.
Los autores desean expresar su agradecimiento a José Luis Lorenzo Ferrer, empleado de Ferrer, por su ayuda en la corrección del manuscrito.