Evaluar mediante tomografía de coherencia óptica (OCT) el proceso de cicatrización neointimal tras el implante de stents de cromo cobalto con recubrimiento de titanio-óxido nítrico (TiNO) y de stents de platino-cromo liberadores de everolimus (SLE) con polímero biodegradable en pacientes con síndrome coronario agudo.
MétodosLos pacientes fueron aleatorizados (1:1) para recibir el stent TiNO o SLE. Se obtuvieron imágenes de OCT a los 30 días (cohorte A, n=52) y a los 6 meses (cohorte B, n=30) de seguimiento. El objetivo primario del estudio fue el porcentaje de struts no cubiertos por paciente.
ResultadosEn la cohorte A, el porcentaje de struts no cubiertos fue menor con los stents TiNO que con los SLE (3,2% frente a 19,6%, p <0,001). El porcentaje de struts mal apuestos fue del 0,4% en el grupo TiNO y del 2,1% en el grupo SLE (p <0,001). En la cohorte B, el porcentaje de struts no cubiertos también fue menor con los stents TiNO (0,0% frente a 8,7% (p <0,001). El porcentaje de struts mal apuestos fue del 0% en el grupo de stent TiNO y del 0,3% en el grupo de SLE (p=0,008). A ninguno de los pacientes se les tuvo que repetir la revascularización durante los 6 meses de seguimiento.
ConclusionesTras una intervención percutánea por síndrome coronario agudo, el implante de un stent TiNO se asoció a un menor porcentaje de struts no cubiertos y mal apuestos por paciente, en comparación con el SLE, en un seguimiento temprano y a medio plazo.
Este estudio está registrado en CinicalTrial.gov con número NCT02464397.
Palabras clave
El proceso de cicatrización neointimal después del implante del stent es un factor decisivo en el resultado a largo plazo. Han surgido dudas sobre el recubrimiento neointimal incompleto de los struts del stent, que es el principal factor de riesgo de trombosis del stent (TS) temprana y tardía1–3. La tomografía de coherencia óptica (OCT) es la modalidad de imagen invasiva preferida para evaluar pequeños grados de recubrimiento neointimal después del implante del stent4. La introducción de los stents farmacoactivos (SFA), en comparación con los stents metálicos (SM), redujo las cifras de repeticiones de la revascularización5,6. Sin embargo, los datos de los registros mostraron tasas más altas de TS (muy) tardía con los SFA de primera generación en comparación con los SM7. Estas preocupaciones en torno a su seguridad se abordaron mediante la creación de SFA de segunda generación y ampliando la duración del tratamiento antiagregante plaquetario doble8,9. En un metanálisis reciente, la incidencia de TS tardía fue inferior con los SFA de segunda generación que con los de primera generación y los SM10. Por lo tanto, la guía más reciente recomienda los SFA de segunda generación frente a los SM10. Los stents recubiertos con óxido de nitruro de titanio (TiNO) tienen la ventaja teórica de un recubrimiento del strut más rápido y completo que los SFA, sin la hiperplasia intimal excesiva que se encuentra en los SM11–14. La seguridad de los stents de acero inoxidable con TiNO se ha demostrado en ensayos clínicos aleatorizados en pacientes con síndrome coronario agudo (SCA) y recientemente en el ensayo TIDES-ACS, que comparó los mismos stents utilizados en el presente estudio12,13. En estudios previos de OCT, los stents de acero inoxidable con TiNO han mostrado un mejor recubrimiento del stent en comparación con los stents liberadores de everolimus (SLE) de polímero permanente de nueva generación en pacientes con SCA14–16. Se ha señalado que los polímeros permanentes de los SFA podrían ser la causa de la inflamación crónica, la reacción de hipersensibilidad, el retraso de la cicatrización neointimal y la neoateroesclerosis, que son conocidos factores de riesgo de TS (tardía)17. El SFA de polímero completamente biodegradable se creó para superar estas limitaciones, aunque en los ensayos clínicos del SFA de polímero biodegradable no se ha demostrado un beneficio clínico claro sobre el SFA de polímero permanente18. Se ha tratado de evaluar mediante OCT la cicatrización neointimal temprana y a medio plazo del stent de cobalto y cromo recubierto con TiNO de nueva generación (OPTIMAX) y se lo ha comparado con el implante de SLE de platino y cromo de polímero biodegradable (SYNERGY) en pacientes con SCA.
MÉTODOSSelección de pacientes y diseño del estudioEl OPTIMAX-OCT es un estudio prospectivo aleatorizado que se llevó a cabo en 2 centros (Heart Center, Satakunta Central Hospital, Pori, Finlandia, y Cardiovascular Center Aalst, Aalst, Bélgica). En el estudio se comparó el proceso de cicatrización neointimal evaluado por OCT a los 30 días y a los 6 meses de seguimiento del implante del stent con TiNO OPTIMAX (Hexacath, Francia) y el SLE SYNERGY (Boston Scientific Corporation, Estados Unidos) en pacientes con SCA. El estudio incluyó a pacientes con SCA y al menos 1 lesión de novo importante (≥ 50% de diámetro) en una arteria coronaria nativa. Los principales criterios de exclusión fueron el shock cardiogénico, la enfermedad del tronco coronario izquierdo no protegido o las lesiones ostiales, la intolerancia a los medicamentos del estudio y la participación simultánea en otro estudio. Los criterios de selección se resumen en el epígrafe 1 del material adicional. Se aleatorizó a los pacientes seleccionados de manera individual para que recibieran un stent con TiNO o un SLE. La aleatorización se generó con un programa informático. Por necesidad, no se aplicó el enmascaramiento de los cirujanos en la asignación del grupo de stent; sin embargo, sí se aplicó a los investigadores que llevaron a cabo el análisis y el tratamiento de datos de la OCT y a los pacientes. A efectos de seguimiento, los pacientes se dividieron en la cohorte A, a la que se evaluó con OCT a los 30 días de seguimiento, y la cohorte B, a la que se evaluó con OCT a los 6 meses de seguimiento. El seguimiento clínico de los pacientes se hizo en el momento asignado para comprobar la aparición de eventos adversos cardiovasculares mayores. Los detalles de la intervención coronaria percutánea (ICP), la intervención farmacológica adyuvante y las definiciones de los objetivos clínicos se presentan en el epígrafe 2 del material adicional.
Los investigadores iniciaron el estudio, que se llevó a cabo de acuerdo con las directrices éticas de la Declaración de Helsinki de 1964, revisada en 2013. Se obtuvo el consentimiento informado por escrito de cada paciente después de la explicación completa del protocolo del estudio. El protocolo fue revisado y aprobado por los comités de ética de los centros participantes. El estudio OPTIMAX-OCT está registrado en ClinicalTrials.gov con el número NCT02464397.
Descripción de los aparatosEl OPTIMAX es un stent expandible con balón de strut fino (81 μm) sobre una plataforma de cobalto y cromo con un diseño helicoidal doble. La plataforma del stent está recubierta con TiNO por deposición química de titanio en fase de vapor mejorada por plasma en una mezcla de gas de nitrógeno y oxígeno preespecificada, en una cámara de vacío. El SYNERGY es un stent expandible con balón de strut fino (74-81 μm) sobre una plataforma de platino y cromo recubierta con un polímero abluminal (poli-D,L-lacto-coglucolato) biodegradable ultrafino (4 μm), que libera everolimus (100 μg/cm2).
Adquisición de las imágenes de tomografía de coherencia óptica y su análisisLa adquisición de imágenes de OCT se presenta en el epígrafe 3 del material adicional. Se utilizó un programa patentado (St. Jude Medical, Estados Unidos) para analizar secciones transversales a intervalos de 1mm (cada 5 fotogramas) dentro del segmento con stent. El área transversal (AT) del stent y el AT de la luz se trazaron de manera semiautomática. El área de hiperplasia neointimal (HNI) se calculó restando el AT de la luz del AT del stent. El porcentaje del área de HNI se calculó como la relación entre el área de la HNI y el AT del stent multiplicado por 100. En cada sección transversal se contó el número total de struts analizables. Los struts se clasificaron en no recubiertos si alguna parte del strut estaba visiblemente expuesta a la luz o recubiertos si una capa de tejido era visible en todas las superficies reflectantes. El porcentaje de struts no recubiertos se calculó como la relación entre los struts no recubiertos y el total multiplicado por 100. En los struts recubiertos, el grosor de la HNI se midió desde el marcador del strut hasta el borde endoluminal del recubrimiento del tejido siguiendo la línea recta que conecta el marcador con el centro de gravedad del vaso19. La aposición se evaluó midiendo la distancia entre el marcador del strut y el contorno de la luz siguiendo la línea recta que conecta el marcador con el centro de gravedad del vaso. Se añadió un margen de 18 μm a modo de corrección para la mitad del blooming. Los struts con una distancia al contorno de la luz mayor que la suma del grosor del strut (más el grosor del polímero en los caso de SLE) +18 μm se consideraron mal apuestos. Dado un grosor de strut recubierto de 81 μm, se adoptó un umbral de mala aposición de 100 μm para los stents con TiNO (81 + 18 = 99 μm). Del mismo modo, dado un grosor de strut de 81 μm y un grosor de polímero de 4 μm, se adoptó un umbral de mala aposición de 100 μm para los SLE (81 + 4 + 18=103 μm). El porcentaje de struts mal apuestos se calculó como la relación entre los struts mal apuestos y el total multiplicado por 100. Los struts ubicados en el ostium de una rama lateral se clasificaron como struts de rama lateral no apuestos y se excluyeron del análisis. El trombo se definió como una masa irregular de alta o baja retrodispersión (trombo rojo o blanco) que protruye de la superficie a la luz de manera discontinua. Dos investigadores ciegos a las características de los pacientes y el tipo de stent utilizado llevaron a cabo por separado el análisis de las OCT fuera de línea.
Análisis estadísticosLos cálculos del tamaño de la muestra se hicieron con base en estudios de OCT previos que compararon los stents con TiNO y los SLE de polímero permanente de nueva generación en pacientes con SCA14,15. Se supuso que se analizaría una media de 150 struts por paciente. El cálculo del tamaño de la muestra se basó en el porcentaje de struts recubiertos por paciente al cabo de 1 mes (cohorte A) y a los 6 meses (cohorte B) de seguimiento. Se han formulado las siguientes hipótesis:
En el seguimiento al mes, la media de struts recubiertos por paciente con stents con TiNO sería del 96% y con SLE, del 85%. Se necesitaría un tamaño de muestra de 50 pacientes (1:1; stents con TiNO frente a SLE, 25 frente a 25) para rechazar la hipótesis de diferencia nula con una potencia del 90% (ß=0,90) y un alfa bilateral de 0,05. El tamaño total de la muestra representa una pérdida de seguimiento del 5%.
En el seguimiento a los 6 meses, la media de struts recubiertos por paciente con stents con TiNO sería del 99% y con SLE, del 92%. Se necesitaría un tamaño de muestra de 30 pacientes (1:1; stents con TiNO frente a SLE, 15 frente a 15) para rechazar la hipótesis de diferencia nula con una potencia del 80% (ß=0,80) y un alfa bidireccional de 0,05. El tamaño total de la muestra representa una pérdida de seguimiento del 5%.
Las variables cualitativas se describen como frecuencias absolutas y relativas (porcentaje), mientras que las variables continuas se registran como mediana [intervalo intercuartílico] o media±desviación estándar, según corresponda. El objetivo principal fue el porcentaje de struts no recubiertos por paciente y el objetivo coprincipal fue el porcentaje de struts mal apuestos por paciente, evaluados a los 30 días y a los 6 meses de seguimiento. Para tener en cuenta la falta de independencia de los struts en la misma lesión, se adoptó el método de análisis no paramétrico de los datos agregados para comparar el porcentaje de struts no recubiertos (y mal apuestos) por paciente entre los 2 grupos de stents (análisis por pacientes) en cada cohorte por separado. En resumen, el porcentaje por pacientes se calculó primero en cada paciente de un grupo de stents y luego la mediana de estos porcentajes se describió como el estimador del porcentaje general del grupo20. También se notificó el porcentaje bruto de struts no recubiertos (y mal apuestos) de todo el grupo de stents (análisis por struts) en cada cohorte por separado. Para comparar los datos entre los 2 grupos, se utilizaron la prueba de la χ2 de Pearson, la prueba exacta de Fisher, la prueba de la t de Student para datos no emparejados o la prueba de Mann-Whitney según correspondiera. Todas las pruebas fueron bilaterales y un valor de p <0,05 se consideró estadísticamente significativo. Los datos se analizaron mediante SPSS v. 21 (SPSS IBM Inc., Estados Unidos).
RESULTADOSCaracterísticas inicialesCohorte ADe enero a octubre de 2015, se inscribió a 57 pacientes que reunían las condiciones: 30 pacientes recibieron stents recubiertos con TiNO y 27, SLE. Dos pacientes del grupo de stent con TiNO y 3 del grupo de SLE retiraron su consentimiento y no asistieron al seguimiento. Por último, 52 pacientes estuvieron disponibles para el análisis (28 del grupo del stent con TiNO y 24 en el del SLE). La media de edad de la cohorte A fue de 62,9±9,0 años; el 30,8% eran mujeres y el 15,4%, diabéticos. El diámetro del vaso de referencia fue menor en los pacientes que recibieron el SLE; otros datos basales eran comparables (tabla 1). No se observaron eventos adversos cardiovasculares mayores en ninguno de los grupos de stents a los 30 días. Ningún paciente tenía estenosis ≥ 50% del diámetro a los 30 días.
Características basales
| Cohorte A | Cohorte B | |||||
|---|---|---|---|---|---|---|
| Stent con TiNO(n=28) | SLE(n=24) | p | Stent con TiNO(n=16) | SLE(n=14) | p | |
| Edad (años) | 61,7±8,3 | 64,4±9,8 | 0,29 | 60,0±10,4 | 57,0±9,9 | 0,42 |
| Mujeres | 8 (28,6) | 8 (33,3) | 0,71 | 4 (25,0) | 1 (7,1) | 0,20 |
| Hipertensión | 14 (50) | 14 (58,3) | 0,54 | 12 (75,0) | 2 (14,3) | 0,001 |
| Hipercolesterolemia | 11 (39,3) | 12 (50) | 0,43 | 13 (81,3) | 4 (28,6) | 0,004 |
| Diabetes mellitus | 5 (17,9) | 3 (12,5) | 0,71 | 2 (12,5) | 0 (0,0) | 0,48 |
| Fumadores en activo | 10 (35,7) | 7 (29,2) | 0,61 | 5 (31,3) | 7 (50,0) | 0,29 |
| IM previo | 4 (14,8) | 2 (8,3) | 0,67 | 4 (25,0) | 2 (14,3) | 0,65 |
| ICP previa | 5 (18,5) | 2 (8,3) | 0,42 | 2 (12,5) | 0 (0,0) | 0,48 |
| Cirugía de revascularización coronaria previa (%) | 2 (7,4) | 0 | 0,49 | 0 | 0 | NA |
| Presentación con IM con elevación del segmento ST | 8 (28,6) | 8 (33,3) | 0,71 | 1 (6,3) | 6 (42,9) | 0,06 |
| Vaso de referencia | ||||||
| Descendente anterior izquierda | 12 (42,9) | 9 (37,5) | 0,90 | 8 (50,0) | 7 (50,0) | 0,19 |
| Circunfleja izquierda | 7 (25,0) | 6 (25,0) | 6 (37,5) | 2 (14,3) | ||
| Arteria coronaria derecha | 9 (32,1) | 9 (37,5) | 2 (12,5) | 5 (35,7) | ||
| Lesión inicial calcificada | 10 (35,7) | 6 (25,0) | 0,40 | 1 (6,3) | 3 (21,4) | 0,31 |
| Trombo | 4 (14,3) | 4 (16,7) | 1,0 | 3 (18,8) | 4 (28,6) | 0,67 |
| Bifurcación | 2 (7,1) | 1 (4,2) | 1,0 | 0 (0,0) | 1 (7,1) | 0,46 |
| Diámetro del vaso de referencia (mm) | 3,15±0,29 | 2,83±0,55 | 0,02 | 2,87±0,49 | 3,12±0,35 | 0,12 |
| Estenosis del diámetro (%) | 84±14 | 81±14 | 0,38 | 82±18 | 83±14 | 0,83 |
| Longitud de la lesión (mm) | 14,6±4,6 | 14,5±4,2 | 0,92 | 16,0±5,5 | 18,3±2,9 | 0,18 |
| Grado de flujo TIMI previo a la intervención | 2,6±0,9 | 2,4±1,1 | 0,40 | 2,4±1,2 | 2,6±1,1 | 0,64 |
| Acceso radial | 24 (85,7) | 16 (66,7) | 0,10 | 15 (93,8) | 11 (78,6) | 0,31 |
| Predilatación | 25 (96,2) | 20 (87,0) | 0,33 | 10 (71,4) | 11 (78,6) | 1,0 |
| Diámetro del stent (mm) | 3,21±0,30 | 3,14±0,35 | 0,38 | 3,08±0,37 | 3,30±0,44 | 0,15 |
| Longitud del stent (mm) | 17,2±3,7 | 18,5±3,7 | 0,21 | 18,0±4,6 | 21,0±3,4 | 0,058 |
| Presión en la liberación del stent | 14,2±3,4 | 14,0±2,6 | 0,83 | 13,7±2,5 | 13,3±2,2 | 0,64 |
| Sin reflujo | 0 (0) | 0 (0) | NA | 0 (0) | 0 (0) | NA |
| Grado de flujo TIMI tras la intervención | 3,0±0,0 | 2,96±0,2 | 0,32 | 3,0±0,0 | 3,0±0,0 | NA |
| Fallo del stent | 0 | 0 | NA | 0 | 0 | NA |
| Éxito de la intervención | 28 (100) | 24 (100) | NA | 16 (100) | 14 (100) | NA |
| Medicamento antitrombótico | ||||||
| Ácido acetilsalicílico | 28 (100) | 24 (100) | NA | 16 (100) | 14 (100) | NA |
| Inhibidor de P2Y12 | 28 (100) | 24 (100) | NA | 16 (100) | 14 (100) | NA |
ICP: intervención coronaria percutánea; IM: infarto de miocardio; SLE: stents liberadores de everolimus; TIMI: Thrombolysis in Myocardial Infarction; TiNO: óxido de nitruro de titanio.
Las variables continuas se expresan como media ± desviación estándar y las cualitativas, como n (%).
De diciembre de 2014 a abril de 2016, se inscribió a 38 pacientes que reunían las condiciones: 20 recibieron stents recubiertos con TiNO y 18, SLE. Cuatro pacientes del grupo del stent con TiNO y 4 en el del SLE retiraron su consentimiento y no asistieron al seguimiento. Por último, 30 pacientes estuvieron disponibles para el análisis (16 del grupo del stent con TiNO y 14 en el del SLE). La media de edad de la cohorte B fue de 58,6±10,1 años; el 16,7% eran mujeres y el 6,7%, diabéticos. Los pacientes que recibieron stents con TiNO eran con más frecuencia hipertensos y dislipémicos; otros datos basales eran comparables (tabla 1). No se observaron eventos adversos cardiovasculares mayores en ninguno de los grupos de stents a los 30 días. Ningún paciente tenía una estenosis ≥ 50% del diámetro a los 6 meses.
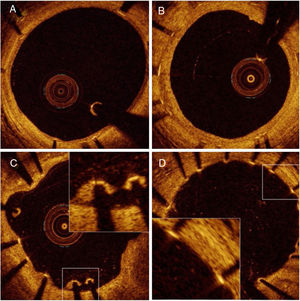
Datos de la tomografía de coherencia ópticaCohorte ALa evaluación del seguimiento de la OCT se llevó a cabo tras una media de 31,6±4,3 días en el grupo de stents con TiNO y una media de 31,5±3,6 días en el grupo de SLE (p=0,97). La adquisición de imágenes de la OCT fue satisfactoria en todos los pacientes y no se observaron complicaciones relacionadas con la intervención de OCT. Se excluyeron del análisis 81 struts de rama lateral no apuestos (45 en el grupo del stent con TiNO y 36 en el del SLE). Se analizaron 4.468 struts en 426 secciones transversales de stents con TiNO y 3.574 struts en 371 secciones transversales de SLE (tabla 2 y figura 1). El porcentaje de struts no recubiertos por paciente fue menor en el grupo de stents con TiNO que en el de SLE (el 3,2% [6,1] y el 19,6% [27,2] respectivamente; p < 0,001). Del mismo modo, el porcentaje de struts mal apuestos por paciente fue menor en el grupo de stents con TiNO (el 0,4% [1,9] y el 2,1% [3,1]; p < 0,001). Sin embargo, el grosor de la HNI fue mayor en el grupo de stents con TiNO según el análisis por paciente (70 [85] y 40 [20] μm; p < 0,001) y el análisis por strut (110,6±86,8 y 40,2±23,1 μm; p < 0,001). Se observó por OCT un pequeño trombo en el stent en 2 pacientes del grupo de stents con TiNO y 7 del grupo de SLE.
Mediciones de tomografía de coherencia óptica
| Cohorte A (seguimiento a 30 días) | Cohorte B (seguimiento a 6 meses) | |||||
|---|---|---|---|---|---|---|
| Stent con TiNO(n=28) | SLE(n=24) | p | Stent con TiNO(n=16) | SLE(n=14) | p | |
| Secciones transversales analizadas | 426 | 371 | 298 | 234 | ||
| Número total de struts analizados | 4.468 | 3.574 | 3.545 | 2.518 | ||
| Struts por sección transversal | 10,5 | 9,6 | 11,9 | 10,8 | ||
| Struts de rama lateral no apuestos | 45 (0,9) | 36 (0,9) | ||||
| Área del stent (mm2) | 7,59 [2,59] | 8,59 [2,7] | 0,32 | 6,84 [2,62] | 9,6 [3,64] | 0,002 |
| Área de la luz (mm2) | 6,89 [3,12] | 8,53 [2,41] | 0,01 | 4,18 [2,32] | 9,01 [3,08] | <0,001 |
| Área de la HNI (mm2) | 0,87 [0,75] | 0,07 [0,18] | <0,001 | 2,21 [1,11] | 0,75 [0,4] | <0,001 |
| Área de la HNI (%) | 9,76 [13,1] | 0,83 [2,1] | <0,001 | 31,9 [15,6] | 8,4 [3,9] | <0,001 |
| Struts no recubiertos por paciente (%) | 3,2 [6,1] | 19,6 [27,2] | <0,001 | 0,0 [0,7] | 8,7 [18,8] | <0,001 |
| Struts no recubiertos (por strut, %) | 191 (4,3) | 984 (27,5) | <0,001 | 27 (0,8) | 365 (14,5) | <0,001 |
| Struts mal apuestos por paciente (%) | 0,4 [1,9] | 2,1 [3,1] | 0,004 | 0,0 [0,0] | 0,3 [2,1] | 0,008 |
| Struts mal apuestos (por strut, %) | 53 (1,2) | 113 (3,2) | 0,001 | 4 (0,1) | 28 (1,1) | <0,001 |
| Grosor de la HNI por paciente (μm) | 70 [85] | 40 [20] | 0,001 | 230 [118] | 60 [45] | <0,001 |
| Grosor de los NIH por strut (μm) | 110,6±86,8 | 40,2±23,1 | 0,001 | 252,2±146,2 | 92,9±81,6 | <0,001 |
| Distancia de mala aposición por paciente (μm) | 50 [230] | 140 [135] | 0,95 | 335 [205] | 200 [160] | 0,28 |
HNI: hiperplasia neointimal; SLE: stents liberadores de everolimus; TiNO: recubrimiento de óxido de nitruro de titanio.
Las variables continuas se expresan como mediana [intervalo intercuartílico] o media ± desviación estándar y las cualitativas, como n (%).
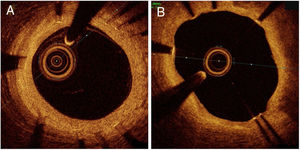
La evaluación del seguimiento de la OCT se llevó a cabo tras una media de 185,9±22,4 días en el grupo de stents con TiNO frente a 202,1±46,9 días en el grupo de SLE (p =0,28). La adquisición de imágenes fue satisfactoria en todos los pacientes y no se observaron complicaciones. Se excluyeron del análisis 21 struts de rama lateral no apuestos (todos en el grupo de SLE). Se analizaron 3.545 struts en 298 secciones transversales de stents con TiNO y 2.518 struts en 234 secciones transversales de SLE (tabla 2 y figura 2). El porcentaje de struts no recubiertos por paciente fue menor en el grupo de stents con TiNO que en el brazo de SLE (el 0% [0,7] y el 8,7% [18,8]; p < 0,001). Del mismo modo, el porcentaje de struts mal apuestos por paciente fue menor en el grupo de stents con TiNO (0 [0,0] y el 0,3% [2,1]; p = 0,008). Sin embargo, el grosor de la HNI fue mayor en el grupo de stents con TiNO según el análisis por paciente (70 [85] y 40 [20] μm; p < 0,001) y el análisis por strut (252,2±146,2 y 92,9±81,6 μm; p < 0,001). En la evaluación de OCT no se observaron trombos en ninguno de los grupos de stents a los 6 meses de seguimiento.
DISCUSIÓNPrincipales conclusionesEste estudio indica que, en los pacientes con SCA tratados con una ICP temprana, el implante del stent con TiNO se asoció con mayor grado de recubrimiento del stent en comparación con el SLE, tanto a los 30 días como a los 6 meses de seguimiento. Además, el porcentaje de mala aposición del strut fue inferior con el stent con TiNO. Sin embargo, la HNI fue más notable después del implante del stent con TiNO que después del implante del SLE. Según el mejor conocimiento de los autores, este es el primer artículo en que se compara el proceso de cicatrización evaluado por OCT de los stents con TiNO y los SLE.
Cicatrización neointimal y perspectivas clínicasEl recubrimiento inadecuado del strut neointimal es el predictor más potente de TS temprana y tardía después del implante del stent en las autopsias histológicas y las conclusiones del informe de OCT3,21. Sin embargo, el porcentaje de struts no recubiertos y mal apuestos tiende a disminuir con el tiempo debido a la cicatrización y el crecimiento neointimales progresivos22,23. La cicatrización vascular a menudo se retrasa en pacientes tratados con SFA, sobre todo en pacientes con SCA24. El recubrimiento del strut del stent se adaptó como criterio indirecto de validación de la seguridad del stent. Esta es una cuestión clínica importante, sobre todo en pacientes con SCA, cuando el riesgo de TS es mayor en la fase temprana tras la ICP, y para pacientes con alto riesgo de hemorragia cuando se necesita un tratamiento antiagregante plaquetario doble más corto. Se considera en riesgo hemorrágico elevado a casi un tercio de los pacientes tratados con ICP25. Pocos estudios de OCT notificaron un recubrimiento neointimal temprano después del implante del SLE utilizado en este estudio; el SLE mostró una mayor porción de struts recubiertos frente al SLE de polímero permanente en la fase temprana después del implante del stent en pacientes con infarto de miocardio con elevación del segmento ST, se encontraron struts no recubiertos en el 57,6% a las 2 semanas y en el 28,4% a los 4 meses26. En pacientes con infarto agudo de miocardio sin elevación del segmento ST, se encontraron struts no recubiertos en el 21,5% al mes de seguimiento27. Los estudios que compararon los stents de acero inoxidable recubiertos con TiNO de la generación anterior frente al SLE de polímero permanente en pacientes con SCA mostraron que había struts no recubiertos en el 1,2% a los 2 meses y el 0,6% a los 9 meses de seguimiento con los stents de acero inoxidable con TiNO en comparación con el 11,3 y el 10,8% con los SLE de polímero permanente14,15. En un estudio con stents de acero inoxidable con TiNO (el 80% eran pacientes con SCA), los struts no recubiertos fueron el 3,7% y el grosor de la HNI fue de 71,5 μm a los 14 días del implante del stent28. Además, la HNI de los stents con TiNO casi alcanzó un nivel estable a los 6 meses, lo que en gran medida es antes que el desarrollo de HNI con SFA29. Una vez terminado el proceso de cicatrización (> 6 meses), el grosor de la HNI de los stents con TiNO desciende a valores entre los de los SM y los SFA14,16,30.
No hay estudios de OCT que comparen los SM con los stents con TiNO. Los resultados del presente estudio que muestran un bajo porcentaje de struts no recubiertos poco después del implante del stent con TiNO coinciden con los informes anteriores de cicatrización neointimal de los stents de acero inoxidable con TiNO14,15,28. En el reciente ensayo aleatorizado TIDES-ACS se compararon los stents utilizados en el estudio actual en pacientes con SCA13. Los stents con TiNO mostraron ausencia de inferioridad en relación con los SLE por lo que respecta a eventos cardiovasculares mayores a los 12 meses y fueron superiores en los objetivos de seguridad coprincipales de muerte cardiaca, infarto de miocardio y hemorragia a los 18 meses con la misma revascularización de la lesión objetivo. Hubo más muertes cardiacas, infarto de miocardio y TS a los 12 meses en el grupo de SLE, aunque el ensayo no tenía la potencia suficiente para abordar estos eventos de seguridad individuales. Después del primer año, la incidencia de muerte cardiaca, infarto de miocardio y TS fue baja en ambos grupos del estudio13. Curiosamente, las muertes cardiovasculares y el infarto de miocardio entre los stents con TiNO y los SLE difirieron en una fase temprana tras el implante del stent13, periodo en que el recubrimiento del strut fue menor con los SLE que con los stents con TiNO del presente estudio. Esto indica que las diferencias en el recubrimiento temprano del strut y la cicatrización pueden explicar, al menos en parte, estos hallazgos en eventos clínicos tempranos. El recubrimiento neointimal más temprano y adecuado de los stents con TiNO se consigue a costa de una formación de HNI más gruesa, ya esperada, ya que los SFA están diseñados fundamentalmente para reducir la reestenosis en el interior del stent. Sin embargo, esto no motivó un exceso de revascularización de la lesión objetivo en el ensayo aleatorizado TIDES-ACS, en el que se compararon los stents con TiNO y los SLE utilizados en el presente estudio13. En el estudio actual, ningún paciente en el grupo de los stents con TiNO presentó estenosis ≥ 50% del diámetro y ninguno sufrió revascularización de la lesión objetivo a los 6 meses. Dado que el recubrimiento del strut del stent se adopta como objetivo indirecto de valoración de la seguridad del stent, el rápido recubrimiento de los stents con TiNO los convierte en seguros para su uso en pacientes con SCA.
LimitacionesEl presente estudio se basa en un tamaño de muestra relativamente pequeño; por lo tanto, los resultados deben interpretarse con cautela. Además, la tecnología actual de la OCT no puede detectar un recubrimiento neointimal de grosor < 10 μm y es difícil diferenciar las capas muy delgadas de recubrimiento neointimal entre el endotelio, las capas delgadas de fibrina o algún trombo poco después del implante del stent (figura 1D). Una limitación es que la OCT no se hizo antes e inmediatamente después de la intervención inicial. Otra clara limitación del estudio es que el 14% de los pacientes se negaron a participar en el seguimiento angiográfico. Además, ningún laboratorio central independiente participó en el análisis de los datos. Por último, este estudio no tuvo la potencia suficiente para correlacionar los hallazgos de la OCT con los objetivos clínicos y se necesitan estudios más amplios para abordar la relevancia clínica de estos hallazgos.
CONCLUSIONESEn los pacientes sometidos a una ICP temprana por SCA, el implante del stent con TiNO se asoció con un menor porcentaje de struts no recubiertos y struts mal apuestos por paciente en comparación con el SLE, según reveló la OCT en los seguimientos temprano y a medio plazo (figura 3). El grosor de la HNI fue mayor en el grupo de los stents con TiNO en ambos momentos.
FINANCIACIÓNLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, el sector comercial o entidades sin ánimo de lucro.
CONTRIBUCIONES DE LOS AUTORESJ. Sia confirma que todos los autores de este artículo de investigación han hecho aportaciones sustanciales a la creación y el diseño del artículo, han participado directamente en su planificación y ejecución y han aprobado la versión final que se presenta.
J. Sia y W. Nammas han contribuido por igual al trabajo.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.
- –
El recubrimiento inadecuado del strut neointimal es el predictor más potente de trombosis del stent temprana y tardía.
- –
La incidencia de TS tardía es inferior con los SFA de segunda generación que con los de primera generación y los SM.
- –
En un ensayo clínico aleatorizado, se ha demostrado ausencia de inferioridad de los stents de acero inoxidable con TiNO en relación con los SLE de polímero permanente de nueva generación por lo que respecta a eventos cardiovasculares mayores.
- –
El recubrimiento temprano del strut fue más rápido y completo con los stents con TiNO que con los SLE en pacientes con síndrome coronario agudo.