La obstrucción microvascular (OMV) se asocia negativamente con la estructura cardiaca y el pronóstico de los pacientes tras un infarto agudo de miocardio con elevación del segmento ST (IAMCEST). El factor epithelial cell adhesion molecule (EpCAM), implicado en la cohesión de las células epiteliales, está poco estudiado en el contexto de la OMV. Por ello, el objetivo de este estudio es evaluar en una cohorte de pacientes con IAMCEST la asociación entre la concentración de EpCAM circulante con la extensión de la OMV, determinada por resonancia magnética cardiaca (RMC), y la función sistólica en fases crónicas.
MétodosSe incluyó prospectivamente a 106 pacientes con un primer IAMCEST tratados con angioplastia primaria percutánea. La concentración sérica de EpCAM se determinó 24h tras la reperfusión coronaria. Se estudió a todos los pacientes mediante RMC a la semana y a los 6 meses del IAMCEST. Se evaluó la correlación entre los valores de EpCAM circulante con la OMV, los índices de función sistólica y la fracción de eyección del ventrículo izquierdo.
ResultadosLa media de edad de la cohorte era 59±13 años y el 76% eran varones. Se dicotomizó a los pacientes según la mediana de EpCAM (4,48 pg/ml). Se observó que los pacientes que tenían valores más bajos de EpCAM presentaban una mayor extensión de la OMV (p=0,021) y un mayor tamaño de infarto (p=0,019) en los estudios de RMC realizados 1 semana después del evento cardiovascular. Respecto a las variables de presentación, la concentración de EpCAM se asoció significativamente con la presencia de OMV en análisis de regresión logística binaria univariable (OR=0,58; IC95%, 0,38-0,88; p=0,011) y multivariable (OR=0,55; IC95%, 0,35-0,87; p=0,010). A pesar de que la OMV tiende a resolverse espontáneamente en fases crónicas, unos valores más bajos de EpCAM se correlacionaron con una peor función sistólica: fracción de eyección del ventrículo izquierdo deprimida (p=0,009) y mayor volumen telesistólico del ventrículo izquierdo (p=0,043).
ConclusionesTras un IAMCEST, la concentración de EpCAM circulante en fase aguda se asocia con la extensión de la OMV evaluada mediante RMC y con un peor remodelado ventricular en fase crónica.
Palabras clave
La reperfusión coronaria, principalmente mediante técnicas percutáneas, disminuye notablemente la mortalidad tras un infarto de miocardio con elevación del segmento ST (IAMCEST) reperfundido. A pesar de una completa reperfusión epicárdica, un número considerable de pacientes (30-50%) presenta una perfusión miocárdica anómala1,2. Este fenómeno se conoce como obstrucción microvascular (OMV) y se relaciona con afección de la estructura y la función cardiacas, así como con un peor pronóstico3,4.
Algunas de las variables de presentación del paciente son útiles para predecir la extensión de la OMV. De hecho, se ha elaborado una puntuación que incluye 4 factores predisponentes (retraso en la reperfusión, diabetes mellitus, clase Killip y elevación considerable del segmento ST en el electrocardiograma basal) para predecir una OMV5. No obstante, los biomarcadores solubles para predecir la extensión de la OMV son escasos, lo que resalta la necesidad crucial de nuevas moléculas para adquirir más conocimientos sobre la fisiopatología de la OMV y ofrecer nuevas alternativas terapéuticas.
Aunque son varios los mecanismos que actúan simultánea y secuencialmente en la fisiopatología de la OMV, las anomalías endoteliales, la menor densidad capilar y el aumento de la permeabilidad endotelial son particularmente importantes2,6,7. En este contexto, la epithelial cell adhesion molecule (EpCAM) se encuentra en la membrana basolateral de numerosas células epiteliales normales para mantener la cohesión entre las células y conservar la integridad epitelial8. A pesar de su prometedor papel en oncología9, no se ha demostrado la participación de esta molécula en el ámbito cardiovascular.
El objetivo de este estudio es explorar la relación entre la EpCAM circulante determinada 24h después de la angioplastia percutánea y la OMV determinada mediante resonancia magnética cardiaca (RMC), así como con la estructura y la función cardiacas en los primeros 6 meses después del IAMCEST.
MÉTODOSPoblación de estudioEste estudio se llevó a cabo conforme a los principios relativos a la utilización de personas descritos en la Declaración de Helsinki, el protocolo del estudio fue aprobado por el comité de ética local y todos los participantes firmaron el consentimiento informado.
Se incluyó prospectivamente a pacientes dados de alta entre julio de 2013 y diciembre de 2017, con los siguientes criterios de inclusión: pacientes con un primer IAMCEST, tal como se explica en las definiciones actuales10, tratados con angioplastia percutánea durante las 12 h posteriores al inicio del dolor torácico y estudiados mediante una RMC a la semana y a los 6 meses después del IAMCEST. Los criterios de exclusión fueron: muerte, reinfarto o inestabilidad clínica durante los primeros 6 meses después del alta o cualquier contraindicación a la RMC.
Pruebas con biomarcadoresLas muestras de sangre se aislaron 24h después de la revascularización coronaria, se centrifugaron a 2.300rpm durante 15min y de inmediato se guardó el suero a 80°C hasta la realización de nuevos análisis. La concentración sérica de EpCAM se determinó mediante las pruebas analíticas Olink CARDIOVASCULAR III (Olink Proteomics, Suecia). La tecnología de detección de anticuerpos PEA (Proximity Extension Assay) utilizada para el protocolo de Proseek Multiplex ya se ha descrito previamente11 y en el .
Se determinó la troponina T ultrasensible (ensayo Elecsys TnT, Roche Diagnostics, Suiza; umbral diagnóstico del infarto de miocardio > 14 ng/ml) en el momento del ingreso, al cabo de 3h y a intervalos de 6-8 h durante las primeras 24h.
Recuento leucocitarioSe determinó el número de linfocitos y eosinófilos (×1.000 cél./ml) a la llegada del paciente y a las 12, 24, 48, 72 y 96h tras la revascularización con una prueba comercial basada en las medidas citoquímicas de dispersión y absorción de la luz (sistema de hematología ADVIA 120, Siemens Diagnostics, Alemania).
Estudios de resonancia magnética cardiacaSe realizaron 2 estudios de RMC (unidad 1,5 T, Magnetom Sonata; Siemens, Alemania) a los 7 [5-8] días (RMC a la semana) y a los 196 [167-242] días (RMC a los 6 meses) del IAMCEST, conforme al protocolo del laboratorio12 y las recomendaciones actuales. La realización y el análisis de todos los estudios estuvo a cargo de 2 cardiólogos especializados en RMC, con 15 años de experiencia, que utilizaron un software personalizado (QMASS MR 6.1.5, Medis, Países Bajos). Los datos de la RMC se registraron de manera prospectiva y se incluyeron de inmediato a la base de datos.
Puede consultarse más información sobre la obtención de la RMC, secuencias y cuantificación, en otros estudios12,13 o en el .
Ya se ha informado previamente de la variabilidad entre observadores a la hora de calcular los índices tradicionales de la RMC utilizada en el presente estudio, y esta es < 5%12,13.
Objetivos y seguimientoComo objetivo primario de este estudio se eligió la OMV determinada mediante RMC al cabo de 1 semana.
Los objetivos secundarios fueron la relación entre la EpCAM determinada 24h después de la angioplastia percutánea y la remodelación ventricular a largo plazo, como demuestran la fracción de eyección del ventrículo izquierdo (FEVI) y el índice de volumen telesistólico del VI a los 6 meses.
Análisis estadísticoSe comprobó la distribución normal de los datos con la prueba de Kolmogorov-Smirnov. Los valores continuos con distribución normal se expresaron como media ± desviación estándar de la media y se compararon con la prueba de la t de Student para datos emparejados y para datos independientes. Los datos no paramétricos se expresaron como la mediana [intervalo intercuartílico] y se compararon con la prueba de la U de Mann-Whitney. Los porcentajes de grupo se compararon con la prueba de la χ2 o la prueba exacta de Fisher, según correspondiera.
Se realizó un análisis de regresión logística multivariante aplicando el método de pasos hacia adelante para comprobar la relación entre las características basales y la presencia de OMV a la semana en todo el grupo de estudio. Todas las variables de entrada se introdujeron a la vez para obtener la odds ratio (OR) y su intervalo de confianza del 95% (IC95%) para las variables no asociadas de manera independiente con la OMV. Para el análisis de regresión multivariante, se eligieron todas las características basales. La EpCAM fue el único índice con relación independiente con la presencia de OMV a la semana.
La relación entre la EpCAM y los índices de RMC se estableció con las pruebas de correlación de Pearson o de Spearman según conviniese.
Se calculó la precisión de discriminación (estadístico c) de la EpCAM para predecir la OMV.
Se analizó la relación entre la EpCAM (pg/ml) y la OMV a la semana (porcentaje de masa del VI), entre la EpCAM (pg/ml) y el tamaño del infarto a la semana (porcentaje de masa del VI) y entre la EpCAM (pg/ml) y la presencia de hemorragia intramiocárdica a la semana (número de segmentos) con modelos de regresión lineal multivariantes aplicados a todo el grupo de estudio. Para los análisis de regresión multivariante, se eligieron todas las características basales como covariables para el ajuste. A continuación, se obtuvo un modelo reducido y simple con selección por pasos hacia atrás.
Las covariables incluidas en el modelo final para el tamaño del infarto a la semana fueron: infarto anterior, clasificación del flujo Thrombolysis in Myocardial Infarction (TIMI) previo a la angioplastia percutánea, troponina T ultrasensible y número mínimo de linfocitos. En el caso de la OMV a la semana, en el modelo final se seleccionaron la clasificación del flujo TIMI antes de la angioplastia percutánea y la troponina T ultrasensible. En el caso de la hemorragia intramiocárdica a la semana, se incluyeron en el modelo final la diabetes mellitus, la clasificación del flujo TIMI tras la angioplastia percutánea, el infarto anterior y el tiempo transcurrido hasta la reperfusión.
A los 6 meses, se analizó la relación entre la EpCAM (pg/ml) y la FEVI (%) y entre la EpCAM (pg/ml) y el índice de volumen telesistólico del VI (ml/m2) con modelos de regresión lineal multivariantes. Todas las características basales se eligieron como covariables para el ajuste. A continuación, se obtuvo un modelo reducido y simple con selección por pasos hacia atrás.
Las covariables incluidas en el modelo final para la FEVI a los 6 meses fueron: infarto anterior, clasificación del flujo TIMI antes de la angioplastia percutánea, número mínimo de linfocitos y troponina T ultrasensible. En el caso del índice de volumen telesistólico del VI a los 6 meses, se incluyeron en el modelo final el número mínimo de linfocitos y la troponina T ultrasensible.
Se consideró que había significación estadística con valores bilaterales de p < 0,05. En todo momento se utilizó el paquete estadístico SPSS (versión 15.0, SPSS Inc., Estados Unidos) y STATA (versión 9.0, StataCorp, Estados Unidos).
RESULTADOSCon los criterios de inclusión, se incluyó prospectivamente a 127 pacientes consecutivos dados de alta entre julio de 2013 y diciembre de 2017. Los criterios de exclusión fueron: muerte (n=2), reinfarto (n=4) o inestabilidad clínica (n=4) durante los primeros 6 meses después del alta o cualquier contraindicación a la RMC (n=11). El grupo final del estudio constó de 106 pacientes con IAMCEST. El diagrama de flujo de los pacientes del estudio se presenta en la .
La media de edad de la muestra era 59±13 años y 81 pacientes (76%) eran varones. La localización anatómica del infarto fue anterior en 54 pacientes (51%) y la clase de Killip fue ≥ II en 20 (19%). En la RMC realizada a la semana, la OMV media fue del 0% (0-2,3) de la masa del VI y la FEVI media fue del 53%±11%.
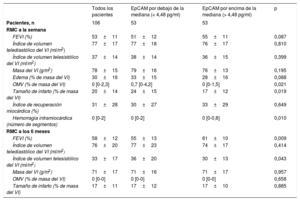
Relación entre la EpCAM y la extensión de la OMV a la semanaSe cuantificó la concentración sérica de EpCAM al cabo de 24h de la reperfusión y la mediana fue de 4,48 pg/ml. En la tabla 1 se presentan las características basales de los pacientes con valores de EpCAM por debajo y por encima de la mediana, y se constata un mayor número de varones que de mujeres con cifras de EpCAM circulante por debajo de la mediana.
Características basales, índices angiográficos y biomarcadores de toda la cohorte y de los pacientes con EpCAM por encima o por debajo de la mediana
| Todos los pacientes | EpCAM por debajo de la mediana (< 4,48 pg/ml) | EpCAM por encima de la mediana (> 4,48 pg/ml) | p | |
|---|---|---|---|---|
| Pacientes, n | 106 | 53 | 53 | |
| Características basales | ||||
| Edad (años) | 59±13 | 58±14 | 60±12 | 0,303 |
| Varones | 81 (76) | 46 (87) | 35 (66) | 0,012 |
| Diabetes mellitus | 22 (21) | 13 (25) | 9 (17) | 0,338 |
| Hipertensión | 55 (52) | 28 (53) | 27 (51) | 0,846 |
| Dislipemia | 48 (45) | 20 (38) | 28 (53) | 0,119 |
| Fumadores | 66 (62) | 31 (59) | 35 (66) | 0,423 |
| Clase Killip | 0,549 | |||
| 1 | 86 (81) | 44 (83) | 42 (79) | |
| 2 | 15 (14) | 8 (15) | 7 (13) | |
| 3 | 1 (1) | 0 (0) | 1 (2) | |
| 4 | 4 (4) | 1 (2) | 3 (6) | |
| Tiempo hasta la reperfusión (min) | 200 [145-390] | 188 [124-413] | 210 [150-329] | 0,827 |
| Escala de riesgo GRACE | 133±35 | 130±34 | 137±37 | 0,286 |
| Puntuación de riesgo de TIMI | 2 [1-4] | 2 [1-3] | 3 [1-4] | 0,433 |
| Índices angiográficos | ||||
| Infarto anterior | 54 (51) | 28 (53) | 26 (49) | 0,698 |
| Enfermedad multivaso | 32 (60) | 15 (28) | 17 (32) | 0,609 |
| Grado de flujo TIMI antes de la ICP | 0,248 | |||
| 0 | 66 (62) | 38 (72) | 28 (53) | |
| 1 | 6 (6) | 2 (4) | 4 (8) | |
| 2 | 7 (7) | 2 (4) | 5 (9) | |
| 3 | 27 (25) | 11 (21) | 16 (30) | |
| Grado de flujo TIMI tras la ICP | 0,574 | |||
| 0 | 0 | 0 | 0 | |
| 1 | 1 (1) | 0 | 1 (2) | |
| 2 | 9 (8) | 5 (10) | 4 (8) | |
| 3 | 96 (91) | 48 (90) | 48 (90) | |
| Biomarcadores | ||||
| TnT-us | 2.807 [1.433-5.140] | 2.898 [1.706-5.429] | 2.769 [624-3.979] | 0,184 |
| Número máximo de eosinófilos(×103cél./ml) | 200 [157-300] | 200 [140-300] | 220 (165-305) | 0,286 |
| Número mínimo de eosinófilos(×103cél./ml) | 30 [10-80] | 30 [15-75] | 30 [10-80] | 0,954 |
| Número máximo de linfocitos(×103cél./ml) | 2.400 [1.905-3.495] | 2.320 [1.920-3.410] | 2.510 [1.900-3.515] | 0,315 |
| Número mínimo de linfocitos(×103cél./ml) | 1.260 [970-1.612] | 1.290 (990-1.635) | 1.210 [940-1.590] | 0,501 |
| EpCAM (pg/ml) | 4,5±1,0 | 3,7±0,5 | 5,3±0,6 | <0,001 |
EpCAM: epithelial cell adhesion molecule; GRACE: Registro global de eventos coronarios agudos (Global Registry of Acute Coronary Events); ICP: intervención coronaria percutánea; TIMI: Thrombolysis in Myocardial Infarction; TnT-us: troponina T ultrasensible.
Los valores expresan n (%), media ± desviación estándar o mediana [intervalo].
Con respecto a las variables de las imágenes obtenidas mediante RMC a la semana, los pacientes con una concentración de EpCAM por debajo de la mediana presentaron mayores valores de OMV (0,7 [0-4,2] frente a 0 [0-1,5]; p=0,021), tamaño del infarto (24±15 frente a 17±12; p=0,019) y hemorragia intramiocárdica (0 [0-2] frente a 0 [0-0,8]; p=0,01) (tabla 2).
Características de las RMC de toda la cohorte y de los pacientes con EpCAM por encima o por debajo de la mediana
| Todos los pacientes | EpCAM por debajo de la mediana (< 4,48 pg/ml) | EpCAM por encima de la mediana (> 4,48 pg/ml) | p | |
|---|---|---|---|---|
| Pacientes, n | 106 | 53 | 53 | |
| RMC a la semana | ||||
| FEVI (%) | 53±11 | 51±12 | 55±11 | 0,087 |
| Índice de volumen telediastólico del VI (ml/m2) | 77±17 | 77±18 | 76±17 | 0,810 |
| Índice de volumen telesistólico del VI (ml/m2) | 37±14 | 38±14 | 36±15 | 0,399 |
| Masa del VI (g/m2) | 78±15 | 79±16 | 76±13 | 0,195 |
| Edema (% de masa del VI) | 30±16 | 33±15 | 28±16 | 0,088 |
| OMV (% de masa del VI) | 0 [0-2,3] | 0,7 [0-4,2] | 0 [0-1,5] | 0,021 |
| Tamaño de infarto (% de masa del VI) | 20±14 | 24±15 | 17±12 | 0,019 |
| Índice de recuperación miocárdica (%) | 31±28 | 30±27 | 33±29 | 0,649 |
| Hemorragia intramiocárdica (número de segmentos) | 0 [0-2] | 0 [0-2] | 0 [0-0,8] | 0,010 |
| RMC a los 6 meses | ||||
| FEVI (%) | 58±12 | 55±13 | 61±10 | 0,009 |
| Índice de volumen telediastólico del VI (ml/m2) | 76±20 | 77±23 | 74±17 | 0,414 |
| Índice de volumen telesistólico del VI (ml/m2) | 33±17 | 36±20 | 30±13 | 0,043 |
| Masa del VI (g/m2) | 71±17 | 71±16 | 71±17 | 0,957 |
| OMV (% de masa del VI) | 0 [0-0] | 0 [0-0] | 0 [0-0] | 0,658 |
| Tamaño de infarto (% de masa del VI) | 17±11 | 17±12 | 17±10 | 0,885 |
EpCAM: epithelial cell adhesion molecule; FEVI: fracción de eyección del ventrículo izquierdo; OMV: obstrucción microvascular; RMC: resonancia magnética cardiaca; VI: ventrículo izquierdo.
Los valores expresan número absoluto, media ± desviación estándar o mediana [intervalo].
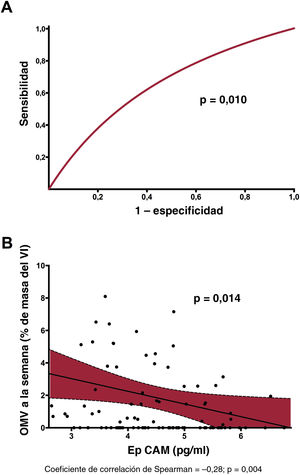
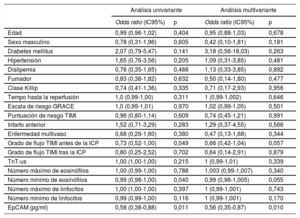
En un análisis univariante, la EpCAM (OR = 0,58; IC95%, 0,38-0,88; p=0,011), la clasificación del flujo TIMI antes de la angioplastia percutánea (OR = 0,73; IC95%, 0,52-1,00; p=0,049) y el número mínimo de eosinófilos (OR = 0,99; IC95%, 0,98-1,00; p=0,040) se relacionaron significativamente con la presencia de OMV. No obstante, cuando se incluyeron todas las variables clínicas basales en un modelo de regresión logística multivariante, solo la concentración de EpCAM se relacionó de manera independiente con la OMV (OR = 0,55; IC95%, 0,35-0,87; p=0,010) (tabla 3). Además, se constató una precisión de discriminación significativa de la EpCAM para predecir la OMV (estadístico c = 0,65; IC95%, 0,54-0,75; p=0,01) (figura 1A). En la y , respectivamente, se muestran las características basales y de la RMC según la presencia de OMV en la RMC realizada 1 semana después.
Predictores de OMV a la semana: análisis univariante y multivariante
| Análisis univariante | Análisis multivariante | |||
|---|---|---|---|---|
| Odds ratio (IC95%) | p | Odds ratio (IC95%) | p | |
| Edad | 0,99 (0,96-1,02) | 0,404 | 0,95 (0,88-1,03) | 0,678 |
| Sexo masculino | 0,78 (0,31-1,96) | 0,605 | 0,42 (0,10-1,81) | 0,181 |
| Diabetes mellitus | 2,07 (0,79-5,47) | 0,141 | 3,18 (0,56-18,03) | 0,263 |
| Hipertensión | 1,65 (0,76-3,56) | 0,205 | 1,09 (0,31-3,85) | 0,481 |
| Dislipemia | 0,76 (0,35-1,65) | 0,488 | 1,13 (0,33-3,85) | 0,892 |
| Fumador | 0,83 (0,38-1,82) | 0,632 | 0,50 (0,14-1,80) | 0,477 |
| Clase Killip | 0,74 (0,41-1,36) | 0,335 | 0,71 (0,17-2,93) | 0,956 |
| Tempo hasta la reperfusión | 1,0 (0,99-1,00) | 0,311 | 1 (0,99-1,002) | 0,646 |
| Escala de riesgo GRACE | 1,0 (0,99-1,01) | 0,970 | 1,02 (0,99-1,05) | 0,501 |
| Puntuación de riesgo TIMI | 0,96 (0,80-1,14) | 0,609 | 0,74 (0,45-1,21) | 0,991 |
| Infarto anterior | 1,52 (0,71-3,29) | 0,283 | 1,29 (0,37-4,55) | 0,566 |
| Enfermedad multivaso | 0,68 (0,29-1,60) | 0,380 | 0,47 (0,13-1,68) | 0,344 |
| Grado de flujo TIMI antes de la ICP | 0,73 (0,52-1,00) | 0,049 | 0,66 (0,42-1,04) | 0,057 |
| Grado de flujo TIMI tras la ICP | 0,80 (0,25-2,52) | 0,702 | 0,64 (0,14-2,91) | 0,879 |
| TnT-us | 1,00 (1,00-1,00) | 0,215 | 1 (0,99-1,01) | 0,339 |
| Número máximo de eosinófilos | 1,00 (0,99-1,00) | 0,788 | 1,003 (0,99-1,007) | 0,340 |
| Número mínimo de eosinófilos | 0,99 (0,98-1,00) | 0,040 | 0,99 (0,98-1,005) | 0,055 |
| Número máximo de linfocitos | 1,00 (1,00-1,00) | 0,397 | 1 (0,99-1,001) | 0,743 |
| Número mínimo de linfocitos | 0,99 (0,99-1,00) | 0,116 | 1 (0,99-1,001) | 0,170 |
| EpCAM (pg/ml) | 0,58 (0,38-0,88) | 0,011 | 0,56 (0,35-0,87) | 0,010 |
EpCAM: epithelial cell adhesion molecule; GRACE: Registro global de eventos coronarios agudos (Global Registry of Acute Coronary Events); IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; OMV: obstrucción microvascular; TIMI: Thrombolysis in Myocardial Infarction; TnT-us: troponina T ultrasensible.
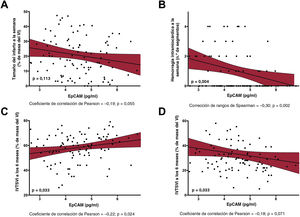
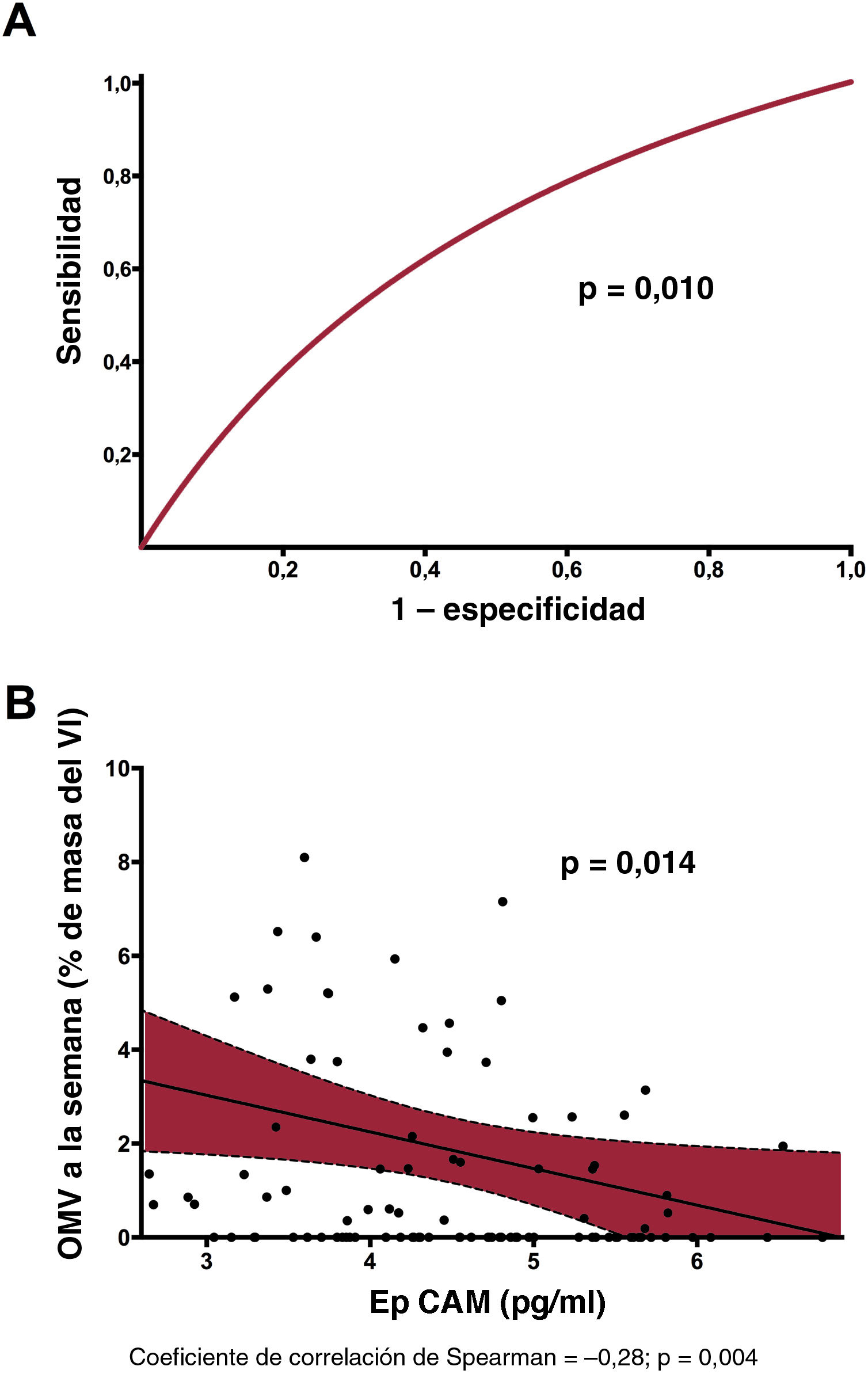
Valor predictivo y relación de la EpCAM con respecto a la OMV al cabo de 1 semana. A: se constató una precisión significativa en la discriminación de la EpCAM (estadístico c) para predecir la OMV. B: tras ajustar las características basales, se observó una relación negativa entre la EpCAM y la OMV a la semana en el grupo de estudio. EpCAM: epithelial cell adhesion molecule; OMV: obstrucción microvascular; VI: ventrículo izquierdo.
En la fase crónica (6 meses), se detectó un aumento de la FEVI (58%±12% frente a 53%±11%; p < 0,001) y una disminución del índice de volumen telesistólico del VI (33±17 frente a 37±14ml/m2; p=0,007) y el tamaño del infarto (17%±11% frente a 20%±14%; p=0,001) respecto a las características basales. En cambio, no se observaron diferencias en el índice de volumen telediastólico medio del VI (76±20 frente a 77±17ml/m2; p=0,932). La OMV y la hemorragia intramiocárdica prácticamente habían desaparecido en todos los pacientes a los 6 meses.
En cuanto a las variables de las imágenes de RMC obtenidas a los 6 meses, los pacientes con una concentración de EpCAM por debajo de la mediana presentaban valores de FEVI inferiores (55%±13% frente a 61%±10%; p=0,009) y valores más altos del índice de volumen telesistólico del VI (36±20 frente a 30±13ml/m2; p=0,043) (tabla 2). La FEVI a los 6 meses (OR = 1,05; IC95%, 1,01-1,09; p=0,012) y el índice de volumen telesistólico del VI a los 6 meses (OR = 0,97; IC95%, 0,95-0,99; p=0,048) se relacionaron de manera significativa con una concentración baja de EpCAM.
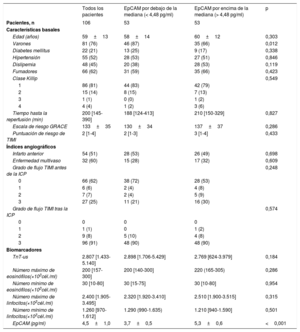
Efecto ajustado de EpCAM a corto y largo plazo en la estructura y la función cardiacasTras el ajuste multivariante con todas las características basales, la concentración sérica de EpCAM siguió relacionándose de manera inversa y significativa con la OMV (p=0,014) (figura 1B), el tamaño del infarto (p=0,113) (figura 2A) y la hemorragia intramiocárdica (p=0,004) (figura 2B) observados 1 semana después. También se observó significativa una relación positiva entre la concentración sérica de EpCAM y la FEVI a los 6 meses (p=0,017) (figura 2C) y una relación negativa con el índice de volumen telesistólico del VI a los 6 meses (p=0,033) (figura 2D).
Asociación entre la EpCAM y el tamaño del infarto y entre la EpCAM y la hemorragia intramiocárdica a la semana y entre la EpCAM y la FEVI y la EpCAM y la IVTSVI a los 6 meses. En un análisis de regresión lineal multivariante, se observó una relación negativa entre la EpCAM y el tamaño del infarto (A) y entre la EpCAM y la hemorragia intramiocárdica a la semana (B) y una relación positiva entre la EpCAM y la FEVI (C) y entre la EpCAM y el IVTSVI a los 6 meses (D) del IAMCEST. EpCAM: epithelial cell adhesion molecule; FEVI: fracción de eyección del ventrículo izquierdo; IAMCEST: infarto de miocardio con elevación del segmento ST; IVTSVI: índice de volumen telesistólico del ventrículo izquierdo; VI: ventrículo izquierdo.
El resultado principal de este estudio es la relación de los valores de EpCAM circulante con la OMV determinada mediante RMC a la semana y los índices de remodelación del VI a largo plazo en una cohorte de pacientes con un primer IAMCEST.
Obstrucción microvascularEn el IAMCEST reperfundido, pueden tener lugar alteraciones de la microcirculación en más del 50% de los pacientes1,2. Este fenómeno se conoce como OMV y tiene efectos dañinos en la estructura y el pronóstico, tales como un mayor tamaño del infarto, una función sistólica más reducida, menos recuperación contráctil y una remodelación más adversa3,4. En cuanto al pronóstico, según un metanálisis reciente, la presencia de OMV aumenta el riesgo de muerte a 2 años, el reinfarto y la insuficiencia cardiaca14. En conjunto, la OMV tiene consecuencias adversas en la estructura y el pronóstico.
En las últimas 2 décadas se han visto avances importantes en la detección de la OMV, que van desde predictores puramente clínicos (clase Killip, retraso en la reperfusión, presencia de diabetes mellitus y elevación considerable del segmento ST en el electrocardiograma inicial)5, pasando por marcadores fáciles de conseguir (número de leucocitos)15,16 y parámetros invasivos, a la aparición de las modernas técnicas de imagen no invasivas1,17,18. No obstante, la RMC con realce tardío de gadolinio es actualmente la técnica más fiable para determinar la presencia y la extensión de la OMV, que se define como las regiones dentro del núcleo de un área infartada hiperrealzada sin fijación de contraste1,5.
Según los datos del presente estudio, el número mínimo de eosinófilos, pero no la clase Killip, la presencia de diabetes y el número de linfocitos se relacionaron con la extensión de la OMV determinada mediante RMC al cabo de 1 semana (). Aunque se han descrito otras variables iniciales para establecer correlación con la aparición de OMV, esto no pudo confirmarse en la cohorte del presente estudio debido al pequeño tamaño muestral.
Biomarcadores circulantes asociados con obstrucción microvascularEn los últimos años, se han hecho avances importantes en el ámbito de la fisiopatología y el diagnóstico de la OMV, aunque no hay estudios suficientes sobre el valor predictivo de los biomarcadores séricos en la detección y la cuantificación de la OMV. En algunos estudios se ha determinado correlación entre biomarcadores inespecíficos (troponina T ultrasensible, lactato deshidrogenasa y péptidos natriuréticos, entre otros) y la OMV determinada mediante RMC19,20. Aunque en la cohorte del presente estudio se detectó una correlación positiva entre la troponina T ultrasensible y la extensión de la OMV a la semana (), este biomarcador universal no se relacionó de manera significativa con la OMV en los modelos de regresión logística univariante o multivariante. Sin embargo, ninguno de estos marcadores está involucrado exclusivamente en la fisiopatología de la OMV. Así pues, es preciso investigar los biomarcadores relacionados específicamente con la fisiopatología de esta complicación.
Aunque la OMV es un fenómeno multifactorial, con varios mecanismos que actúan a la vez y en secuencia en la patogénesis de la OMV2, las células endoteliales desempeñan un papel decisivo. En el contexto del IAMCEST reperfundido, se ha constatado que las alteraciones endoteliales, en concreto la disminución de la densidad capilar miocárdica inmediatamente después de iniciarse la isquemia, el aumento de la permeabilidad endotelial debido a la inflamación repentina y la pérdida de las uniones entre celulares endoteliales causantes del edema intersticial son factores importantes en la escasa microvascularización cardiaca posterior al IAMCEST6,7,21. Puesto que el endotelio participaría de manera activa en la fisiopatología de la OMV, el objetivo es determinar si los biomarcadores involucrados específicamente en la integridad endotelial se relacionan con la presencia de OMV determinada mediante RMC y la estructura cardiaca resultante en el IAMCEST reperfundido.
Relación independiente de la EpCAM con la OMV tras un IAMCEST reperfundidoEn condiciones fisiológicas, las células endoteliales controlan la difusión de los nutrientes y el oxígeno, la coagulación, la migración de los leucocitos y la activación de las plaquetas. No obstante, su disociación podría tener efectos dañinos, como edema, extravasación eritrocitaria y leucocitaria y alteración de la hemostasia vascular22. En la estructura endotelial y la comunicación intervienen las uniones intercelulares comunicantes y las uniones de anclaje o adherentes estrechas. La EpCAM, una glucoproteína superficial transmembrana de tipo I, se encuentra en la membrana basolateral de muchas células epiteliales normales8,23. Esta proteína está muy relacionada con la aparición de cáncer por su sobrexpresión en las células neoplásicas. En varios estudios se ha indicado la asociación de la expresión aumentada de EpCAM con metástasis en los tumores epiteliales y la corta supervivencia de los pacientes9. En efecto, actualmente existen algunos ensayos clínicos que trabajan con una amplia variedad de carcinomas para evaluar la eficacia de los anticuerpos bloqueadores dirigidos contra EpCAM (adecatumumab o edrecolomab) en monoterapia o tratamiento de combinación.
Que se sepa, este es el primer estudio que evalúa la función de la EpCAM en el ámbito cardiovascular. Según los datos del presente estudio, la menor expresión de EpCAM se relaciona de manera significativa con mayor OMV a la semana, así como con función sistólica reducida a largo plazo.
Posible interferencia de la EpCAM en la OMV por el estímulo de la angiogénesisSe ha observado que la angiogénesis participa en la reparación de la OMV. Varios estudios realizados con modelos clínicos y experimentales han destacado la rápida sobrexpresión, tanto en suero como en el miocardio infartado, de los marcadores proangiogénicos7,24–26. De hecho, los estudios experimentales dirigidos a estimular la angiogénesis han dado como resultado una mayor densidad microvascular, un tamaño del infarto reducido y una función sistólica conservada7,27,28.
Se ha demostrado que la EpCAM participa en la estimulación de la angiogénesis en distintos contextos. Primero, en una cohorte de 98 muestras de glioma, la sobrexpresión de la EpCAM se relacionó con la malignidad del tumor y la angiogénesis, como demuestra la densidad de microvasos aumentada29. Segundo, en el cáncer de mama parece que la EpCAM estimula la invasión cancerígena, ya que la eliminación concreta de esta molécula lleva a una menor formación de vasos, probablemente por su interferencia con la interleucina 830. Por último, en pacientes con esteatohepatitis no alcohólica, se ha observado una relación positiva entre 2 moléculas proangiogénicas (factor de crecimiento endotelial vascular y angiopoyetina-2) y la EpCAM31. Conforme a estos resultados previos, podría hipotetizarse que la EpCAM estimula la angiogénesis en el miocardio infartado, lo que daría como resultado una disminución de la OMV y una mejor remodelación ventricular. No obstante, se requiere seguir investigando tanto en el laboratorio como a pie de cama para corroborar esta cuestión.
Aunque este nuevo biomarcador podría incorporarse al arsenal terapéutico para detectar pronto la OMV en los pacientes con IAMCEST, no era este el objetivo del estudio. Son precisos otros estudios con una cohorte más grande de pacientes con IAMCEST para confirmar la importancia de la concentración de EpCAM en la presencia de OMV, así como su función específica en la disfunción microvascular.
Limitaciones del estudioEste estudio debería interpretarse en el contexto de determinadas limitaciones. Primero, como estudio observacional, no puede descartarse el sesgo de selección o los factores de confusión no medidos; segundo, la ausencia de mediciones sucesivas impide evaluar la significación de los cambios dinámicos en la EpCAM circulante a lo largo del tiempo. Por último, el tamaño del infarto, la OMV y el edema se cuantificaron mediante planimetría manual y hay algunas discrepancias en lo que respecta a la reproducibilidad de esta técnica.
CONCLUSIONESEste estudio ilustra por primera vez que los valores de EpCAM circulante tras un IAMCEST reperfundido se relacionan con la OMV determinada mediante RMC en las fases agudas y la remodelación ventricular adversa a largo plazo. Aunque se requieren más estudios para corroborar los resultados, estos hallazgos contribuyen a comprender mejor la fisiopatología de la OMV y podrían servir para evaluar bioquímicamente la extensión de la OMV.
FINANCIACIÓNEste estudio recibió financiación del Instituto de Salud Carlos III y de los Fondos Europeos de Desarrollo Regional FEDER (subvenciones PI17/01836, PI20/00637 y CIBERCV16/11/00486, y un contrato de posgrado FI18/00320 a C. Ríos-Navarro).
CONTRIBUCIÓN DE LOS AUTORESC. Ríos-Navarro y J. Gavara contribuyeron por igual en la investigación. C. Ríos-Navarro llevó a cabo la investigación, compiló los datos, hizo el análisis, escribió el artículo y revisó el manuscrito final. J. Gavara llevó a cabo la investigación, compiló los datos, hizo el análisis, escribió el artículo y revisó el manuscrito final. J. Núñez concibió y diseñó el análisis, compiló los datos y revisó el manuscrito final. E. Revuelta-López llevó a cabo la investigación, compiló los datos y revisó el manuscrito final. J.V. Monmeneu llevó a cabo la investigación, compiló los datos y revisó el manuscrito final. M.P. López-Lereu llevó a cabo la investigación, compiló los datos y revisó el manuscrito final. E. de Dios llevó a cabo la investigación, compiló los datos y revisó el manuscrito final. N. Pérez-Solé llevó a cabo la investigación, compiló los datos y revisó el manuscrito final. J.M. Vila compiló los datos y revisó el manuscrito final. R. Oltra compiló los datos y revisó el manuscrito final. F.J. Chorro compiló los datos, obtuvo la financiación y revisó el manuscrito final. A. Bayés-Genís concibió y diseñó el análisis, obtuvo la financiación, redactó el artículo preliminar y revisó el manuscrito final. V. Bodí concibió y diseñó el análisis, obtuvo la financiación, redactó el artículo preliminar y revisó el manuscrito final.
- –
La OMV se relaciona con un peor pronóstico después del IAMCEST. La OMV es un fenómeno multifactorial en el que las células endoteliales tienen una importancia crucial. La EpCAM participa en la fisiología del endotelio y se ha estudiado poco su participación en las enfermedades cardiovasculares. Es crucial estudiar la EpCAM como factor de predicción de la OMV generalizada para conocer mejor su fisiopatología y ofrecer nuevas alternativas terapéuticas.
- –
Los valores de EpCAM circulante a las 24h de una revascularización coronaria se relacionan de forma negativa con la OMV determinada mediante RMC a la semana. Los valores de EpCAM más altos también se relacionan con índices de remodelación del VI a largo plazo, como demuestran una FEVI reducida y el aumento de volumen telesistólico del VI. Se trata de resultados preliminares y serán necesarios más estudios para confirmar que la EpCAM es un biomarcador y, con el tiempo, una diana biológica en la fisiopatología del IAMCEST.
Los autores no declaran ninguno.