Más de 140 millones de personas habitan sobre los 2.500 m de altura. En la región andina existe la mayor densidad de población sobre los 3.500 m. Por otro lado, es creciente el número de personas que habitan a nivel del mar (NM) y se movilizan a alturas mediana, grande o extrema por razones laborales o científicas, por turismo o por deporte, como ocurre con excursionistas, montañistas y esquiadores. Por ello es de interés conocer los efectos de la altura en aspectos fisiológicos y estructurales del organismo humano.
Los efectos de la altura se deben a la baja presión barométrica y, por lo tanto, a una reducción en la presión parcial de oxígeno en el aire inspirado. Esta condición de hipoxia hipobárica es la causa de la hipoxia alveolar e hipoxemia en los seres humanos que habitan o ascienden a la altura. Múltiples son las respuestas al estímulo hipóxico, así como los mecanismos adaptativos. En ocasiones, hay mala adaptación en quien asciende a la altura. En otras, hay pérdida de la adaptación en el nativo de altura. En este artículo editorial se revisan resumidamente los efectos de la altura en la circulación pulmonar en tres situaciones: hipoxia crónica, hipoxia aguda e hipoxia subaguda.
Hipoxia crónicaNativo normal de grandes alturasEstudios pioneros de investigadores peruanos demostraron con cateterismo cardiaco la presencia de hipertensión pulmonar (HP) asintomática en nativos sanos residentes en una comunidad andina ubicada a 4.540 m de altura1. Posteriores investigaciones a diferentes alturas en los Andes y en Asia permitieron establecer que la relación entre la altitud y la presión arterial pulmonar media (PAPm) está representada por una curva de tipo parabólico, de forma tal que por encima de los 3.500 m hay HP leve a moderada asociada con niveles adaptativos de hipoxemia y policitemia. En nuestro estudio, a 4.540 m (presión barométrica, 445 mmHg; presión parcial de oxígeno en el aire inspirado, 80 mmHg), la PAPm fue 28 mmHg, con saturación arterial de oxígeno (SaO2) del 80% y hemoglobina en 20 g/dl1. En nativos que viven a esta altitud fallecidos en accidente, el estudio histológico cuantitativo de las arterias pulmonares demostró engrosamiento de la capa media de células musculares lisas (CML) en las pequeñas arterias distales, con extensión de la capa muscular hasta las arteriolas2. Estos hallazgos explican el incremento de la resistencia vascular pulmonar, la HP y la hipertrofia ventricular derecha.
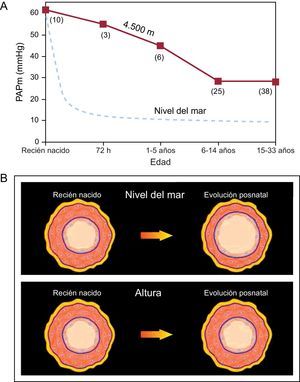
En una revisión histórica, Reeves y Grover3 han destacado que fueron científicos peruanos los primeros en demostrar la patogenia de la HP hipóxica crónica en humanos al describir los cambios posnatales de la circulación pulmonar3. Los investigadores peruanos demostraron que el recién nacido a grandes alturas (GA) tiene HP y gruesa capa de CML en las pequeñas arterias y arteriolas pulmonares, hallazgos similares a los descritos a NM. Constituyen, tanto a NM como en GA, expresión remanente del patrón fetal. Sin embargo, en el recién nacido a NM tiene lugar un rápido remodelamiento vascular —adelgazamiento de la capa muscular con ampliación del lumen—, lo que determina un rápido descenso de la resistencia vascular pulmonar y de la PAP. En contraste, en el recién nacido a GA, el remodelamiento vascular ocurre lentamente en el curso de la vida, por lo cual la HP y la hipertrofia ventricular derecha persisten hasta la edad adulta (Figura 1)1, 2, 4.
Figura 1. A: relación entre presión arterial pulmonar media y edad en nativos normales que habitan a grandes alturas, a 4.540 m (línea continua), en comparación con los datos descritos en residentes a nivel del mar (línea punteada) (los números entre paréntesis indican el número de casos); la presión arterial pulmonar media declina rápidamente a nivel del mar; en contraste, en el nativo que vive a grandes alturas el grado de hipertensión pulmonar declina lentamente y puede persistir hasta la edad adulta. B: representación esquemática del remodelamiento posnatal de las arterias pulmonares distales; este proceso de maduración ocurre rápidamente a nivel del mar en contraste con el lento proceso que tiene lugar en grandes alturas. PAPm: presión arterial pulmonar media. Reproducido de Penaloza y Arias-Stella 4 , con permiso de Wolters Kluwer-LWW.
Durante el ejercicio la respuesta de la PAP en el nativo de GA es mayor que en el habitante a NM, a pesar de que la carga de trabajo y el gasto cardiaco sean similares o incluso menores. Esto se debe a la menor distensibilidad de las arterias pulmonares como consecuencia de la gruesa capa de CML5. Sin embargo, el nativo de GA es capaz de realizar actividad física similar o incluso mayor que el residente a NM aclimatado a GA. La HP del nativo de GA es reversible tras prolongada residencia a NM6. Es interesante señalar que los nativos del Tíbet, que tienen el más antiguo ancestro de vida en altura, se comportan, tanto en reposo como en ejercicio, de forma similar al habitante a NM debido a que está genéticamente adaptado7.
Mal de montaña crónicoAlgunos residentes de GA pierden su capacidad de adaptación y desarrollan mal de montaña crónico (MMC)8. En estos pacientes se observa reducción de la ventilación alveolar, que se acentúa durante el sueño. La hipoventilación alveolar determina hipoxemia de mayor grado que en el nativo normal. Como consecuencia, hay respuesta incrementada de eritropoyetina, policitemia exagerada, HP acentuada e incremento de la hipertrofia ventricular derecha y, en algunos casos, insuficiencia cardiaca congestiva. En el estudio hemodinámico realizado por nuestro grupo en pacientes con MMC, se obtuvo los siguientes datos:PAPm, 47 mmHg; SaO2, 70%, y hemoglobina, 25 g/dl4, 9.
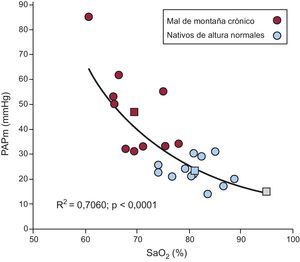
El cuadro clínico de estos pacientes es similar al que se observa a NM en casos de enfermedad pulmonar obstructiva crónica avanzada, gran obesidad y apnea del sueño severa. Una observación importante en el MMC es la relación inversa entre PAPm y SaO2. A menor SaO2, mayor HP. Esto se muestra en la Figura 2, que compara pacientes con MMC, nativos normales de GA y residentes de NM4. Durante el ejercicio, aun a baja carga, se observa disminución de la SaO2 e HP severa4, 9, 10. Durante el sueño se observa hipoventilación e hipoxemia acentuadas y, consecuentemente, HP exagerada11.
Figura 2. Relación inversa entre presión arterial pulmonar media y saturación arterial de oxígeno en pacientes con mal de montaña crónico. A medida que la saturación arterial de oxígeno disminuye, la presión arterial pulmonar media se incrementa, de tal forma que el paciente con la saturación arterial de oxígeno más baja tiene el mayor grado de hipertensión pulmonar (granate). Con fines de comparación se muestran los valores obtenidos en los nativos normales que residen a gran altura (azul). Se muestran también los valores medios de presión arterial pulmonar media correspondientes a ambos grupos y a los residentes a nivel del mar (cuadrados). PAPm: presión arterial pulmonar media; SaO2: saturación arterial de oxígeno. Reproducido de Penaloza y Arias-Stella 4 , con permiso de Wolters Kluver-LWW.
El MMC puede ser primario debido a hipoventilación alveolar relacionada principalmente con el incremento de la edad. Con frecuencia el MMC es secundario a enfermedad pulmonar, obesidad y apnea del sueño. En otros casos hay relación con el tabaco y la polución tanto ambiental (poblaciones mineras) como doméstica (exposición crónica al humo de cocinas de leña u otros combustibles de biomasa). Los raros reportes patológicos de pacientes que mueren con el diagnóstico de MMC e insuficiencia cardiaca corresponden a MMC secundario. En estos casos se encuentra gran hipertrofia ventricular derecha, excesiva muscularización de las arterias pulmonares distales y engrosamiento de la adventicia4.
El tratamiento ideal del MMC es el descenso a NM. Una alternativa paliativa es la sangría isovolémica. Se han realizado ensayos farmacológicos con acetozolamida, que incrementa la ventilación alveolar y mejora la hipoxemia; nifedipino, que disminuye la HP pero tiene efecto sistémico, y sildenafilo, que selectivamente reduce la HP y mejora la tolerancia al ejercicio4.
Hipoxia agudaMal de montaña agudoLos residentes a NM que suben a altitudes medianas o grandes sufren, en mayor o menor grado, mal de montaña agudo o «soroche». El grado de susceptibilidad al mal de montaña agudo es variable. Los síntomas más frecuentes son cefalea, trastornos del sueño, trastornos gastrointestinales y mareos. La principal causa es la hipoxemia, y por ello el tratamiento es la administración de oxígeno y, en casos graves, el retorno a lugares bajos. Es de interés conocer que el ascenso a altura determina incremento de la PAP, tanto en las personas con mal de montaña agudo como en las que permanecen asintomáticas al llegar a la altura. Es una respuesta intrínseca de la CML a la hipoxia alveolar; el grado de HP es generalmente discreto y no participa en los síntomas del mal de montaña agudo. Ocurre tanto a turistas como a excursionistas, esquiadores y montañistas. El uso de acetozolamida es la profilaxis más aceptada. Se ha demostrado que el ascenso escalonado atenúa el grado de HP12, por lo que se recomienda como medida para prevenir un cuadro clínico grave denominado edema pulmonar por ascensión a altura (EPAA) asociado a HP severa.
Edema pulmonar por ascensión a alturaAlgunos residentes de NM que ascienden a GA sufren EPAA, una entidad clínica grave y potencialmente fatal. Ocurre pocos días después de la llegada a GA. Los primeros casos se describieron en Perú, en jóvenes nativos de GA que retornaban a la altura después de permanecer algunas semanas a NM13. A esta modalidad clínica se la ha denominado EPAA por reascenso (reentrada). Posteriormente, se han hecho numerosos estudios en los Andes, las Montañas Rocosas de Estados Unidos, en Asia y los Alpes. En el Monte Rosa, ubicado en los Alpes italianos a 4.559 m, se han realizado importantes estudios experimentales sobre susceptibilidad, mecanismo, prevención y tratamiento del EPAA.
El EPAA es un modelo de edema pulmonar no cardiogénico debido a HP hipóxica severa e incremento de permeabilidad en la membrana alveolocapilar. La altitud, la velocidad de ascenso, el grado de actividad física y la susceptibilidad individual son factores determinantes del EPAA. El cuadro clínico se caracteriza por fatiga, disnea, tos, esputo rosado y espumoso, taquicardia, taquipnea, cianosis y rales pulmonares. La radiografía de tórax muestra infiltrados en forma de opacidades densas, confluentes y de distribución variable en los campos pulmonares14. El EPAA ocurre en individuos susceptibles con exagerada reactividad arterial pulmonar a la hipoxia. La susceptibilidad se ha atribuido a un defecto en la síntesis pulmonar de óxido nítrico15.
Hay escasos estudios hemodinámicos con cateterismo cardiaco durante el episodio de EPAA a la misma altitud en que ocurre el evento16. Investigadores peruanos realizaron este tipo de estudios en un laboratorio ubicado en la población andina de Cerro de Pasco, a 4.340 m, y detectaron las cifras de SaO2 más bajas (media, 57%) y las de HP más altas (media de PAPm, 63 mmHg) que se haya descrito en el EPAA17. Maggiorini et al18 realizaron estudios similares en montañistas susceptibles a quienes se indujo el EPAA experimentalmente por el rápido ascenso a un laboratorio construido en el refugio «Regina Margherita», en la cumbre del Monte Rosa, a 4.559 m. En este estudio se demostró incremento de la presión capilar pulmonar (media, 22 mmHg) y valor normal de la presión de oclusión (presión en cuña o wedge pressure)18. El concepto actual de la patogenia del EPAA implica la combinación de dos procesos concurrentes: a) vasoconstricción pulmonar hipóxica exagerada y no homogénea, lo cual determina excesiva HP e incremento de la presión capilar pulmonar y, como consecuencia, daño de la membrana alveolocapilar (capillary stress failure) e inundación alveolar18, 19, 20, y b) defecto en el drenaje del fluido alveolar debido a deficiente transporte transepitelial de sodio21.
El mecanismo de la HP en el EPAA difiere del que se ha descrito en el nativo de altura, en el que el principal factor de la HP es la gruesa capa de CML en las arterias pulmonares distales. En la mayoría de los casos con EPAA, el factor principal de la HP severa no es estructural, ya que ocurre en residentes a NM con arterias pulmonares normales (turistas, excursionistas, montañistas). El factor principal es la vasoconstricción hipóxica, propiedad intrínseca de la CML. El estímulo hipóxico actúa en el sarcolema de la CML inhibiendo la corriente de salida en los canales de K+ dependientes de voltaje (Kv), lo cual induce despolarización de la membrana y apertura de los canales de Ca2+ dependientes de voltaje. El ingreso de Ca2+ estimula la liberación del Ca2+ depositado en el retículo sarcoplásmico, lo que aumenta el Ca2+ citosólico que, por sucesivas acciones enzimáticas, actúa sobre el aparato contráctil actina-miosina y determina la contracción de la CML22.
Sin embargo, la hipoxia aguda induce también disfunción endotelial, lo cual activa la vía de la endotelina y su efecto vasoconstrictor23, en tanto que deprime las vías del óxido nítrico y la prostaciclina y su efecto vasodilatador. Además, la hipoxia aguda activa el sistema simpático y su efecto vasoconstrictor24. Estos mecanismos permiten entender el efecto beneficioso del oxígeno, el óxido nítrico y fármacos vasodilatadores tales como los bloqueadores de los canales de Ca2+ (nifedipino), los análogos de la prostaciclina (iloprost) y los inhibidores de la fosfodiestarasa 5 (sildenafilo, tadalafilo). Según el agente empleado, se bloquean los canales de Ca2+, se abren los canales de K+ y se activan las vías del óxido nítrico y la prostaciclina, lo cual incrementa la generación de guanosinmonofosfato cíclico y adenosinmonofosfato cíclico, mediadores de la vasorrelajación de las CML.
Hipoxia subagudaLos efectos de la hipoxia subaguda para el corazón y la circulación pulmonar se describieron hace cinco décadas en terneros trasladados para pastar a entre 2.500 y 3.770 m de altitud en las Montañas Rocosas de Utah (Estados Unidos). Tras algunas semanas, en estos animales se desarrollaba exceso de HP asociada a gruesa capa de CML en las arterias pulmonares distales y, consecuentemente, una exagerada hipertrofia ventricular derecha e insuficiencia cardiaca. Estos animales morían si permanecían en altura, pero se recuperaban rápidamente una vez trasladados a lugares bajos. Esta enfermedad de los bovinos ocasionada por hipoxia subaguda se denominó brisket disease25.
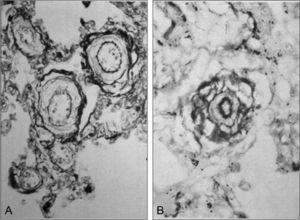
Hace cinco décadas, investigadores chinos describieron un cuadro clínico similar en niños lactantes de la etnia Han que nacen en niveles bajos y luego son trasladados a GA donde, tras semanas o meses, presentan HP severa e insuficiencia cardiaca, con resultado fatal si no se traslada a los niños a lugares bajos. Posteriormente, investigadores chinos y británicos realizaron un estudio clínico-patológico y describieron esta entidad con el nombre de mal de montaña subagudo infantil26, 27. En ese estudio destaca el hallazgo de masiva hipertrofia ventricular derecha y exagerada hipertrofia de la capa media de CML en las pequeñas arterias y arteriolas pulmonares (Figura 3), lo cual implica excesiva vasorreactividad a la hipoxia y HP severa. El origen vascular del mal de montaña subagudo infantil difiere del mecanismo respiratorio inicial observado en el MMC del adulto. Investigaciones hemodinámicas en el mal de montaña subagudo infantil realizadas con cateterismo cardiaco, y más recientemente con ecografía Doppler, han confirmado HP severa. En un estudio realizado en China en 55 niños, la PAPm alcanzó el nivel de 72 mmHg28. El mal de montaña subagudo infantil se observa en los Andes con menos frecuencia, pero se han comunicado algunos casos2.
Figura 3. A: secciones transversas de pequeñas arterias pulmonares de un niño de la etnia Han, de 11 meses de edad, llevado por sus padres a vivir en Lhasa (Tíbet) a 3.600 m; tras algunas semanas, contrajo mal de montaña subagudo infantil; se observa gran hipertrofia de la capa muscular media (Elastica van Gieson ×600). B: sección transversa de una arteriola del mismo caso; se observa una capa muscular media muy gruesa entre las láminas elásticas, de las cuales la interna es particularmente gruesa (Elastica van Gieson ×1.000); se debe tener en cuenta que a nivel del mar las arteriolas no tienen capa muscular y sus dos láminas elásticas están fusionadas. Reproducido de Heath 27 , con permiso de la Universidad Peruana Cayetano Heredia.
Conflicto de interesesNinguno.
Autor para correspondencia: Instituto de Investigaciones de la Altura, Universidad Peruana Cayetano Heredia, Avda. Honorio Delgado 430, Urb. Ingeniería, S.M.P., Lima 31, Perú. penaloza.dante@gmail.com