La disección coronaria espontánea (DCE) se define por la separación aguda de las capas de la pared de la arteria coronaria que crea una falsa luz debido a la acumulación de sangre que se produce por causa no traumática ni iatrogénica. Por lo general, la falsa luz suele crear una compresión de la verdadera luz, de manera que se produce una disminución del flujo que causa isquemia miocárdica. Su fisiopatología no está clara y se han propugnado 2 posibles mecanismos. En el primero, una rotura de la capa íntima del endotelio favorece la salida de sangre procedente del torrente sanguíneo a la capa media de la arteria (mecanismo inside-out). En el segundo, una hemorragia inicial en la pared de la arteria procedente de los vasa vasorum (mecanismo outside-in) crea un hematoma intramural. Si la presión dentro del hematoma crece, se produce una rotura secundaria del endotelio y una comunicación con la luz del vaso. Por lo tanto, encontrar una puerta de entrada en un estudio de imagen no es específico del primer mecanismo.
La incidencia real de dicha entidad no se conoce con exactitud, ya que suele ser un hallazgo. En las últimas series publicadas y en los recientes documentos de consenso de las sociedades internacionales1,2, parece situarse entre el 0,07 y el 0,2% de las coronariografías. En los estudios realizados en el síndrome coronario agudo (SCA), esta incidencia asciende a un 1-4%. Está bien establecida su mayor incidencia en mujeres (cerca del 90% de los casos), y suele ser una de las causas más frecuentes de SCA en mujeres de menos de 50 años (hasta un 25%) y asciende a un 34% en casos de infarto agudo de miocardio en dicho grupo. Por último, es la causa más frecuente de infarto agudo de miocardio en mujeres en el periparto. Esta entidad se ha relacionado con diferentes condiciones como la displasia fibromuscular, factores relacionados con el embarazo, enfermedades del tejido conectivo y recientemente el hipotiroidismo3,4.
En un reciente artículo publicado en Revista Española de Cardiología, García-Guimaraes et al.5 presentan los datos de un registro español realizado durante 4 años en 31 centros. Es una de las series con mayor número de pacientes incluidos y presenta una foto muy interesante de esta entidad en nuestro medio. Así, confirma los datos demográficos en cuanto a edad (53 años) y sexo (el 88% mujeres) y la presentación clínica mayoritaria en forma de SCA (92%).
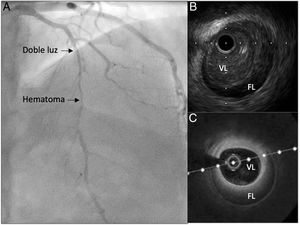
Dado que su presentación más frecuente es el SCA, la angiografía coronaria suele ser el método diagnóstico inicial, y se han definido diferentes patrones6. La confirmación definitiva requeriría de una técnica de imagen intravascular, ya sea la ecografía intracoronaria o la tomografía de coherencia óptica (figura 1). La realización de estas técnicas requiere pasar una guía intracoronaria por la zona de disección, lo que supone un riesgo de complicaciones que pueden desencadenar una pérdida de flujo coronario7. Por ello, deberían reservarse solo para los casos con una angiografía dudosa y deberían realizarlas operadores experimentados, tanto en el campo del intervencionismo coronario como en la interpretación de imágenes intracoronarias.
La actitud terapéutica es crucial. El curso de la DCE suele ser hacia una curación, por lo que la experiencia acumulada y los documentos de consenso1,2 recomiendan una estrategia inicial conservadora. La intervención coronaria percutánea (ICP) se debería limitar a pacientes con isquemia refractaria en los que se hayan documentado oclusión coronaria, arritmias ventriculares o inestabilidad hemodinámica. La ICP en este tipo de lesiones tiene un resultado peor que la ICP de lesiones arterioescleróticas8,9 y un potencial riesgo de complicaciones: disección iatrogénica sobre DCE, paso de guía a la falsa luz, propagación del hematoma intramural o disección distal no tratable. Incluso se han descrito recomendaciones para realizar una ICP diferente de la convencional: tratar de recuperar el flujo distal solo con angioplastia con balón, usar balones de corte para poder fenestrar la falsa luz, lo que disminuye la presión en su interior y evita su propagación, o usar stents liberadores de fármaco de última generación en lugar de stents metálicos. El presente estudio5 apoya claramente dicha actitud, ya que el abordaje de un 78% de los pacientes fue conservador, modalidad que se mostró como un predictor independiente de buena evolución clínica posterior.
Una vez establecida una estrategia conservadora inicial, es muy importante el tratamiento médico. La controversia más importante se presenta en el tratamiento antitrombótico, que puede ser diferente del recomendado para un SCA de etiología arterioesclerótica, para el que la doble antiagregación más anticoagulación es el tratamiento estándar indicado. Esta recomendación se basa en el papel primordial de la aceleración de la cascada aterotrombótica y el trombo intracoronario resultante en la limitación del flujo coronario distal. Por el contrario, estudios recientes10 mediante tomografía de coherencia óptica han mostrado que la presencia de trombo en DCE es escasa: el 36% de los casos de falsa luz fenestrada y el 14% de las DCE no fenestradas, por lo que un tratamiento antitrombótico intenso no es tan vital. Incluso si, como piensan muchos autores, el mecanismo fisiopatológico más frecuente es el hematoma intramural por hemorragia de los vasa vasorum, el tratamiento intenso puede ser incluso perjudicial11. Otros antiagregantes plaquetarios más potentes, como el prasugrel, el ticagrelor o los inhibidores de los receptores de la glucoproteína IIb/IIIa, están claramente desaconsejados. El presente registro muestra que, a pesar de que se sometió a ICP al 26% de los pacientes (para quienes estaría indicado el tratamiento antiagregante plaquetario doble), al alta se prescribió el tratamiento antiagregante plaquetario doble hasta en un 59% de los casos, lo que supondría un exceso de un 33% de casos respecto a las recomendaciones.
El papel de la anticoagulación sistémica es aún más controvertido. La recomendación actual es que, una vez se ha diagnosticado la DCE, en ausencia de otras indicaciones específicas para la anticoagulación (trombo intracoronario, fibrilación auricular, tromboembolia sistémica), esta se debe retirar de inmediato12.
Se puede considerar que el pronóstico de esta entidad es bastante benigno en términos de supervivencia. La serie con seguimiento más prolongado13 muestra una supervivencia del 92,3% a los 10 años, mientras que la serie con mayor número de pacientes muestra una supervivencia del 98,8% a los 3 años14. En cuanto a morbilidad, el pronóstico no es tan benigno, ya que se describen datos de eventos cardiovasculares en un 20-47,9% según la longitud del seguimiento, y el reinfarto fue el evento más frecuente. Lo que es más importante, la tasa de recurrencia de DCE se sitúa entre el 17 y el 22% a los 3 años. Este es un dato de difícil interpretación, ya que se consideran tanto progresiones de la disección inicial como nuevos fenómenos en territorios diferentes transcurridos 30 días o más del episodio inicial. Se han encontrado factores pronósticos favorecedores de la redisección, como la hipertensión arterial14 y la tortuosidad coronaria15, mientras que el tratamiento con bloqueadores beta ha mostrado un efecto protector14.
Como ya se ha comentado, la evolución más frecuente es a la curación del problema, por lo que es muy importante que se pueda constatar dicha curación una vez superados los síntomas. A diferencia de la fase inicial, en la que la gravedad del cuadro clínico hace abogar por la realización de una coronariografía invasiva, diferentes series han señalado la utilidad de la angiografía coronaria no invasiva mediante tomografía computarizada multicorte para su seguimiento16. Así, dado que la DCE es más frecuente en mujeres jóvenes, en quienes el tratamiento antiagregante puede producir menorragias2, se ha propuesto que detectar la «curación» puede justificar la finalización de todo tratamiento antitrombótico con seguridad.
Estudios recientes confirman la relativa benignidad del cuadro clínico, después de realizar un análisis de la función ventricular a largo plazo mediante resonancia magnética cardiaca17. La disminución de la fracción de eyección general es muy ligera (57%), y no se detecta realce tardío de gadolinio hasta en un 39% de los casos.
En resumen, la DCE debe sospecharse ante mujeres jóvenes con un SCA. Para su confirmación en la fase aguda se debe realizar una angiografía coronaria invasiva y solo en casos dudosos emplear técnicas específicas de diagnóstico intracoronario. La estrategia inicial debe ser conservadora, y se debe reservar la ICP para casos con oclusión del flujo coronario distal. El tratamiento médico es diferente que el del SCA de etiología arterioesclerosa, ya que se recomienda evitar tratamientos antitrombóticos intensos. Para la comprobación de la curación, la tomografía computarizada multicorte coronaria puede ser la técnica de elección. El tratamiento a largo plazo no está claro pues, a pesar de que la mortalidad es muy baja, la tasa de recurrencias puede ser elevada.
CONFLICTO DE INTERESESLos autores no presentan conflictos de intereses relacionados con el presente manuscrito.