A pesar de los avances en la predicción de la muerte súbita cardiaca (MSC) en la miocardiopatía hipertrófica (MCH), continúa aumentando el interés en nuevos marcadores de riesgo1. Se ha propuesto el realce tardío de gadolinio (RTG), medido como porcentaje de la masa del ventrículo izquierdo (VI) en la resonancia magnética cardiaca (RMC), como predictor independiente de MSC2. Al parecer, las áreas de fibrosis intersticial o desorganización miocítica también son importantes en la formación de arritmias ventriculares3.
Las técnicas de imagen de seguimiento tisular facilitan la determinación cuantitativa de las propiedades mecánicas del miocardio mediante la evaluación de la deformación miocárdica. Se ha demostrado que la reducción de la deformación se correlaciona con la fibrosis intersticial3 y se han descrito valores de deformación más bajos en áreas de miocardio hipertrofiado no potenciado, lo que indica que mecanismos como la desorganización miocítica también puedan contribuir a ello4. La RMC de seguimiento de características (RMC-FT) se utiliza cada vez más en la práctica clínica debido a la combinación de calidad de imagen con la posibilidad de un fácil análisis de las imágenes posprocesadas. Las mediciones generales son más reproducibles que las regionales; aunque es factible, la experiencia en el uso de mediciones de deformación miocárdica en 3D es escasa.
Nuestro objetivo es analizar la asociación entre las mediciones generales en 2D de la deformación del VI utilizando RMC-FT, las características morfológicas y los marcadores pronósticos en la MCH.
Se realizó una revisión retrospectiva de una serie consecutiva de pacientes con MCH en seguimiento clínico en 2 centros de referencia. Los pacientes eran mayores de 16 años y se les realizó una valoración diagnóstica mediante RMC durante el seguimiento. Se excluyó a aquellos con MCH por enfermedades metabólicas o sindrómicas o con evidencia de arteriopatía coronaria (estenosis coronaria ≥ 50% o RTG subendocárdico en la RMC). Se definió como «arritmia ventricular» (AV) la taquicardia ventricular no sostenida en la monitorización con Holter de 24 h (tiempo decidido por el especialista), la taquicardia ventricular sostenida, la fibrilación ventricular o la MSC. El riesgo de MSC se estimó utilizando la puntuación propuesta en la guía de 2014 de la Sociedad Europea de Cardiología.
Las imágenes de RMC se obtuvieron en escáneres de 1,5 T, y 2 lectores expertos (1 en cada centro) realizaron el análisis de las imágenes. El RTG se evaluó 10-15 min después de la administración intravenosa de gadobutrol-gadoterato de meglumina y se utilizó la reconstrucción con recuperación de la inversión en función de la fase sensible. La pila de imágenes con RTG del eje corto del VI se evaluó primero visualmente para detectar la presencia de RTG. A continuación, un lector experto (N. Dias Ferreira) realizó la cuantificación de RTG en todos los estudios positivos para RTG midiendo regiones con una intensidad de señal > 5 DE por encima del miocardio remoto y expresadas como porcentaje de la masa del VI. La deformación o strain radial global (GRS), la deformación longitudinal global (GLS) y la deformación circunferencial global (GCS) máximas en 2D se evaluaron retrospectivamente en secuencias de precesión libre en estado estacionario con un software disponible en el mercado (cvi42, Circle Cardiovascular Imaging Inc., Canadá). Los límites endocárdico y epicárdico se dibujaron manualmente en las imágenes telediastólica y telesistólica de los cortes de eje largo y en todos los cortes de eje corto comprendidos entre la base y el vértice. Se calculó la media de la GLS a partir de las 3 vistas longitudinales estándares, mientras que las medias de la GRS y la GCS se calcularon a partir de los planos de eje corto basal, medio y apical del VI.
Las comparaciones entre grupos se realizaron mediante la prueba de la t de Student, la prueba de la U de Mann-Whitney, la prueba de Kruskal-Wallis, la prueba de la χ2 o la prueba exacta de Fisher según correspondiera. Las correlaciones se midieron con el coeficiente de Spearman. La significación estadística se definió como un valor de p < 0,05.
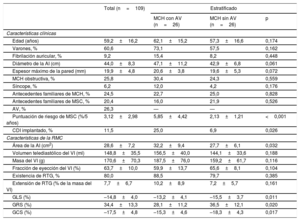
Se incluyó en el estudio a 109 pacientes con MCH (el 60,6% varones), con una media de edad de 59,2±16,2 años. El seguimiento medio fue de 39±25 meses y se documentó AV en 26 pacientes (26,3%): 24 con taquicardia ventricular no sostenida y 2 con MSC. El riesgo medio basal de MSC estimado a 5 años fue del 3,12 ± 2,98% (el 79,1% en riesgo bajo, el 11,6% en riesgo intermedio y el 9,3% en alto riesgo). Se observó RTG en el 80% de los pacientes y afectaba al 7,7 ± 6,7% de la masa del VI. Los valores medios de GLS, GRS y GCS fueron del −14,8 ± 4,0%, el 34,4 ± 13,3% y el −17,5 ± 4,8% respectivamente. La tabla 1 resume las características clínicas y de la RMC del total de la población y después de la estratificación en función de la existencia de AV.
Características clínicas y de la RMC del total de la población y después de la estratificación en función de la existencia de AV
| Total (n=109) | Estratificado | |||
|---|---|---|---|---|
| MCH con AV (n=26) | MCH sin AV (n=26) | p | ||
| Características clínicas | ||||
| Edad (años) | 59,2±16,2 | 62,1±15,2 | 57,3±16,6 | 0,174 |
| Varones, % | 60,6 | 73,1 | 57,5 | 0,162 |
| Fibrilación auricular, % | 9,2 | 15,4 | 8,2 | 0,448 |
| Diámetro de la AI (cm) | 44,0±8,3 | 47,1±11,2 | 42,9±6,8 | 0,061 |
| Espesor máximo de la pared (mm) | 19,9±4,8 | 20,6±3,8 | 19,6±5,3 | 0,072 |
| MCH obstructiva, % | 25,8 | 30,4 | 24,3 | 0,559 |
| Síncope, % | 6,2 | 12,0 | 4,2 | 0,176 |
| Antecedentes familiares de MCH, % | 24,5 | 22,7 | 25,0 | 0,828 |
| Antecedentes familiares de MSC, % | 20,4 | 16,0 | 21,9 | 0,526 |
| AV, % | 26,3 | — | — | |
| Puntuación de riesgo de MSC (%/5 años) | 3,12±2,98 | 5,85±4,42 | 2,13±1,21 | <0,001 |
| CDI implantado, % | 11,5 | 25,0 | 6,9 | 0,026 |
| Características de la RMC | ||||
| Área de la AI (cm2) | 28,6±7,2 | 32,2±9,4 | 27,7±6,1 | 0,032 |
| Volumen telediastólico del VI (ml) | 148,8±35,5 | 156,5±40,0 | 144,1±33,6 | 0,188 |
| Masa del VI (g) | 170,6±70,3 | 187,5±76,0 | 159,2±61,7 | 0,116 |
| Fracción de eyección del VI (%) | 63,7±10,0 | 59,9±13,7 | 65,6±8,1 | 0,104 |
| Existencia de RTG, % | 80,0 | 88,5 | 79,7 | 0,385 |
| Extensión de RTG (% de la masa del VI) | 7,7±6,7 | 10,2±8,9 | 7,2±5,7 | 0,161 |
| GLS (%) | –14,8±4,0 | –13,2±4,1 | –15,5±3,7 | 0,011 |
| GRS (%) | 34,4±13,3 | 28,1±11,2 | 36,5±12,1 | 0,020 |
| GCS (%) | –17,5±4,8 | –15,3±4,6 | –18,3±4,3 | 0,017 |
AI: aurícula izquierda; AV: arritmias ventriculares; CDI: cardioversor-desfibrilador implantable; GCS: deformación circunferencial global; GLS: deformación longitudinal global; GRS: deformación radial global; MCH: miocardiopatía hipertrófica; MSC: muerte súbita cardiaca; RMC: resonancia magnética cardiaca; RTG: realce tardío de gadolinio; VI: ventrículo izquierdo.
Salvo otra indicación, los valores expresan media±desviación estándar.
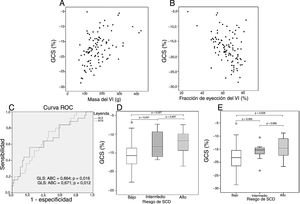
Los valores de deformación se correlacionaron con una mayor masa del VI (GLS, r=0,46; GRS, r=−0,46; GCS, r=0,47; todos con p < 0,001) (figura 1A), una fracción de eyección del VI reducida (GLS, r=−0,33; GRS, r=0,44; GCS, r=−0,41; todos con p < 0,003) (figura 1B) y extensión del RTG (GLS, r=0,24, p=0,027; GRS, r=−0,34, p=0,001; GCS, r=0,37; p < 0,001).
Diagramas de dispersión de los valores de GCS en relación con la masa (A) y la fracción de eyección del ventrículo izquierdo (B) que muestran una correlación entre ambas variables. Curva ROC para la capacidad de GLS y GCS de predecir arritmias ventriculares (C). Diagramas de cajas de GLS (D) y GCS (E) estratificados por categoría de riesgo de MSC. ABC: área bajo la curva; GCS: deformación circunferencial global; GLS: deformación longitudinal global; MSC: muerte súbita cardiaca; VI: ventrículo izquierdo.
Los pacientes con AV mostraron peores valores de deformación (GLS, el −13,2 ± 4,1% frente al −15,5 ± 3,7%; p=0,011; GRS, el 28,1 ± 11,2% frente al 36,5 ± 12,1%; p=0,02; GCS, el −15,3 ± 4,6% frente al −18,3 ± 4,3%; p=0,017) (tabla 1). La curva ROC para la capacidad de GLS y GCS de predecir AV mostró unas áreas bajo la curva de 0,664 (intervalo de confianza del 95% [IC95%], 0,535-0,793) y 0,671 (IC95%, 0,552-0,789) respectivamente (figura 1C).
Los pacientes con bajo riesgo de MSC estimado presentaron mejores valores de GLS que aquellos con riesgo intermedio (−15,5±3,8 frente a −12,6±3,5; p=0,031) (figura 1D) y riesgo alto (−12,2±3,6; p=0,027) (figura 1D). También presentaban mejores valores de GCS en comparación con los de alto riesgo (−18,0±4,5 frente a −14,5±4,3; p=0,028) (figura 1E) y una tendencia a mejores valores en comparación con los pacientes con riesgo de MSC intermedio (−15,9±3,3; p=0,065) (figura 1E).
Las correlaciones encontradas entre la deformación y la masa del VI, la fracción de eyección del VI y la extensión del RTG coinciden con estudios previos que utilizaron RMC-FT5,6. Sin embargo, la extensión del RTG no fue considerablemente diferente entre los pacientes con y sin AV. Esto podría explicarse, en parte, por la población relativamente pequeña. Otra limitación del estudio es el número residual de MSC; reproduciendo la metodología de otros estudios pequeños, se incluyó la taquicardia ventricular no sostenida en el objetivo compuesto de arritmia. Además, puesto que solo participaron pacientes a quienes se les realizó RMC, es posible que haya un sesgo de selección.
En nuestra cohorte, los valores medios de deformación estuvieron dentro del intervalo de normalidad. Sin embargo, fueron considerablemente mejores en los pacientes con menor riesgo de eventos arrítmicos.
En definitiva, las peores mediciones de deformación se asociaron con un fenotipo de MCH más grave, la existencia de AV y mayor riesgo de MSC estimado. Se necesitan estudios prospectivos de mayor tamaño para evaluar su valor incremental en relación con los marcadores de riesgo de MSC en la MCH existentes.