Hace más de 2 décadas, la actitud ante los pacientes en coma recuperados de una parada cardiaca extrahospitalaria (PCEH) consistía básicamente en ofrecer medidas de soporte vital y esperar una recuperación neurológica espontánea1. Esta mejoría raramente ocurría y, solo entonces, se iniciaba un estudio etiológico de la cardiopatía subyacente. Con la llegada de la hipotermia terapéutica, surgió la percepción de que quizá era necesario tener una actitud activa para facilitar la recuperación de los pacientes y prevenir o minimizar las consecuencias del denominado síndrome posparada2, cuadro este generado por un daño corporal masivo producido por una isquemia prolongada seguida de la reperfusión. Este cambio de actitud coincidió con la demostración en el estudio DANAMI-23 del beneficio de trasladar a los pacientes con síndrome coronario agudo con elevación del segmento ST (SCACEST) a un centro con capacidad permanente para intervención coronaria aunque no fuese el más cercano. Hasta entonces la reperfusión se realizaba mayoritariamente con fibrinolisis sistémica, donde el escenario de la PCEH no resultaba el más adecuado, especialmente después de una reanimación prolongada por los posibles traumatismos producidos durante las maniobras de reanimación. Por lo tanto, la reperfusión farmacológica solo se ofrecía a un escaso número de pacientes tras una reanimación de corta duración.
Con el paso del tiempo, comenzó a cobrar vida el concepto de que probablemente también los pacientes recuperados de una PCEH deberían ser trasladados a centros con capacidad permanente para intervención coronaria si fuese necesaria. Esta estrategia se recomendó en las guías de práctica clínica, pues la cardiopatía isquémica es la principal causa de PCEH en la población adulta4. La idea se sustentó en datos de los registros que indicaban que los pacientes tratados en centros con capacidad para una intervención coronaria en cualquier momento obtenían mejores resultados5. Sin embargo, resultaba evidente que había un sesgo de selección al confirmarse que los pacientes escogidos para intervención coronaria precoz tenían un perfil de riesgo más favorable o datos indiscutibles de sufrir un SCACEST6. Este fue el germen para indicar la necesidad de estudiar el posible papel de la realización sistemática y precoz de una angiografía coronaria a los pacientes reanimados de una PCEH.
En el artículo de Viana-Tejedor et al., recientemente publicado en Revista Española de Cardiología, se revelan los resultados del ensayo clínico aleatorizado COUPE7, el sexto que se publica, que intenta ofrecer alguna luz sobre esta controversia aún no resuelta7–12. El estudio COUPE, al igual que los ensayos previos, no ha demostrado superioridad alguna de una estrategia invasiva o conservadora inicial para los pacientes en coma recuperados de una PCEH sin elevación del segmento ST. La información obtenida del COUPE y los estudios previos, sin embargo, nos hace reflexionar sobre los ensayos clínicos realizados sobre esta condición, que quizá puedan resultar de utilidad para el diseño y la ejecución de futuras investigaciones.
DISEÑO DE LOS ESTUDIOS SOBRE EL PAPEL DE LA ANGIOGRAFÍA TRAS LA REANIMACIÓNEn general, el diseño de los estudios7–12, en su esquema, han buscado un planteamiento pragmático en mayor o menor grado, con pocos criterios de exclusión, persiguiendo una posible generalización de sus resultados al incluir a pacientes sin límite de edad, mayoritariamente con cualquier ritmo inicial, con comorbilidades, etc. Habitualmente esto podría constituir una virtud en sí misma, pues los estudios pragmáticos son los preferidos para definir una estrategia diagnóstico-terapéutica, pero pueden no resultar adecuados si no se adapta el tamaño de la muestra a las diferencias en el pronóstico que pueda ocasionar la asignación al azar de un tratamiento a poblaciones con riesgos heterogéneos. El hecho de que no existan diferencias significativas entre los factores asociados con el riesgo del grupo asignado al tratamiento experimental y al grupo de control no significa que los riesgos sean iguales, especialmente si la muestra es pequeña. La complejidad de la situación tras una PCEH hace que el tamaño muestral proyectado sea en todos ellos insuficiente para compensar los innumerables factores de confusión que se relacionan con el pronóstico y no se han considerado en la distribución de los brazos de los estudios. Si los estudios no están suficientemente dimensionados, el azar podría inclinar la balanza hacia uno u otro lado. Factores como las comorbilidades de los pacientes, el ritmo inicial, la duración de la reanimación, su calidad y la etiología, entre otras muchas, solamente pueden compensarse mediante una estratificación en la aleatorización o con tamaños muestrales amplios.
Por otra parte, también resulta importante la elección del objetivo primario en estudio. Salvo el estudio piloto DISCO9, diseñado para explorar la viabilidad de un ensayo clínico en este contexto, donde solo se ofrece la información de la mortalidad a las 24 horas, el resto de los estudios seleccionan como objetivo primario la mortalidad por cualquier causa (ARREST8, COACT11 y TOMAHAWK12) o la supervivencia con buen resultado neurológico (PEARL10 y COUPE7). Pero es necesario considerar que, si lo que se espera es una reducción de la mortalidad en la PCEH con una estrategia de angiografía sistemática y precoz, la reducción de la mortalidad obtenida sería a expensas de una reducción en la mortalidad cardiovascular de estos pacientes por el tratamiento de la cardiopatía isquémica, y no por la reducción en otras causas de muerte. Ninguno de los 6 estudios citados ha tenido en cuenta que la principal causa de muerte de los pacientes en coma tras una PCEH es la limitación del esfuerzo terapéutico debido a un predecible mal resultado neurológico. Esta es la causa en un 73% de los fallecimientos, mientras que la causa cardiovascular, como el shock cardiogénico o una nueva parada circulatoria, solamente sucede en el 21% y en una proporción menor, la limitación del esfuerzo terapéutico por otras comorbilidades u otras afecciones13. Por lo tanto, para que tenga impacto en una reducción significativa de la mortalidad por cualquier causa, una reducción exclusivamente de la mortalidad cardiovascular, que es lo que se podría esperar de una revascularización precoz, exigirá un tamaño muestral muy superior al proyectado en los 6 ensayos clínicos. Lo mismo sucedería en lo referente a la supervivencia con buen resultado neurológico, donde existen pocas bases fisiopatológicas para justificar que la angiografía precoz pudiese tener un gran impacto positivo, salvo el debido a menor mortalidad cardiovascular. Por lo tanto, un objetivo primario menos ambicioso podría ser la mortalidad cardiovascular. En el mundo de la cardiología, este planteamiento es bien conocido y aceptado en otros contextos, dada la dificultad de demostrar beneficios en objetivos «duros» como la mortalidad por cualquier causa y alcanzar el enorme tamaño de la muestra que sería necesario. En la insuficiencia cardiaca o la cardiopatía isquémica, por ejemplo, no resulta infrecuente que el objetivo primario de un estudio con un tratamiento novedoso sea demostrar su efecto en la mortalidad cardiovascular y la rehospitalización14. También puede servir de ilustración lo sucedido en el recientemente publicado estudio TTM-215, diseñado para valorar el efecto de controlar la temperatura a dos objetivos diferentes de 33 o <37,8°C, cuyo objetivo primario también fue la mortalidad por cualquier causa. El efecto esperado del control de la temperatura era disminuir el daño neurológico y con ello lograr una menor mortalidad total. Durante los 6 meses de duración del estudio, fallecieron 911 pacientes de los 1.850 analizados. El estudio no demostró beneficio con ninguno de los umbrales de temperatura. Pero es necesario resaltar que, la causa de muerte de un tercio de los pacientes fallecidos fue la limitación del esfuerzo terapéutico los primeros días del estudio no por un esperado mal resultado neurológico, sino por las importantes comorbilidades que presentaban los pacientes. Esta eventualidad ha restado significativamente potencia estadística al estudio. Quizá un diseño más razonable habría sido la mortalidad de causa neurológica o las secuelas neurológicas graves. Esto no se ha planteado nunca en el ámbito de los pacientes críticos y posiblemente debería considerarse para el diseño de algunos de los estudios futuros, especialmente en situaciones en que haya múltiples factores con posible efecto en el pronóstico.
Por lo tanto, si no es posible dimensionar de manera realista un estudio para un objetivo ambicioso y definitivo, como la mortalidad por cualquier causa, probablemente resulte más adecuado dimensionarlo para un objetivo más humilde pero a su vez capaz de resolver parte de las incógnitas que tenemos.
ANGIOGRAFÍA SELECTIVA O ANGIOGRAFÍA SISTEMÁTICA PARA TODOS LOS PACIENTES RECUPERADOS DE UNA PCEHLamentablemente, el estudio COUPE no pudo completarse debido a una inclusión de pacientes muy lenta que no alcanzó la muestra proyectada al inicio del estudio. Queda la duda sobre cuáles podrían haber sido los resultados si se hubiese completado la inclusión de pacientes y si habría sido de utilidad para la decisión de realizar o no una angiografía precoz a todos los pacientes. Aunque los autores del estudio COUPE atribuyen la baja tasa de inclusión en gran medida al impacto de la pandemia de COVID-19, que disminuyó el número de pacientes recuperados de una PCEH, se puede deducir que el impacto de la pandemia en el estudio realmente ha sido pequeño. Dada la evolución del estudio, que comenzó en 2016 y se esperaba que concluyera en 3 años, la velocidad de inclusión de pacientes fue menor de lo esperado a lo largo de todo el estudio, y solo se vio afectada por la pandemia en los últimos 10 meses del periodo de inclusión de pacientes, de casi 5 años. Lo que sí es posible es que la pandemia tuviera un impacto en la finalización prematura, ya que probablemente se supuso que demoraría en exceso su conclusión. Seguramente la causa más probable de la baja inclusión de pacientes es la enorme dificultad que presenta la realización de ensayos clínicos en pacientes críticos, sobre todo si se trata de pacientes con una elevada mortalidad, pues el investigador y los allegados del paciente pueden pensar que se está privando a este del posible beneficio de una acción que se piensa que puede ser útil, en lugar de dejar al azar la elección del tratamiento que podría privarle de esta acción. Por este motivo, hay que felicitar a los autores del COUPE por intentar llevar a cabo el estudio y publicar sus resultados, a pesar de que probablemente les haya quedado un sabor amargo al decidir su interrupción prematura.
Con respecto a la aproximación invasiva precoz, resulta indiscutible en el momento actual y nunca se ha cuestionado su utilidad para los pacientes recuperados de una PCEH que muestran elevación del segmento ST en el electrocardiograma obtenido al recuperar el latido, aquellos en inestabilidad hemodinámica o los que presentan arritmias ventriculares malignas recurrentes con elevada sospecha de isquemia miocárdica. Esta es la actitud recomendada también para los pacientes que no han sufrido una PCEH. Por lo tanto, no hay ningún motivo que haga pensar que no lo sea también para los pacientes que han sufrido una PCEH, salvo que la proporción de pacientes con mal pronóstico sea mayor. Sin embargo, la duda se mantiene ante pacientes que no reúnen estas características.
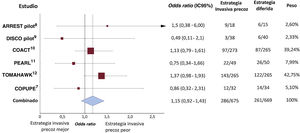
Con los 6 ensayos clínicos realizados hasta ahora y a la espera de la publicación de los que aún están en curso (figura 1), no se justifica una actitud invasiva por sistema para los pacientes que presenten una estabilidad hemodinámica y eléctrica. Incluso en el ensayo TOMAHAWK12, a los 30 días habían fallecido 143 de 265 pacientes (54,0%) del grupo de angiografía inmediata y 122 de 265 pacientes (46,0%) del grupo de angiografía diferida (cociente de riesgo, 1,28; intervalo de confianza del 95%, 1,00-1,63; p=0,06). Este fenómeno puede atribuirse en parte a un mayor deterioro neurológico observado en el grupo de estrategia invasiva, que podría justificarse por el retraso en el empleo de otras estrategias con un efecto beneficioso más consolidado en el tratamiento de estos pacientes, como es el control de la temperatura, que varios ensayos clínicos avalan. La actitud de realizar todas las pruebas diagnósticas lo antes posible para obtener una información pronóstica muy precoz, si no tienen un impacto demostrado en la evolución de los pacientes, no debería demorar los tratamientos con alguna evidencia científica de eficacia. Este es uno de los motivos argumentados para la falta de eficacia en algunos ensayos clínicos recientes sobre el control de la temperatura. Este tratamiento había demostrado su eficacia antes de que se generalizasen la angiografía sistemática y otras pruebas diagnósticas muy precoces, en parte motivada por las guías de práctica clínica4. Uno de los aspectos que ha llamado la atención en el citado estudio TTM-2 es que se trata del ensayo clínico en el que se han realizado más angiografías precoces15; se practicaron angiografías coronarias al 78% de los pacientes, el 90% de las veces en las primeras 2 h de ingreso, y se revascularizó solamente al 39% de los pacientes. Al 67% de los pacientes se les realizó además una tomografía computarizada cerebral, en la mayoría de las ocasiones al ingreso del paciente.
Diagrama de efectos (forest plot) de la mortalidad por cualquier causa a corto plazo de los estudios aleatorizados sobre el efecto de la angiografía precoz sistemática en pacientes en coma recuperados de una parada cardiaca extrahospitalaria sin elevación del segmento ST en el electrocardiograma posterior a la recuperación de la circulación espontánea. IC95%: intervalo de confianza del 95%.
Probablemente en la práctica clínica diaria, la actitud adecuada es dirigir a los pacientes con elevación del segmento ST y/o con inestabilidad eléctrica o hemodinámica a una estrategia invasiva precoz. Mientras que en otras situaciones, con la información actualmente disponible, la actitud más correcta sería iniciar sin dilación las medidas terapéuticas con eficacia demostrada en al menos algún ensayo clínico, y reservar las pruebas diagnósticas a un momento posterior si surge la necesidad o después de constatar la recuperación neurológica16. Además, se debe meditar las decisiones sobre la retirada de las medidas de soporte vital y tenerlas en cuenta después de que haya trascurrido un tiempo suficiente para evitar posibles errores.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESNinguno.