Palabras clave
Introducción
Propionibacterium acnes (PA) es un bacilo anaerobio grampositivo que forma parte de la flora habitual de varias mucosas, incluidas la oral y la intestinal. Coloniza también la piel, donde predomina dentro de los folículos pilosebáceos, especialmente en la cara, el cuero cabelludo y la parte superior del tronco. Es un microorganismo de baja virulencia, y se le había catalogado anteriormente como contaminante de las muestras microbiológicas. Sin embargo, se ha demostrado su implicación en infecciones graves sobre material protésico, como las válvulas cardiacas protésicas y otros dispositivos intracardiacos1-23.
Por tratarse de una bacteria de crecimiento lento, si los hemocultivos o las muestras quirúrgicas no son sometidas a una incubación prolongada, puede no ser aislada6,10,11,13,25; incluso, a veces, su presencia en tejidos sólo puede ser confirmada por técnicas de biología molecular (reacción en cadena de la polimerasa [PCR])11,12.
En la literatura, sólo se han descrito 36 casos de endocarditis infecciosa sobre válvula protésica por Propionibacterium acnes (EIVPPA). La mayoría corresponde a casos aislados o a series mayoritariamente retrospectivas y que no inciden en todos los aspectos de la enfermedad.
En el presente trabajo se describen de forma prospectiva y consecutiva 16 casos de EIVPPA. La mayoría reunía características clínicas, ecocardiográficas, microbiológicas y anatómicas similares, y bastante diferenciadas de las habituales.
Métodos
Se recogieron de forma prospectiva, consecutiva y concurrente 16 casos definitivos de EIVPPA (14 diagnosticados en nuestro centro) entre 1991 y 2006, a través de un cuestionario con variables definidas. Constituyeron el 4,3% de las endocarditis diagnosticadas en nuestro centro en ese periodo. En 9 la endocarditis fue sospechada por el cirujano en el acto quirúrgico y en todos la histología fue compatible con endocarditis y el cultivo, positivo para PA. Con el fin de describir los aspectos evolutivos de la enfermedad los datos se describen agrupados en tres periodos: desde el inicio de los síntomas hasta el diagnóstico, en el ingreso diagnóstico, y hasta finalizar el seguimiento (hasta 5 años; mediana, 3 años).
Procedimientos
Ecocardiográficos: en todos los pacientes se realizó al menos una exploración ecocardiográfica.
Microbiológicos y anatomopatológicos: se obtuvieron al menos 3 hemocultivos, al ingreso, en los casos en que se sospechó endocarditis infecciosa (EI). El aspecto macroscópico de las válvulas fue descrito por el cirujano en el momento del recambio valvular. Las muestras quirúrgicas, prótesis y tejido periprotésico se remitieron a microbiología, donde en condiciones de asepsia fueron valoradas por el patólogo. Las prótesis y una porción de las vegetaciones y del tejido periprotésico se procesaron para cultivo; se realizó trituración en mortero de los tejidos previamente a la incubación. Parte del tejido periprotésico y de las vegetaciones, así como el pannus, se enviaron para estudio histológico. Todos los cultivos realizados en nuestro centro fueron sometidos a larga incubación (30 días).
PCR en tiempo real: se llevó a cabo la detección de ADN del PA por PCR en tiempo real en 11 episodios: en 9 casos se extrajo el ADN de muestras de tejido periprotésico conservado en parafina y en 3 de ADN extraído de tejido en fresco.
Definiciones
Retraso diagnóstico: tiempo transcurrido desde la aparición del primer síntoma hasta el diagnóstico.
Forma de presentación: primeros síntomas y/o signos con los que se presentó el paciente a la primera consulta, sean o no la que corresponde al ingreso.
Resultados
Epidemiología
La media de edad fue 59,4 (intervalo, 41-78) años; 13 pacientes eran varones; 13 se localizaron en prótesis metálicas y 3 en biológicas. El tiempo entre la implantación de la prótesis y la aparición de los síntomas osciló entre 1 semana y 27 años: en 7 pacientes este periodo fue ≤ 1 año y en 9, > 8 años. En el primer grupo, sólo en 1 paciente se detectó una posible puerta de entrada para el PA diferente de la cirugía de sustitución valvular. Sin embargo, en el segundo grupo siempre había un posible factor de riesgo en relación con interrupción de la barrera mucocutánea (tabla 1). Tres pacientes habían tenido EI previa por Streptococcus pneumoniae, Staphylococcus epidermidis y con cultivo negativo, respectivamente.
Clínica
Las formas de presentación clínica (tabla 1) incluyeron: disfunción protésica severa asintomática (31%); insuficiencia cardiaca (19%), síndrome coronario (12.5%); fiebre (25%), asociada a síndrome constitucional (12,5%) y a síntomas neurológicos (12,5%); eventos neurológicos isquémicos repetidos sin fiebre (6,2%), manifestaciones cutáneas (6,2%) (livedo reticularis y lesiones necróticas en pulpejos de los dedos) y manifestaciones reumáticas (6,2%) (artromialgias y tenosinovitis de repetición).
En 8 pacientes la clínica había motivado previamente el ingreso hospitalario sin que se llegara al diagnóstico de EI (mediana de ingresos previos, 1 [1-6]). En 2 pacientes se sustituyó la válvula afectada por sospecha de EI, pero el diagnóstico infeccioso fue descartado aunque las muestras quirúrgicas no se sometieron a larga incubación. Ambos pacientes presentaron dehiscencia valvular periprotésica al poco tiempo del recambio.
Al ingreso diagnóstico tenía insuficiencia cardiaca el 62,5%; fiebre, el 43,7% (2 se habían presentado como disfunción protésica asintomática); nuevo soplo, el 81,2%; disminución de los ruidos protésicos, el 6,2%, y esplenomegalia, el 6,2%. El retraso diagnóstico fue < 1 mes en 3, entre 1 y 12 meses en 9 y > 12 meses en 4 pacientes.
En las recaídas las manifestaciones clínicas fueron, generalmente, semejantes a las que habían tenido en su primer episodio, excepto en el caso 1, que desarrolló inicialmente sintomatología reumática muy florida y, posteriormente, otras manifestaciones periféricas antes de que se llegara al diagnóstico en la primera y la segunda recaída.
Ecocardiografía
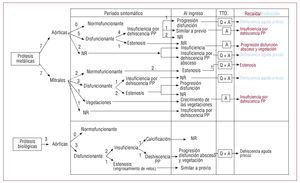
Durante el periodo previo al diagnóstico, se realizaron 14 ecocardiogramas transtorácicos y 4 transesofágicos a 13 pacientes (fig. 1). El 71,4% de las prótesis aórticas metálicas presentaban disfunción, el 57% por dehiscencia y el 14,2% por estenosis. El 42,8% de las prótesis metálicas mitrales eran disfuncionantes: el 28,5% estenóticas y el 14,2% insuficientes; en el 14,2% se detectaron vegetaciones sin disfunción protésica. El 100% de las prótesis aórticas biológicas mostraba disfunción: el 33,3% por dehiscencia, el 66,6% por distorsión de velos: el 33,3% por calcificación que producía insuficiencia y el 33,3% por engrosamiento, con lo que se comportaba como estenótica.
Fig. 1. Hallazgos ecocardiográficos de 16 de endocarditis infecciosas sobre válvula protésica por Propionibacterium acnes a lo largo de su evolución clínica. En la tabla se muestran los hallazgos ecocardiográficos principales en el periodo sintomático, en el momento del diagnóstico y en las recaídas, en los casos en que éstas se produjeron (en rojo). Asimismo se especifican los casos que presentaron dehiscencia protésica precoz en el seguimiento (en azul). En todos estos casos se especifica, asimismo, el tipo de tratamiento que se había realizado. En los demás pacientes se realizó recambio valvular y la exploración ecocardiográfica tras el tratamiento fue normal. A: antibioterapia; NR: ecocardiograma no realizado; PP: periprotésica; Q: tratamiento quirúrgico; TTO: tratamiento.
Al ingreso diagnóstico se repitió el ecocardiograma en 8 pacientes, y se realizó de novo en 3. En el primer grupo se encontró progresión de la disfunción protésica en el 37,5% (1 de ellos con vegetaciones y abscesos); crecimiento de vegetación (12,5%); aparición de nueva disfunción protésica (25%), y ausencia de cambios (25%). En el 100% de los ecocardiogramas realizados de novo se objetivó insuficiencia por dehiscencia periprotésica, en una asociada a absceso.
En la recaída, el 66,6% de los pacientes que no habían sido operados presentaron progresión de la dehiscencia protésica previa y el 33,3%, una dehiscencia nueva. El paciente que recayó tras el recambio valvular presentó la misma disfunción protésica que en el primer episodio (estenosis).
Microbiología
Durante el periodo sintomático previo al diagnóstico, se extrajeron hemocultivos en 2 pacientes. En 1 de ellos se objetivó la presencia de PA en 1 de 6 hemocultivos (tabla 2).
En el ingreso diagnóstico se extrajeron hemocultivos en 7 pacientes; 4 fueron positivos para PA, con un tiempo medio de crecimiento de 11,6 (5-21) días. En 3 fueron estériles: todos ellos estaban recibiendo tratamiento antibiótico. Se obtuvieron muestras quirúrgicas de 13 pacientes. En todas se aisló el PA, con un tiempo de crecimiento medio de 12,2 (5-30) días. En uno de los casos, el PA creció únicamente en el trombo protésico, que se cultivó de manera paralela a la prótesis.
Las 4 recaídas estuvieron microbiológicamente documentadas. En 2 los hemocultivos fueron positivos para PA y en 2 lo fueron las muestras quirúrgicas.
La PCR en tiempo real no detectó la presencia de ADN de PA en ninguna de las muestras conservadas en parafina. Sin embargo, fue positiva en los 2 casos realizados con muestras en fresco, aunque no en todos los fragmentos.
Tratamiento y evolución
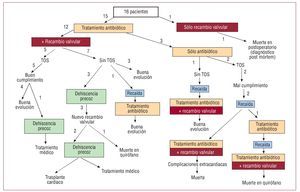
Inicialmente, el 18,7% de los pacientes recibieron sólo tratamiento antibiótico y el 75%, antibioterapia más cirugía. Uno recibió únicamente cirugía, ya que el diagnóstico se hizo post mórtem (fig. 2).
Fig. 2. Tratamiento y evolución en 16 casos de endocarditis infecciosa sobre válvula protésica por Propionibacterium acnes. TOS: tratamiento oral supresor.
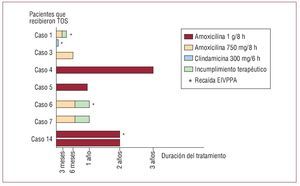
Los antibióticos utilizados fueron penicilinas (40%), cefalosporinas de tercera generación (26,6%), vancomicina en monoterapia (6,6%) o en combinación con aminoglucósidos (20%) u otros antibióticos (6,6%). La duración del tratamiento parenteral fue ≥ 6 semanas. Se prescribió además tratamiento oral supresor (TOS) con amoxicilina en 2 pacientes que no habían sido operados, y en 5 en los que la limpieza quirúrgica fue incompleta o la antibioterapia no se había iniciado inmediatamente después de la sustitución valvular (fig. 3).
Fig. 3. Duración y cumplimiento del tratamiento oral supresor (TOS) en 16 casos de endocarditis infecciosa sobre válvula protésica por Propionibacterium acnes.
El 58,3% de los pacientes que recibieron tratamiento combinado evolucionaron favorablemente, el 8,3% recayó, y el 33,3% presentó dehiscencia precoz (uno finalmente precisó trasplante cardiaco). El 100% de los pacientes que inicialmente sólo habían recibido antibioterapia finalmente fueron intervenidos por recaída (fig. 2). En 1 paciente se desarrolló insuficiencia renal progresiva con anticuerpos anticardiolipínicos positivos y biopsia inespecífica, y precisó diálisis.
La mortalidad relacionada con la endocarditis fue de un 18,7%.
Anatomía patológica
Macroscópicamente, los hallazgos más frecuentes fueron abundante pannus grisáceo friable (43,7%) y la desinserción de la prótesis o dehiscencia de las suturas (31,2%). Otros que destacar fueron: seudoendotelización parcial de la prótesis, signos inflamatorios y trombo de aspecto antiguo. Las vegetaciones (7%) y los abscesos (7%) fueron infrecuentes.
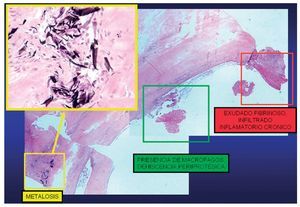
Histológicamente se objetivó: granuloma de cuerpo extraño (71,4%), exudado fibrinoso (57,1%), trombos en distintas fases de organización (42,8%), signos inflamatorios crónicos (35,7%), signos de actividad aguda (14,3%), sutura no organizada (21,4%), depósitos de calcio (21,4%) y neoangiogénesis (14,3%). En ninguna de las muestras se observaron colonias bacterianas. En 2 casos se observó metalosis (fig. 4).
Fig. 4. Detalle histológico de sección de tejido periprotésico de EIVPPA con tinción hematoxilinaeosina.
Discusión
En la literatura se ha relacionado, mayoritariamente, como factor de riesgo para la EIVPPA la cirugía cardiaca previa2,5,6,22, y únicamente hay tres reportes aislados que la relacionan con una puerta de entrada cutánea9,10,23. Nuestro estudio indica que en la endocarditis precoz (< 1 año de la cirugía) el factor de riesgo es la cirugía cardiaca previa, mientras que en la tardía es la manipulación mucocutánea. Además ponemos de manifiesto que el tiempo transcurrido entre la manipulación y el inicio de los síntomas puede ser muy largo, por lo que ésta puede pasar inadvertida.
El retraso diagnóstico fue mayor que el habitual en las endocarditis protésicas, algo descrito en otras publicaciones1,5,20,23,24, aunque en nuestra serie fue incluso superior. La aparición de fiebre fue también menos frecuente, tanto en este estudio como en los casos publicados, aunque fue menor en el nuestro. La manifestación más frecuente fue la disfunción protésica progresiva (93%), acompañada de insuficiencia cardiaca (62%) con porcentajes mayores que los reseñados (el 82 y el 36% respectivamente)1,2,4-6,8,10-13,16,23,25. La proporción de síntomas neurológicos publicada es mayor que en esta serie (el 38 frente al 26%), pero en ambos casos superior a la incidencia general de complicaciones neurológicas de las endocarditis protésicas (20%). Los datos clínicos discordantes encontrados entre nuestra serie y la literatura parecen deberse a que nuestra metodología ha permitido identificar las endocarditis con menor sintomatología infecciosa. La sospecha del cirujano cardiaco en el momento del recambio tuvo un papel fundamental. Otros autores también han recogido esta apreciación16,23.
Otra característica importante fue la presencia de síntomas relacionados con inmunocomplejos circulantes, como mialgias locales, artritis aséptica, tenosinovitis, lesiones necróticas cutáneas, livedo reticularis o insuficiencia renal progresiva. Existen tres publicaciones de endocarditis por PA en las que se describen manifestaciones inmunológicas, como una glomerulonefritis que precisó corticoides a altas dosis para la curación20,21,24. Es probable que parte de la fisiopatología de la enfermedad esté relacionada con fenómenos inmunológicos inflamatorios, como ya se ha descrito en otras infecciones producidas por PA como el acné26 o las endoftalmitis, en las que siempre se necesita asociar corticoides para la curación27.
También el síndrome inflamatorio SAPHO (sinovitis, acné, periostitis, hiperostosis, osteítis) se ha relacionado con la infección por PA28.
Las recaídas tardías fueron otra característica reseñable, por lo que parece recomendable un seguimiento estrecho no inferior a 2 años, especialmente en los pacientes que no sean intervenidos. Hay escasos datos en la literatura al respecto, pero en un caso el paciente tuvo 4 episodios en 4 años2,10,17.
La expresión ecocardiográfica más frecuente fue la disfunción protésica por dehiscencia periprotésica, casi siempre sin abscesos o seudoaneurismas. También la disfunción protésica es el dato predominante en las EIVPPA descritas1,2,4-6,8,10-14,23,25, aunque la frecuencia de vegetaciones o abscesos es mayor que en el presente trabajo, hecho explicable por las diferencias metodológicas. Nuestro estudio muestra, además, que la exploración ecocardiográfica inicial puede ser normal, y la disfunción puede desarrollarse lentamente. Por ello, si hay datos clínicos que lo indiquen como embolias neurológicas repetidas con rango de anticoagulación adecuado o hemocultivos positivos para PA, debe hacerse un seguimiento clínico y ecocardiográfico para descartar la enfermedad.
Nuestros datos y otros publicados4,13,18 muestran que los hemocultivos deben incubarse al menos 3 semanas y las muestras quirúrgicas hasta 30 días para no infradiagnosticar la EIVPPA. El cultivo de las muestras quirúrgicas mostró un mayor rendimiento que los hemocultivos. El procesamiento de los cultivos utilizando trituración en mortero de los tejidos, como en nuestro centro, o la sonicación de las prótesis aumentan el rendimiento del cultivo en infecciones protésicas y debe ser recomendado29. La utilización de cultivo en anaerobiosis, en catéteres intravasculares, aumenta la detección del PA30. La presencia del PA puede ser subestimada si no se utilizan estas técnicas de procesamiento.
La antibioterapia seguida de cirugía de recambio valvular curó a la mayoría de los pacientes. Sin embargo, el tratamiento antibiótico aislado sirvió para controlar los síntomas, pero no consiguió casi nunca eliminar la infección. El hecho de que un correcto tratamiento antibiótico no sea suficiente para conseguir la curación indica la participación de la biocapa. No obstante, el tratamiento oral supresor podría ser de utilidad en pacientes en los que la cirugía esté contraindicada o en los que el material protésico no ha sido completamente retirado, aunque su duración no está bien establecida. Se han decrito 2 casos que evolucionaron favorablemente con TOS, pero el seguimiento fue tan sólo de 12 y 18 meses respectivamente14,19. La alta tasa de dehiscencia protésica precoz que se encontró es inusual en nuestro centro. La causa no pudo ser identificada, ya que los cultivos fueron negativos y la histología fue inespecífica. No se puede evitar la sospecha de que todas o al menos parte de ellas hayan sido EIVPPA con bajo inóculo. Recientemente se ha descrito un caso de dehiscencia protésica aguda como manifestación clínica de EIVPPA13. Asimismo, en la literatura está ampliamente descrito el aflojamiento protésico (en ortopedia) en relación con infecciones subclínicas por PA31.
La mortalidad se encontró dentro del rango descrito en la literatura (13-27%)11,17.
La apariencia macroscópica de las prótesis cardiacas infectadas por PA no ha sido descrita con detalle en la literatura16,23. Nuestros datos indican que la presencia de un pannus de aspecto friable y grisáceo, con o sin seudoendotelización parcial de la prótesis, debería alertar, sobre todo en los casos de disfunción valvular, y hacer descartar la EIVPPA.
Los hallazgos histológicos de las EIVPPA, no descritos previamente en la literatura, mostraron datos compatibles con una infección crónica. Fue particularmente llamativa la presencia de tejido de granulación, también descrito en EI nativas por PA32 e infecciones de prótesis articulares33; es interesante mencionar que, en los últimos años, se han publicado numerosos trabajos que relacionan la sarcoidosis con la presencia de PA34. La metalosis en el tejido periprotésico, presente en dos de nuestros casos, se ha relacionado con desinserciones protésicas en ortopedia por mecanismos inmunológicos35 o en respuesta a infección subyacente36. Asimismo, podría tener un papel la liberación por parte del PA de ácido propiónico, ya que éste puede ser corrosivo para los metales.
El comportamiento clínico de las EIVPPA puede ser consecuencia de diferentes propiedades del PA, como son su baja virulencia o su capacidad para producir biocapa. Las bacterias sesiles, inmersas en la biocapa, estimularían a los macrófagos; éstos son incapaces de fagocitarlas, pero liberan enzimas que lesionarían el tejido del huésped, ocasionando la dehiscencia periprotésica. Por otro lado, estaría justificada la baja frecuencia de síntomas infecciosos, sólo presentes cuando son liberadas a la circulación grupos de bacterias en su forma planctónica. Además, la presencia de biocapa también puede justificar que los cultivos habituales de las prótesis cardiacas no identifiquen la presencia del PA, al no conseguir el crecimiento de las bacterias sesiles embebidas en ella, salvo que los tejidos sean triturados o las prótesis sean sonicadas, y ambos casos se mantengan en larga incubación. Ha sido demostrada la capacidad del PA de formar biocapa sobre distintos biomateriales (prótesis articulares33 o catéteres37) y también in vitro sobre prótesis valvulares38, pero hasta la fecha no existen referencias en la literatura sobre la demostración de la biocapa en prótesis valvulares cardiacas infectadas in vivo por este microorganismo.
Conclusiones
La EIVPPA es una enfermedad que se adquiere durante la cirugía cardiaca o como consecuencia de bacteriemias de origen mucocutáneo. Muestra un curso clínico lentamente progresivo, con escasos signos infecciosos, entre los que predominan los cardiacos, secundarios a disfunción valvular, y los neurológicos. Esto puede motivar que muchas EIVPPA pasen inadvertidas y que la incidencia real esté subestimada. Ecocardiográficamente, rara vez muestra vegetaciones o abscesos, manifestándose fundamentalmente como dehiscencia o trombosis protésica. Para su detección puede ser necesaria la incubación prolongada de los cultivos. La PCR en tiempo real puede ser un arma diagnóstica útil, con resultados prometedores sobre muestras de tejido en fresco. El aspecto histológico es compatible con infección crónica. El tratamiento antibiótico suprime fácilmente el microorganismo, pero no lo elimina, por lo que la retirada del material protésico es necesaria para su curación. La evolución puede complicarse con dehiscencia protésica no infecciosa, a pesar del tratamiento correcto. Es necesaria una estrecha colaboración entre el clínico, el microbiólogo, el cirujano y el patólogo para interpretar correctamente todos los datos según el contexto clínico y no infradiagnosticar las EIVPPA.
Agradecimientos
Nuestro agradecimiento al Dr. R. Velayos, a la Dra. I. Mate, al Dr. Pintado y al Dr. Cereizo, por permitir la publicación de los datos de dos pacientes.
ABREVIATURAS
EI: endocarditis infecciosa.
EIVPPA: endocarditis infecciosa sobre válvula protésica por Propionibacterium acnes.
PA: Propionibacterium acnes.
PCR: reacción en cadena de la polimerasa.
TOS: tratamiento oral supresor.
Full English text available from: www.revespcardiol.org
Correspondencia: Dra. L. Guío Carrión.
Servicio de Medicina Interna-Infecciosas. Hospital de La Princesa. Diego de León, 62. 28006 Madrid. España.
Correo electrónico: lauraguio@hotmail.com
Recibido el 12 de febrero de 2008.
Aceptado para su publicación el 6 de noviembre de 2008.