No hay duda de que la muerte súbita cardiaca (MSC) y las arritmias ventriculares (AV) se encuentran entre los eventos más desoladores que afectan a los pacientes cardiovasculares, a sus familias e, incluso, a la población en general. La MSC preocupa a la mayoría de los médicos que se ocupan de la estratificación del riesgo de los pacientes, en un ámbito lleno de incertidumbres, pero con consecuencias muy graves por lo que respecta a las acciones que deben adoptarse y al pronóstico clínico. En las últimas décadas, la comunidad científica ha reconocido que se trata de un área de investigación prioritaria, por lo que se ha acelerado la obtención de nuevos datos, nuevas tecnologías y nuevos modelos de estratificación, entre otros. Mensualmente e, incluso, a diario hay nuevos datos disponibles para su análisis. La consecuencia es que algunos ensayos de distribución aleatoria que generan nueva evidencia1, pero publicados de manera casi simultánea, por desgracia no se han abordado en la nueva edición de las guías de práctica clínica de la Sociedad Europea de Cardiología (ESC) sobre el tratamiento de pacientes con AV y la prevención de la MSC2, que hace nuevas recomendaciones que claramente mejorarán la atención de los pacientes en riesgo. El presente comentario editorial tiene como objetivo destacar las innovaciones y novedades más relevantes presentadas en la nueva guía de práctica clínica1.
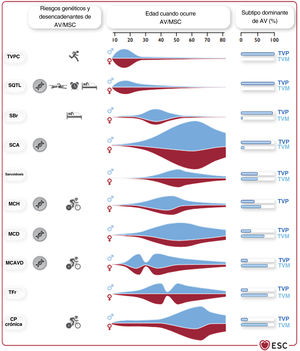
ASPECTOS GENERALES Y EVALUACIÓN CLÍNICASiguiendo el enfoque centrado en el paciente propuesto por la ESC, la guía de práctica clínica refuerza la importancia de los equipos multidisciplinares y los centros especializados para la evaluación del paciente y las técnicas intervencionistas (es decir, ablación mediante catéter, dispositivos de asistencia circulatoria mecánica y soporte de la cirugía cardiotorácica). La contextualización también está bien impulsada en la presente guía. Dado que la mitad de las MSC ocurre como una primera manifestación y la etiología puede variar dependiendo de muchos factores, hay una figura central (figura 1) que refleja el riesgo genético, los principales desencadenantes, la edad de inicio clínico y los subtipos dominantes de AV. El documento reconoce el bajo índice de supervivencia después de un paro cardiaco extrahospitalario. Por primera vez, hay recomendaciones formales claras para las acciones comunitarias: a) la promoción de la formación comunitaria en soporte vital básico (clase I); b) la recomendación de la reanimación cardiopulmonar sin demora por parte de los testigos de un paro cardiaco extrahospitalario (clase I); c) la disponibilidad de acceso adecuado a un desfibrilador externo automatizado en lugares donde es más probable que se produzca un paro cardiaco (clase I), y d) la existencia de alertas a través del teléfono móvil para ayudar a las víctimas cercanas (clase IIa).
Riesgo genético de AV/MSC, desencadenantes habituales de AV/MSC, edad en el momento de la presentación de AV/MSC, predominio por sexos y AV típicas (TVP/FV frente a TVM) en varias enfermedades asociadas con AV/MSC. AV, arritmia ventricular; CP, coronariopatía; FV, fibrilación ventricular; MCAVD, miocardiopatía arritmógena del ventrículo derecho; MCD, miocardiopatía dilatada; MCH, miocardiopatía hipertrófica; MSC, muerte súbita cardiaca; SBr, síndrome de Brugada; SCA, síndrome coronario agudo; SQTL, síndrome de segmento QT largo; TFr, tetralogía de Fallot reparada; TVM, taquicardia ventricular monomorfa; TVP, taquicardia ventricular polimórfica; TVPC, taquicardia ventricular polimórfica catecolaminérgica. Reproducido con autorización de Zeppenfeld et al.2.
Para la evaluación del paciente, las técnicas avanzadas de diagnóstico por la imagen, entre las cuales se encuentran la evaluación ecocardiográfica de la deformación miocárdica y la resonancia magnética cardiaca (RMC), desempeñan un papel destacado, con diferentes técnicas para estudiar la cardiopatía estructural. El realce tardío de gadolinio se ha promovido como una herramienta importante para el diagnóstico, la estratificación del riesgo e, incluso, como soporte de las intervenciones terapéuticas (es decir, la ablación de taquicardia ventricular [TV]). Las pruebas de provocación también se han revisado con algunas novedades relevantes. Por ejemplo, un diagrama práctico muestra recomendaciones para el control prolongado de pacientes a los cuales se les han realizado pruebas farmacológicas/de provocación dependiendo de la positividad del resultado y el fármaco concreto utilizado para la prueba. En nuestro medio, la mayoría de las pruebas de flecainida se realizan en las consultas externas o durante la hospitalización ambulatoria. Sin embargo, la guía recomienda un seguimiento de 24 horas para pruebas de flecainida con resultados positivos, lo que podría requerir un cambio de protocolos ordinarios en muchos hospitales. Una posible alternativa sería disponer de ajmalina en España, que necesita un periodo de seguimiento mucho más corto si el resultado es positivo. Esto último requeriría nuevamente que las autoridades sanitarias lo hicieran posible, pero los médicos son responsables de solicitarlo en función de las nuevas recomendaciones.
Los autores han incluido una sección independiente sobre pruebas genéticas. Se recomienda utilizar la secuenciación de nueva generación con series grandes. Sin embargo, en el diagnóstico ordinario, estas series no deben incluir solo genes candidatos con una clara asociación con la enfermedad estudiada y genes no cuestionables. La interpretación de los resultados es fundamental y no hay datos que respalden el beneficio de los programas de detección masiva en la población general. El grupo de trabajo también señala que las pruebas genéticas y clínicas deben realizarse solo por equipos multidisciplinares con experiencia (clase I). Este aspecto podría representar un problema en entornos distintos de las unidades multidisciplinares. La creciente prevalencia de estas enfermedades dificulta la derivación de todos estos pacientes a centros especializados y, por tanto, se requiere una red para una interacción factible y realista entre los niveles de atención médica (local, regional, nacional e internacional).
Otro enfoque novedoso se basa en la organización en torno a 5 escenarios que clasifican el modo de presentación clínica. Estos escenarios son muy útiles e ilustrativos, y se organizan en a) hallazgo incidental de una taquicardia ventricular no sostenida (TVNS); b) primera presentación de taquicardia ventricular monomorfa sostenida (TVMS); c) superviviente de paro cardiaco repentino; d) víctima de MSC, y e) familiares de pacientes no supervivientes del síndrome de muerte arrítmica súbita. En todos ellos se destaca la importancia de los antecedentes familiares. Además, la RMC y las pruebas genéticas ganan protagonismo. El papel de la coronariografía urgente se aborda ampliamente, con la conclusión de que, después de varios ensayos aleatorizados de control (1 proporcionado por investigadores españoles3), no aporta ningún beneficio en el síndrome coronario agudo sin elevación del segmento ST. Sin embargo, se respalda una recomendación de clase I en pacientes con inestabilidad eléctrica, en quienes se sospecha isquemia miocárdica persistente. La coronariografía puede complementarse con la provocación con un fármaco para diagnosticar la angina vasoespástica, pero, aunque esta es una técnica cada vez más aceptada en nuestro entorno, se le ha asignado solo una recomendación de clase IIb. En el caso de pacientes no supervivientes de MSC, se hace hincapié en el importante papel de una autopsia integral, que incluya la toma de una muestra de sangre/tejido para la extracción de ADN y las pruebas genéticas si los resultados de la autopsia y las pruebas toxicológicas son negativas (clase I). Trasladar esa recomendación a nuestro entorno es un reto que debe abordarse, ya que solo una minoría del territorio español se adhiere a las recomendaciones de las guías de práctica clínica sobre autopsia molecular en pacientes no supervivientes de MSC. Esto significa que cada comunidad autónoma de España debe organizar una red de centros de referencia para el estudio macroscópico, microscópico y molecular de los corazones y coordinar estos centros con unidades de cardiopatía hereditaria. Al mismo tiempo, se deben establecer vínculos de cooperación estables entre los departamentos de justicia (a cargo de peritos y médicos forenses), las administraciones sanitarias y los médicos.
TRATAMIENTO AGUDO DE ARRITMIAS VENTRICULARESEl tratamiento agudo se describe mejor en la nueva guía. Existe una nueva recomendación para la supresión inmediata de la TVMS, incluso si se tolera bien, ya que puede producirse un rápido deterioro hemodinámico (clase I). El ensayo PROCAMIO4, realizado en nuestro entorno por Ortiz M et al., ha aportado evidencia de nuevas recomendaciones sólidas para tratar la TVMS tolerada hemodinámicamente. Si se desconoce la etiología, se recomienda la procainamida intravenosa antes que la amiodarona (clase IIa frente a IIb), con la excepción de aquellos pacientes con insuficiencia cardiaca grave, infarto agudo de miocardio o enfermedad renal terminal. Además, los pacientes que se presentan con tormenta arrítmica se abordan de manera considerable en las guías de práctica clínica, que presentan un algoritmo muy práctico. La sedación superficial o media está indicada como tratamiento de primera línea para calmar la angustia psicológica y disminuir el tono simpático proarritmógeno (clase I). Respecto al tratamiento farmacológico, los bloqueadores beta no selectivos y, específicamente, el propranolol (más eficaz que el metoprolol), reciben gran atención en combinación con la amiodarona como tratamiento de primera línea. El landiolol, un nuevo bloqueador selectivo beta 1 de acción ultracorta, se propone cuando la TV es refractaria a la amiodarona, pero no está comercializado en España. Siguiendo en esta dirección, la ablación de TV es muy recomendable (clase I) en pacientes con tormenta arrítmica que no responden a fármacos antiarrítmicos (FAA) y, probablemente, sedación superficial/media también. Se recomienda la sedación profunda, pero, curiosamente, con una clase inferior (clase IIa) que la ablación de TV. Los documentos luego tratan sobre cómo deben continuar los médicos e indican la ablación de TV antes del paso a la sedación profunda y la ventilación mecánica, según la clase más fuerte de recomendación para la ablación de TV. Esto último está respaldado por estudios que demuestran control del ritmo, supervivencia y resultados clínicos mejores con técnicas intervencionistas electrofisiológicas realizadas en centros experimentados. También debe valorarse en pacientes con episodios recurrentes de TV polimórfica/fibrilación ventricular (FV) desencadenados por un complejo ventricular prematuro (CVP) similar, que no responde al tratamiento médico o a la revascularización coronaria (clase IIa). La modulación autónoma es una alternativa novedosa que también recibe una atención considerable en la práctica clínica, pero la evidencia sobre su eficacia no es concluyente. La asistencia circulatoria mecánica se puede valorar en el tratamiento de la tormenta arrítmica y el shock cardiogénico refractarios a los medicamentos, cuando el tratamiento convencional falla, y para ofrecer asistencia circulatoria durante la ablación (clase IIb).
TRATAMIENTO A LARGO PLAZOA largo plazo, las recomendaciones generales para la prevención secundaria se mantienen prácticamente sin cambios. A pesar de ello, algunas novedades que podrían tener un impacto clínico importante se tratarán más adelante (véanse comentarios sobre cardiopatías estructurales específicas). La selección de un cardioversor-desfibrilador implantable (CDI) en prevención primaria se comenta en otra parte. Esta edición destaca la importancia de una evaluación adecuada antes del implante (y en el momento del cambio de generador), con especial atención a la esperanza de vida, la calidad de vida y las comorbilidades, ya que afectan a los beneficios y riesgos esperados. El documento hace hincapié en el hecho de que la decisión final sobre el implante debe ser el resultado de un proceso de decisión conjunta. Se recomienda la evaluación del estado psicológico y el tratamiento, si es necesario, de todos los pacientes (clase I). El análisis de los problemas relacionados con la gestión de los dispositivos al final de su vida útil también recibe una indicación de clase I. No hay nuevas recomendaciones en pacientes con miocardiopatía isquémica y disfunción sistólica grave al contrario de lo que ocurría en las guías de práctica clínica anteriores. Por desgracia, el implante de un CDI en pacientes con miocardiopatía no isquémica y disfunción sistólica del ventrículo izquierdo continúa siendo controvertido. En general, se recomienda el implante de un CDI cuando la fracción de eyección del ventrículo izquierdo (FEVI) es inferior al 35% en pacientes con clase II de la New York Heart Association (al menos, evitando la clase IV). Sin embargo, los resultados negativos del ensayo DANISH continúan alimentando el debate, a pesar del beneficio comprobado de supervivencia en pacientes menores de 70 años5. Se presenta una imagen completamente diferente en las guías de práctica clínica cuando se trata de miocardiopatía dilatada y miocardiopatía hipocinética no dilatada secundaria a etiología hereditaria, inflamatoria, infiltrante o neuromuscular (véanse comentarios sobre cardiopatías estructurales específicas).
La programación de un CDI desempeña un papel relevante en las guías de práctica clínica, donde se hace hincapié en los beneficios clínicos de tiempos de detección más largos (8-12 s; 30 latidos), valores de corte de tasas más altos (188 frente a 200 lpm) e intervalos más largos para los discriminadores de ritmos supraventriculares (hasta 230 lpm), que en conjunto ayudan a reducir los tratamientos adecuados e inadecuados con relevancia para la morbilidad y la mortalidad. Uno de los aspectos novedosos de las guías de práctica clínica hace referencia al tratamiento concomitante (ajuste de bloqueadores beta) para evitar tratamientos inadecuados o tratamiento invasivo para la prevención del tratamiento inadecuado de un CDI (la ablación mediante catéter recibe una indicación de clase I en pacientes con taquicardia supraventricular recurrente y fibrilación auricular que redunda en tratamientos inadecuados). También se comentan tecnologías más recientes. Respecto a los CDI subcutáneos, las nuevas guías de práctica clínica incorporan datos relevantes que confirman la ausencia de inferioridad en comparación con los CDI transvenosos (en pacientes sin necesidad de estimulación por bradicardia, electroestimulación antitaquicárdica o resincronización). Sin embargo, las indicaciones en su mayoría se mantienen sin cambios. En general, se observa la misma imagen con desfibriladores cardiacos portátiles. El hecho de que estos dispositivos no pudieran mejorar la supervivencia en la fase temprana después del infarto de miocardio impidió cualquier nueva versión de las indicaciones. Aunque este es probablemente el escenario más interesante, no se puede recomendar su uso frecuente, pero se puede valorar en pacientes seleccionados (clase IIb). Sin embargo, la indicación para los pacientes que necesitan protección temporal se consolida (es decir, después de la extracción del CDI a causa de una infección, recomendación de clase IIa).
COMENTARIOS SOBRE CARDIOPATÍAS ESTRUCTURALES ESPECÍFICASSíndromes coronarios agudosLa reperfusión urgente es el tratamiento más importante para la prevención de AV en el infarto de miocardio con elevación del segmento ST. También se recomienda el tratamiento con bloqueadores beta para prevenir AV antes de la revascularización (clase I). Se debe tener en cuenta que la amiodarona intravenosa inhibe de forma aguda AV relevantes hemodinámicamente recurrentes (clase IIa), aunque la evidencia en este entorno se extrapola principalmente de los estudios de paro cardiaco extrahospitalario. La lidocaína tiene una recomendación de clase IIb, que debe valorarse solo si el tratamiento con bloqueadores beta y amiodarona no es efectivo después de la revascularización. El impacto de las AV que se producen después de la reperfusión (> 48 horas) en la futura MSC no está tan claro. La aparición de AV tardías después de la reperfusión se asoció con la mortalidad por cualquier causa a largo plazo, mientras que la AV que se produjo poco tiempo después de la reperfusión no se asoció con ningún pronóstico a 5 años. Se necesitan más estudios para aclarar el impacto de las AV que se producen>48horas después del infarto de miocardio con elevación del segmento ST en la MSC tardía en pacientes contemporáneos tratados con ICP aguda. Estas guías de práctica clínica mencionan supervivientes de paro cardiaco repentino con espasmo de la arteria coronaria, en quienes se debe valorar el implante de un CDI (clase IIa) ya que es posible que la intervención médica y los numerosos medicamentos no sean lo suficientemente protectores. La evidencia limitada sugiere que la estratificación del riesgo invasivo por electroestimulación programada en la fase temprana posterior al infarto de miocardio puede ser útil para la identificación de pacientes de alto riesgo con FEVI reducida (clase IIb), pero se aportará nueva evidencia en un futuro próximo.
Síndromes coronarios crónicosHay algunos cambios importantes respecto a los pacientes con coronariopatía crónica. En primer lugar, se ha eliminado el papel de la electroestimulación programada para probar la inducibilidad de la TV. En cambio, su uso se ha actualizado a clase I en pacientes con a) infarto de miocardio previo y síncope inexplicable, y b) TVNS y FEVI entre el 36 y el 40%. En segundo lugar, las nuevas guías de práctica clínica también han actualizado algunas indicaciones del CDI en la prevención primaria que eran una práctica muy extendida, pero que no se habían reflejado en la versión anterior. Uno de los temas más novedosos y relevantes que impacta directamente en la práctica actual hace referencia a un subconjunto especial de pacientes de prevención secundaria, aquellos con TVMS tolerada hemodinámicamente que no presentan una FEVI gravemente deteriorada (≥ 40%). La falta de mejora de la supervivencia que presentan los CDI en este contexto y la posible abolición de la TVMS con ablación mediante catéter abre la posibilidad de detener los CDI en esos casos (clase IIa) si la ablación mediante catéter tiene éxito (es decir, TV no inducible y eliminación de los electrogramas anormales). Para el resto de los pacientes con TVMS, se recomienda un CDI (clase I). Uno de los temas más esperados por muchos lectores es la forma en que las guías de práctica clínica abordan la nueva evidencia respecto al valor que ofrecen las intervenciones de ablación de TV en la fase crónica de los pacientes isquémicos. Si bien su uso se ha reducido a clase IIb como tratamiento preventivo después del primer episodio en personas sin CDI, existen nuevas recomendaciones para pacientes con TVMS recurrente a pesar del uso crónico de amiodarona (clase I) o como tratamiento de primera línea (clase IIa). Sin embargo, un estudio reciente publicado por Arenal et al.5 defiende el uso de la ablación mediante catéter antes de administrar FAA para la TVMS en pacientes con cardiopatía isquémica, que ofrece mejores resultados clínicos en el resultado combinado de TV recurrente, rehospitalización y muerte. Este estudio, realizado por investigadores españoles, lamentablemente no se incorporó a las guías de práctica clínica, ya que se publicó poco antes de la publicación de aquellas. Probablemente, las recomendaciones futuras deben dar respaldar de manera más sólida la ablación de TV de pacientes con cardiopatía isquémica.
Complejos ventriculares prematuros idiopáticosEl grupo de trabajo ha ampliado considerablemente la sección sobre CVP idiopáticos y ha aportado numerosas recomendaciones nuevas. Las guías de práctica clínica hacen hincapié en la importancia de excluir la cardiopatía estructural subyacente en pacientes con CVP y nuevamente fomentan el uso de la RMC en el caso de formas atípicas de presentación (p. ej., edad avanzada, morfología de bloqueo de rama derecha, posible reentrada) o de pruebas iniciales no concluyentes (nueva recomendación, clase IIa, nivel C). Las decisiones se basan en síntomas o deterioro de la función cardiaca. Las opciones de tratamiento se diferencian según el origen del CVP. La ablación mediante catéter es la opción preferida para los CVP que se originan en el tracto de salida del ventrículo derecho o los fascículos del ventrículo izquierdo, mientras que los bloqueadores beta (clase I) y los antagonistas del calcio son la primera opción para el resto de los casos (clase I). Las guías de práctica clínica aluden al bajo riesgo de presentar disfunción ventricular en el caso de pacientes asintomáticos con una alta carga de CVP y resaltan el umbral de CVP>10% para provocar miocardiopatía, por lo que solo en estos casos recomiendan un seguimiento regular. Además, se puede valorar la ablación mediante catéter en pacientes seleccionados con>20% de CVP (clase IIb). Dada su potencial reversibilidad, la guía también subraya la importancia de sospechar y reconocer la miocardiopatía inducida por CVP en pacientes con carga de CVP>10% y deterioro de la función cardiaca (clase IIa) y nuevamente hacen hincapié en el papel de la RMC (clase IIa). En este contexto, el papel de la ablación mediante catéter se ha actualizado a clase I y es la opción preferida frente a los FAA. En pacientes con alta carga de CVP y cardiopatía estructural agravada (clase IIa) o que no responden al tratamiento de resincronización cardiaca (clase IIa), tanto la ablación mediante catéter como la amiodarona son opciones razonables.
MiocardiopatíasDe especial interés es la base genética de las miocardiopatías dilatadas y arritmógenas y su relación con el pronóstico más allá de la FEVI. Es notable que en casi la mitad de los pacientes con miocardiopatía dilatada aparentemente idiopática hay una etiología genética subyacente que puede identificarse fácilmente. Esto es importante si se tiene en cuenta los diversos pronósticos en función del subtipo genético6. Al margen del mal pronóstico arrítmico ya conocido de los portadores de la mutación FLNC. se han añadido algunas otras dianas genéticas con mayor susceptibilidad a la MSC en presencia de FEVI no muy reducida, como FLNC, RBM20 y PLN, a pesar de que faltan otros genes de alto riesgo arrítmico (p. ej., genes desmosómicos). Dada la conocida superposición entre miocardiopatías dilatadas y arritmógenas, estas nuevas recomendaciones para un enfoque genéticamente adaptado se aplican cuando se detecta una mutación patógena en estos genes, independientemente del fenotipo observado. En el caso específico de portadores de la mutación LMNA/C, se ha incorporado una calculadora de riesgo, que tiene en cuenta algunos marcadores de riesgo, como sexo masculino, TVNS y FEVI ligeramente alterada. Además, se han añadido otros factores de riesgo para los LMNA/C, RBM20 y PLN mencionados anteriormente, como síncope, realce tardío de gadolinio (RTG) e inducibilidad de TV, en presencia de FEVI del 36 al 50%. Asimismo, con los fenotipos típicos de miocardiopatía arritmógena, existe consenso en que, en los casos con síncope inexplicable o cardiopatía estructural avanzada con afectación derecha, izquierda o biventricular, se debe valorar un CDI. En general, el espectro de variables clínicas que influyen en la estratificación del riesgo se ha ampliado con diferencias entre las etiologías resumidas en la tabla 1.
Marcadores de riesgo de muerte súbita cardiaca en miocardiopatías
| MCD | MCA | MCH | MCR | MCNC | Distrofia miotónica | |
|---|---|---|---|---|---|---|
| RTG | +++ | ++ | ++ | + | + | + |
| Genéticaa | +++ | ++ | + | - | + | - |
| TVNS | ++ | ++ | +++ | - | - | + |
| Síncope | ++ | +++ | +++ | - | - | ++ |
| EEP | + | + | + | - | - | ++b |
| Bloqueo AV | ++ | - | - | - | - | ++ |
| Sexo masculino | ++ | ++ | - | - | - | + |
–, sin relación;+, débil;++, fuerte;+++, muy fuerte; AV, auriculoventricular; EEP, electroestimulación programada; MCA, miocardiopatía arritmógena; MCD, miocardiopatía dilatada; MCH, miocardiopatía hipertrófica; MCNC, miocardiopatía no compacta; MR, miocardiopatía restrictiva; RTG, realce tardío de gadolinio; TVNS, taquicardia ventricular no sostenida.
En el caso de la miocardiopatía hipertrófica (MCH), la clásica calculadora de estratificación de riesgo continúa siendo válida en la guía actual, con una consideración especial en aquellos casos en la «zona gris» con un riesgo a 5 años de MSC entre el 4 y el 6%. La RMC puede ayudar a inclinar la balanza hacia un alto riesgo en pacientes con una proporción de RTG>15%. Curiosamente, por primera vez, la existencia de una mutación sarcomérica se considera un factor adicional que debe tenerse en cuenta en estos casos dudosos. Sin embargo, no se mencionan los diversos genes sarcoméricos o mutaciones específicas, por lo que este consejo parece algo incompleto. En las formas menores de miocardiopatía, como las enfermedades no compactadas, restrictivas o neuromusculares, la falta de evidencia solo permite hacer recomendaciones generales a partir del consenso de los expertos.
Cardiopatías inflamatorias, valvulares y congénitasLa ablación de TV se reconoce cada vez más como una herramienta terapéutica en miocarditis crónica con shocks recurrentes por TVMS o CDI con poca respuesta a los FAA (clase IIa) y, por primera vez, se considera una alternativa a los CDI para TV bien toleradas con función de FEVI preservada y cicatriz limitada (clase IIb). Se ha realizado una nueva recomendación para el implante de CDI en pacientes con TV/FV hemodinámicamente no tolerada durante la fase aguda de la miocarditis antes del alta hospitalaria (clase IIa), además de la recomendación previa en la fase crónica. En las presentes guías de práctica clínica se introduce un nuevo algoritmo para la prevención de la MSC y el tratamiento de AV en la sarcoidosis cardiaca, basado principalmente en los resultados de la RMC y de las pruebas electrofisiológicas. Se recomienda un CDI en cualquiera de los siguientes escenarios: paro cardíaco «abortado» o TVMS (clase I), FEVI<35% (clase I), RTG considerable en la RMC después de resolver la inflamación aguda (clase IIa), indicación de electroestimulación permanente relacionada con el bloqueo AV de alto grado (clase IIa). En el caso de FEVI del 35 al 50% y RTG menor, la inducibilidad de TVMS en la electroestimulación programada es un criterio adicional para el implante de un CDI (clase IIa). La definición de RTG considerable continúa siendo difícil de alcanzar. Aunque la ablación de TV puede ser útil para pacientes con AV, solo se recomienda después del fracaso de los FAA (clase IIb). En la miocardiopatía de Chagas, la amiodarona y la ablación mediante catéter han demostrado eficacia para controlar la AV recurrente en pacientes sintomáticos. Se realiza una nueva recomendación de ambos (clase IIa, los FAA se consideran la primera opción). Sorprendentemente, el beneficio del CDI en la mejora del pronóstico continúa siendo controvertido, incluso en la prevención secundaria. Por tanto, las recomendaciones de CDI han bajado de categoría: el CDI solo se recomienda en pacientes con TV sintomática si los FAA no son eficaces (clase IIb).
En las valvulopatías, cada vez se presta más atención a la asociación entre la MSC y el prolapso de la válvula mitral y el papel potencial de la RMC en la estratificación del riesgo. Se destaca la necesidad de estudios centrados en la identificación del subgrupo de pacientes en riesgo de MSC.
El documento pone énfasis en la evaluación de lesiones residuales o nuevas anomalías estructurales en pacientes con cardiopatía congénita y AV sostenida (clase I). Tras publicaciones recientes que vinculan la taquicardia supraventricular con conducción ventricular rápida a MSC (especialmente en pacientes con intercambio auricular en la transposición de las grandes arterias, operación de Fontan y anomalía de Ebstein), se realiza una nueva recomendación para el tratamiento con ablación cardiaca en pacientes seleccionados con paro cardíaco (clase IIa). Se realizan recomendaciones específicas para pacientes con tetralogía de Fallot reparada. Aunque la electroestimulación programada continúa siendo muy recomendada para la estratificación del riesgo arrítmico en pacientes sintomáticos y TVNS (clase IIa), su recomendación en pacientes asintomáticos ha bajado de categoría (clase IIb). Por último, se fomenta la transección preoperatoria de istmos anatómicos relacionados con TV en pacientes con TVMS tratados con reemplazo de vena pulmonar quirúrgico o percutáneo (clase IIa). Sin embargo, no se comenta la posible utilidad de este enfoque en pacientes asintomáticos.
RECOMENDACIÓN SOBRE ENFERMEDADES ELÉCTRICAS PRIMARIASLamentablemente, debido a la falta de evidencia sólida sobre los síndromes de arritmia primaria hereditaria, la mayoría de las recomendaciones continúan teniendo un nivel de evidencia C. Un aspecto notablemente positivo en la guía actual es la inclusión de algoritmos de tratamiento clínico que integran las recomendaciones más importantes para los diversos escenarios clínicos. Las pruebas genéticas se destacan en la nueva guía, que tienen una indicación de clase I en la mayoría de las canalopatías.
Aunque la FV idiopática se mantiene como diagnóstico de exclusión, se ha incluido en la guía actual entre las enfermedades eléctricas primarias. Se pueden tener en cuenta las pruebas genéticas y la evaluación clínica de los familiares de primer grado (clase IIb). Se recomiendan isoproterenol, quinidina o verapamilo para el tratamiento agudo de la tormenta arrítmica y quinidina para el tratamiento crónico de los shocks recurrentes de los CDI (clase IIa). El nivel de recomendación para la ablación mediante catéter en centros con experiencia en CVP que inducen FV recurrente ha descendido del I al IIa en las guías de práctica clínica actuales. Al igual que en las guías de práctica clínica anteriores, se recomiendan valores de corte del intervalo QT ≥480 y ≥460ms para el diagnóstico del síndrome del intervalo QT largo (SQTL) en pacientes asintomáticos y sintomáticos, respectivamente. Ahora se desaconseja el uso habitual de la prueba de epinefrina (clase III) debido a su escasa reproducibilidad. Sin embargo, se hace hincapié en la utilidad del «test de bipedestación» en el diagnóstico del SQTL. Los bloqueadores beta continúan siendo recomendados para todos los pacientes con SQTL. La nueva versión de las guías de práctica clínica indica la preferencia por bloqueadores beta no selectivos, como nadolol y propranolol. La recomendación de mexiletina en el SQTL de tipo 3ha pasado de la clase IIb a la clase I. Lamentablemente, existen limitaciones en España para seguir estas recomendaciones debido al acceso limitado a estos medicamentos: el propranolol de formulación retardada (que facilita la adherencia terapéutica) ya no se encuentra disponible y el nadolol y la mexiletina requieren solicitud como medicamentos extranjeros. El síndrome de Andersen-Tawil se presenta por primera vez en las guías de práctica clínica en una sección aparte. Este cambio es positivo dadas las características específicas de la enfermedad. Los bloqueadores beta o la flecainida son los fármacos de elección para tratar las AV. Se recomienda un CDI después de un paro cardiaco o TV no tolerada, y se debe valorar el Holter insertable si se produce un síncope inexplicable. Respecto al síndrome de QT corto, se ha realizado un cambio muy importante en los criterios diagnósticos, como<360ms y una mutación patógena o características clínicas (antecedentes familiares o supervivencia de un episodio de TV/FV) son los únicos criterios de clase I. Además, se puede utilizar un valor de corte de 320ms (no 340ms) como criterio diagnóstico único (clase IIa). Por último, se pone énfasis en las pruebas genéticas con el nivel de recomendación I. Sin embargo, debe tenerse en cuenta que todas las recomendaciones se basan en el consenso de los expertos y, por tanto, se necesitan más pruebas en el futuro.
Posiblemente, el aspecto más controvertido en el síndrome de Brugada (SBr) es la modificación de los criterios diagnósticos. En pacientes con un patrón de Brugada inducido, se requiere la existencia de otras características clínicas, como TV/FV polimórfica documentada, síncope arrítmico o antecedentes familiares de SBr o MSC (< 45 años) para el diagnóstico. Este cambio se ha justificado por la menor especificidad de las pruebas de provocación de lo que se pensaba inicialmente. Se carece de recomendaciones generales y de seguimiento para pacientes asintomáticos con una prueba farmacológica positiva. La indicación de un CDI en prevención secundaria y para pacientes con síncope arrítmico se mantiene sin cambios. La estratificación del riesgo en pacientes asintomáticos es un reto y objeto de un largo debate. Las guías de práctica clínica actuales han limitado la consideración del estudio electrofisiológico (EEF) para la estratificación del riesgo de pacientes asintomáticos con patrón espontáneo de Brugada de tipo 1 utilizando un protocolo que incluye hasta 2 estímulos adicionales. La recomendación para la ablación mediante catéter (sustrato epicárdico o CVP desencadenante) en pacientes con shocks recurrentes por CDI refractarios a quinidina ha subido de clase IIb a clase IIa. Por primera vez, se hacen recomendaciones en el síndrome de repolarización temprana, una entidad estrechamente relacionada con el síndrome de Brugada. El isoproterenol y la quinidina se recomiendan para el tratamiento de pacientes con tormentas arrítmicas y shocks recurrentes por CDI, respectivamente. Se debe valorar un Holter insertable (clase IIa) en pacientes con patrón de repolarización temprana y síncope arrítmico. Más controvertida es la recomendación (clase IIb) de un CDI o quinidina para pacientes con patrón de repolarización temprana, síncope arrítmico y características de riesgo adicionales, como un patrón electrocardiográfico de alto riesgo o antecedentes familiares de síndrome de repolarización temprana o MSC juvenil inexplicable.
Respecto a la taquicardia ventricular polimórfica catecolaminérgica, se deben comentar 2 características principales. En primer lugar, se ha incorporado un diagrama muy ilustrativo para el tratamiento de estos pacientes con diversos escenarios y el nivel de recomendación en cada situación. En segundo lugar, algunas recomendaciones han cambiado. En este sentido, se ha actualizado el papel de las pruebas genéticas (clase I), ahora también se recomiendan los bloqueadores beta a todos los pacientes con una prueba genética positiva a pesar de que no haya expresión de fenotipo (clase IIa) y se ha hecho hincapié en la superioridad de los bloqueadores beta no selectivos (nadolol o propranolol). Por último, se ha revisado el papel de la denervación cardiaca simpática izquierda y, aunque el documento afirma que no puede sustituir el implante de un CDI, el nivel de recomendación basado en grandes publicaciones recientes se ha actualizado a clase IIa en los casos de bloqueadores beta y fracaso de la flecainida.
RECOMENDACIÓN SOBRE OTROS CUADROS CLÍNICOSLas recomendaciones sobre el tratamiento de las arritmias durante el embarazo no han cambiado de forma sustancial, pero la ablación mediante catéter (utilizando sistemas de cartografía no fluoroscópica) se ha incorporado como una recomendación de clase IIa. Además, se analiza el papel potencial de los cardioversores-desfibriladores portátiles en pacientes con miocardiopatía periparto mientras esperan la recuperación de la FEVI. En este sentido, también se ha incluido una nueva indicación (clase IIb) para pacientes a la espera de un trasplante cardiaco. El riesgo potencial de AV también se revisa en otros 2 grupos específicos: atletas y adultos mayores de 65 años. La guía actual ha optado por un enfoque más práctico, con una clara diferenciación entre deportistas jóvenes (< 35 años) y deportistas de mediana edad (> 35 años). Las recomendaciones de formación en reanimación cardiopulmonar y desfibrilación externa automatizada en instalaciones deportivas han subido de clase IIa a clase I. Finalmente, la frecuente controversia sobre edad y riesgo de MSC sigue sin resolverse. La guía establece que los datos colectivos de estudios de distribución aleatoria y observacionales indican que el beneficio de los DCI no está claro en pacientes>75 años. Sin embargo, no se da ninguna recomendación clara sobre la edad y se recomienda una evaluación personalizada.
CONCLUSIONESAunque continúan existiendo importantes lagunas sobre la evidencia, la actual guía presenta nuevas recomendaciones para la estratificación del riesgo y el tratamiento. Se han reconocido varios avances, especialmente en trastornos hereditarios, inflamatorios e infiltrantes. Con todo, se hacen recomendaciones nuevas y prometedoras para escenarios clínicos más clásicos, que con suerte redundarán en una mejor atención al paciente.
FINANCIACIÓNNinguna.
CONFLICTO DE INTERESESLos documentos de declaración de conflicto de intereses de los autores se pueden consultar en el material adicional
Grupo de trabajo de la SEC para la guía ESC 2022 sobre el tratamiento de pacientes con arritmias ventriculares y la prevención de la muerte súbita cardiaca: Rut Andrea Riba (coordinadora), David Calvo Cuervo (coordinador), Almudena Aguilera Saborido, Pablo Ávila Alonso, Roberto Barriales Villa, Susana Bombín González, Victoria Cañadas Godoy, Juan Fernández Armentera, Juan Jiménez Jaimez, Esther Pérez David, Ivo Roca Luque, Ana Viana Tejedor.
Comité de guías de la SEC: Rut Andrea, Pablo Avanzas, Gemma Berga, Araceli Boraita, David Calvo, Raquel Campuzano, Victoria Delgado, Laura Dos Subirá, Juan José Gómez Doblas, Pilar Mazón, Domingo Pascual, Juan Sanchis, José M. de la Torre, David Vivas, José L. Ferreiro (presidente).
En el anexo A se relacionan por orden alfabético los nombres de todos los autores del artículo.
Véase contenido relacionado: https://secardiologia.es/cientifico/guias-clinicas/arritmias/13800-2022-esc-guidelines-for-the-management-of-patients-with-ventricular-arrhythmias-and-the-prevention-of-sudden-cardiac-death.
Autor para correspondencia.
Direcciones de correo electrónico: davidcalvo307@gmail.com (D. Calvo); randrea@clinic.cat (R. Andrea).