Pese a los esfuerzos realizados para mejorar la atención al shock cardiogénico (SC), incluyendo el desarrollo de dispositivos de asistencia circulatoria mecánica (ACM), su pronóstico continúa siendo desfavorable. En este contexto surgen iniciativas de código SC, basadas en proporcionar una asistencia rápida y de calidad a estos pacientes. Este documento multidisciplinario trata de justificar la necesidad de implantar el código SC, definiendo su estructura/organización, criterios de activación, flujo de pacientes según nivel asistencial e indicadores de calidad. Sus propósitos concretos son: a) presentar las peculiaridades de esta enfermedad y el aprendizaje del código infarto y de experiencias previas en SC; b) detallar las bases para el abordaje de estos pacientes, la estructura de los equipos, su logística, la elección del tipo de ACM y el momento de su implante, y c) abordar los desafíos para la implantación del código SC, como la singularidad del código SC pediátrico. Urge desarrollar una asistencia protocolizada, multidisciplinaria y centralizada en hospitales con gran volumen y experiencia que permita minimizar la inequidad en el acceso a la ACM y mejorar la supervivencia de estos enfermos. Solo el apoyo institucional y estructural de las distintas administraciones permitirá optimizar la atención al SC.
Palabras clave
El presente documento ha sido avalado por: Asociaciones Científicas de la Sociedad Española de Cardiología (Cardiología Intervencionista, Insuficiencia Cardiaca, Cardiopatía Isquémica y Cuidados Agudos Cardiovasculares), Sociedad Española de Cardiología Pediátrica y Cardiopatías Congénitas, Sociedad Española de Anestesiología, Reanimación y Terapéutica del Dolor, Sociedad Española de Cirugía Cardiovascular y Endovascular, Sociedad Española de Medicina Intensiva Crítica y Unidades Coronarias, Sociedad Española de Medicina de Urgencias y Emergencias y Asociación Española de Perfusionistas.
El shock cardiogénico (SC) es la forma más grave de fallo cardiaco, y la mortalidad a 30 días de pacientes seleccionados que reciben un tratamiento adecuado es de entre el 30 y el 50%1. Se debe a una disfunción cardiaca grave que ocasiona hipoperfusión tisular e hipoxia celular2–4. Como todo proceso dependiente del tiempo, puede ser reversible si se identifica y controla la causa desencadenante y se instauran medidas encaminadas a conseguir un soporte cardiocirculatorio adecuado para mantener una perfusión sistémica óptima.
La heterogeneidad en la eficacia del tratamiento se puede explicar por sus diferentes etiologías, presentaciones clínicas y fenotipos, comorbilidad y, a su vez, por la dificultad de identificar marcadores fiables de riesgo5. En lo que respecta a la etiología, la disfunción cardiaca que motiva el SC se puede originar tanto de un daño cardiaco agudo (como en el síndrome coronario agudo o la miocarditis) como de una descompensación de insuficiencia cardiaca (IC) crónica.
La Society for Cardiovascular Angiography and Intervention (SCAI) estableció 5 estadios en 2019: A (pacientes en riesgo de SC), B (SC inicial), C (SC clásico), D (SC en deterioro) y E (SC extremo), fácilmente identificables mediante la exploración física, marcadores bioquímicos (lactato y grado de acidosis metabólica/déficit de bases) y parámetros hemodinámicos6, que tiene implicaciones pronósticas (la mortalidad llega a un 70-80% en estadio E)7. Se ha actualizado en 2022 en algunos aspectos como considerar parada cardiaca solo si existe daño neurológico, mejorar la precisión en parámetros clínicos y enfatizar la progresión dinámica entre estadios7. Estudios de validación avalan su aplicabilidad clínica4.
El éxito en el abordaje del SC se fundamenta en la identificación y el tratamiento precoces de la causa subyacente, la caracterización precisa del estadio evolutivo, la estabilización hemodinámica/respiratoria y el abordaje de la disfunción multiorgánica. Este documento tiene como objetivo poner las bases para mejorar la atención al SC en España con protocolos de actuación que permitan una atención de calidad ajustada a las características de cada centro y de cada paciente. Su esencia se muestra en el resumen ejecutivo del .
ESTRUCTURA DE LOS SISTEMAS DE ATENCIÓN Y EQUIPOS DEL CÓDIGO SHOCK CARDIOGÉNICOMúltiples publicaciones de registros han comunicado experiencias con buenos resultados clínicos de equipos multidisciplinarios en el ámbito de un código SC8–11. La adecuada atención a estos pacientes precisa de una organización de los servicios sanitarios, para o cual se propone un modelo de atención en red, conocido en inglés como «Hub and Spoke», en el que se pueda administrar cada tratamiento según las necesidades de los pacientes, de manera oportuna y en el centro más adecuado2,5,7,12. Algunos de los aprendizajes del código infarto pueden ser útiles a la hora de diseñar esta atención (). Como muestran las experiencias locales previas en España () y otros países (), se debe tener en cuenta las peculiaridades geográficas y los recursos sanitarios de cada centro hospitalario y área sanitaria y establecer el tratamiento más adecuado en el centro inicial o, en el caso de que no estuviese disponible, la derivación rápida a otro centro mediante vías ágiles de traslado.
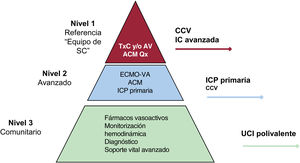
Es clave identificar centros de referencia en hospitales de alto volumen con protocolos claramente definidos en el seno de una organización regional por niveles de atención (tabla 1 y figura 1)13. Las características de los hospitales en función de su nivel de atención se detallan en la tabla 2. Aunque lo habitual será la detección de los pacientes subsidiarios de código SC en el medio hospitalario, la identificación precoz de aquellos con estadios A o B puede permitir la toma de decisiones respecto a canalizarlos directamente hacia centros de nivel 2 o 1. En cualquier caso, los hospitales de nivel 3 tienen un papel clave, ya que la evaluación por el especialista en críticos en este centro de detección (intensivista, médico de urgencias) permitirá no retrasar la actuación inicial con una activación precoz del código SC en caso de mala evolución o respuesta inadecuada al tratamiento instaurado en principio. Los centros de nivel 2 deben tener la capacidad de implantar asistencia circulatoria mecánica (ACM) de corta duración. Estos centros pueden tener un papel muy relevante como receptores de los pacientes en SC e implante de oxigenador extracorpóreo de membrana (ECMO). Por último, los de nivel 1 (y algunos centros de nivel 2 con la estructura necesaria disponible) deberán contar con equipos multidisciplinarios, cuyos objetivos, integrantes y funciones se muestran en la tabla 3. La definición de estos niveles asistenciales no es una tarea sencilla. Un factor clave de los centros de nivel 1 es tener amplia experiencia en el uso de varias ACM. Además, los datos avalan la necesidad de que del abordaje de estos pacientes se encarguen especialistas con experiencia y competencia en la atención de pacientes cardiovasculares críticos14–16. Estos especialistas también son clave para una actuación coordinada que permita la rápida evaluación del paciente y la activación del equipo SC17,18. Recientemente se ha propuesto el término «shock doc» para el especialista con competencias en cuidados críticos cardiológicos responsable de coordinar decisiones e intervenciones17.
Características de una organización regional jerarquizada que permita el código shock cardiogénico
| Red regional interhospitalaria categorizada |
| Criterios de selección consensuados |
| Capacidad de contactar rápidamente entre centros |
| Protocolizar indicación y tipo de asistencia circulatoria mecánica |
| Protocolizar traslados y transportes entre centros |
Figura central. Niveles de atención de los hospitales para el tratamiento del shock cardiogénico. ACM: asistencia circulatoria mecánica; AV: asistencia ventricular de media/larga duración; CCV: cirugía cardiovascular; ECMO-VA: oxigenador extracorpóreo de membrana venoarterial; IC: insuficiencia cardiaca; ICP: intervención coronaria percutánea; Qx: quirúrgico; SC: shock cardiogénico; TxC: trasplante cardiaco; UCI: unidad de cuidados intensivos.
Características de los centros hospitalarios de atención al SC en función de su nivel
| Nivel 3 o comunitario (detección del SC): UCI polivalente, sin cirugía cardiaca, angioplastia primaria ni ACM |
| Nivel 2 o avanzado (asistencia inicial al SC): programa ininterrumpido de angioplastia primaria y cirugía cardiaca. Capacidad de implantar dispositivos de ACM de corta/media duración |
| Nivel 1 o avanzado + opciones a largo plazo (tratamiento definitivo del SC): equipos multidisciplinarios de SC, experiencia amplia en implante percutáneo y quirúrgico de ACM de corta duración, programas acreditados de ACM de media/larga duración o TxC |
ACM: asistencia circulatoria mecánica; SC: shock cardiogénico; TxC: trasplante cardiaco; UCI: unidad de cuidados intensivos.
Objetivos del equipo multidisciplinario de shock cardiogénico, con sus miembros y funciones en evaluación y elección de ACM
| ObjetivosAsegurar un rápido diagnósticoIdentificar el fenotipo específicoAsignación al nivel de asistencia apropiadoToma de decisiones referentes a intervenciones y ACMReconocer la inutilidad y adoptar medidas paliativasIdentificar a los candidatos a ensayos clínicos | |
| Miembros | Funciones |
| Médicos y personal de enfermería de los servicios de urgencias hospitalarios y servicios de emergencias médicas extrahospitalarios | Primer contacto con el paciente si este no está ingresadoEstratificación del riesgo y abordaje inicialDecisión respecto al centro receptorTraslados entre centros con apoyo de nivel 1 o 2 |
| Intensivista/cardiólogo de críticos/anestesiólogo/cirujano cardiovascular y personal de enfermería de críticos | Coordinación del procesoIdentificación, estratificación y diagnósticoTratamiento médicoMonitorización hemodinámica invasivaSeguimiento, planteamiento y decisión precoz de ACMControl tras la intervención y posoperatorioEvaluación neurológicaRehabilitación y nutriciónAdecuación de medidas terapéuticas/paliativasCuidados al final de la vida/donación |
| Cardiólogo en insuficiencia cardiaca y trasplante | Tratamiento médicoDecisión de ACM de larga duraciónIndicaciones y contraindicaciones para el trasplante cardiaco |
| Cardiólogo intervencionista y personal de enfermería intervencionista | Intervención coronaria o estructuralDecisión de implante precoz de la ACMImplante percutáneo de ACM de corta duración |
| Bloque quirúrgico/cirujano cardiaco y/o vascular, anestesiólogo, perfusionista y personal de enfermería quirúrgico | Implante quirúrgico de ACM de corta y media duraciónTrasplante cardiaco/ACM de larga duraciónControl del dispositivo de ACM durante su implante, recambio o traslado |
ACM: asistencia circulatoria mecánica.
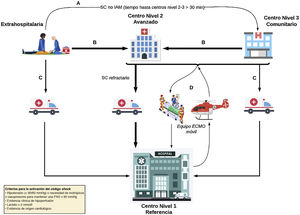
La organización del SC debe incluir los traslados a centros de nivel 1, el implante de ACM en centros de nivel 2 y el implante en centros de nivel 3 por equipos móviles de nivel 1 o 2 (figura 2). La tabla 4 detalla la composición de los equipos móviles que deben adaptarse a las situaciones regionales y estar disponibles 24 h los 7 días de la semana con contacto telefónico directo con los hospitales de nivel 2 y 3. Es particularmente importante que el médico canulador tenga amplia experiencia en el abordaje vascular. Con la creación de estos equipos, capaces de desplazarse a otros centros e implantar un dispositivo de asistencia circulatoria, fundamentalmente el ECMO, se ha demostrado beneficio en la supervivencia de estos pacientes19,20. El medio de transporte recomendado para distancias <400 km es el terrestre, mientras que el medio aéreo de ala fija se recomienda para distancias> 600 km (tabla 5). En el caso de transporte insular, se recomienda personalizar la decisión en función de la distancia por recorrer y las condiciones meteorológicas. En todo traslado es posible que surjan complicaciones (tabla 6).
Flujo de pacientes en la atención en red del shock cardiogénico. A: para lograr la estabilización precoz de un paciente con SC no secundario a un infarto agudo de miocardio (IAM) diagnosticado fuera del hospital, se puede transportarlo al centro de nivel 3 más cercano en caso de que el traslado al centro de nivel 1-2 exceda los 30 min comparado con el de nivel 3. B: un paciente con SC diagnosticado fuera del hospital o que se encuentra en un centro de nivel 3 se debe trasladar al centro de nivel 1 o 2 en función de los tiempos de traslado, especialmente en el contexto de un síndrome coronario agudo. C: un paciente con SC diagnosticado fuera del hospital o que se encuentra en un centro de nivel 3 se puede trasladar al centro de nivel 1 en caso de que se prevea necesidad de asistencia de alta complejidad. D: activación del equipo ECMO; se puede desplegar una unidad móvil desde el centro de nivel 1 hasta sus diferentes centros de referencia (niveles 2 y 3) en caso de necesidad de implante de asistencia circulatoria mecánica de alta complejidad para asegurar un traslado seguro. ECMO: oxigenador extracorpóreo de membrana; PAS: presión arterial sistólica; SC: shock cardiogénico.
Equipo de ECMO móvil, perfiles y roles
| Miembro del equipo | Tipo de perfil | Roles |
|---|---|---|
| Líder del equipo | Cardiólogo/intensivista/anestesiólogo/cirujano cardiovascular expertos en ECMO | LíderCoordinación del equipoAbordaje médico del pacienteColaborar en procedimiento de canulación |
| Médico canulador | Cardiólogo intervencionista/cirujano cardiovascular/especialista de críticos* | CanulaciónSujeción cánulas |
| Especialista en ECMO | Cardiólogo/intensivista/anestesiólogo experto en ECMO. Personal de enfermería perfusionista o personal de enfermería de críticos formado en ECMO | Purgado ECMOInicio del tratamientoAsegurar el correcto funcionamiento del dispositivoControl de la coagulación/gasometría |
| Personal de enfermería de críticos | Personal de enfermería experto en paciente crítico | Prepara material (lista de verificación)Apoyo en la canulación/instrumentaciónApoyo del personal de enfermería durante el transporte |
ECMO: oxigenador extracorpóreo de membrana.
Medios de transporte disponibles para traslado de pacientes con shock cardiogénico y asistencia circulatoria mecánica/ECMO
| Ambulancia | Helicóptero | Avión | |
|---|---|---|---|
| Distancia para tiempo razonable | ≤ 400 km | ≤ 650 km | Cualquier distancia |
| Ruido | Relativamente poco | Muy ruidoso | Ruidoso |
| Coste | ++ | +++ | ++++ |
| Limitaciones de peso | Ilimitado | Depende de la nave y las condiciones meteorológicas | Variable, dependiendo de la nave y las condiciones |
| Espacio para personal y equipo | Suficiente (4-5 miembros) | Limitado (3-5 miembros) | Variable (≥ 4 miembros) |
| Equipo de carga y sujeción y circuito ECMO/paciente | Relativamente sencillo | Relativamente sencillo | Variable dependiendo del equipamiento y de la nave |
| Logística a la llegada | No precisa transporte secundario | Helipuerto hospital o aeropuerto. Puede precisar transporte secundario | Precisa de aeropuerto habilitadoPrecisa transporte secundario |
| Impacto del clima | ++ | ++++ | +++ |
ECMO: oxigenador extracorpóreo de membrana.
Todos los vehículos deben tener: a) suministro eléctrico adecuado para ECMO y todos los demás equipos durante la duración del transporte; b) control climático; c) suministro de oxígeno fiable (aparte de los cilindros de transporte); d) sistema de aspiración; e) aire comprimido; f) iluminación adecuada, y e) espacio adecuado para el personal y el equipo necesarios.
Complicaciones relacionadas con el transporte de pacientes en asistencia mecánica circulatoria y estrategias para minimizarlas
| Complicaciones | |
| Relacionadas con el paciente | Extubación accidentalBajo nivel de sedaciónHipovolemiaRecirculaciónIsquemia arterialHemorragia |
| Relacionadas con el personal | Olvido de equiposFalta de personalErrores en la comunicación |
| Relacionadas con el equipamiento | Trombosis en el circuitoMovilización de las cánulasMaterial defectuosoFallo eléctrico/Fallo de baterías |
| Relacionadas con el transporte | Mal funcionamiento de fuentes de energíaErrores logísticosTráficoAmbulancia inadecuada |
| Relacionadas con el entorno | Condiciones meteorológicasDescompresiónCongelación de accesos venososHipotermia |
| Estrategias para minimizarlas | Transmisión exhaustiva, clara y precisa de la información entre todos los actoresGarantizar la seguridad de los profesionales que deben conocer procedimientosProtocolo de derivación oficial entre centrosFormación periódica del equipo, con simulación si es posibleListas de verificaciónEcógrafo portátil con sondas cardiaca y vascular |
Lógicamente, el primer indicador es la existencia misma de programas regionales de asistencia multidisciplinaria al SC (código SC). También es muy importante recoger la tasa de mortalidad hospitalaria por SC (pacientes fallecidos por SC/total de pacientes ingresados por SC) y el porcentaje de pacientes con SC secundario a síndrome coronario agudo tratados con coronariografía emergente (< 120 min). Este indicador serviría para captar la integración entre la red de código infarto y la red de SC. Por último, se debe registrar el porcentaje de ACM inscritos en el registro nacional de dispositivos de asistencia circulatoria y respiratoria en España (Registro RENACER). Dado que se trata de un registro de carácter obligatorio, debería ser del 100%.
También es clave recoger indicadores que permitan la prevención del SC, fundamentalmente los recomendados en el código infarto. Se calcula que 1 de cada 5 muertes por SC podrían haberse evitado con tiempos de primer contacto médico a angioplastia primaria dentro de los primeros 90 min recomendados21. De hecho, en las últimas décadas la proporción de casos de SC debido a SCA ha disminuido5.
ASISTENCIA CIRCULATORIA MECÁNICA: MOMENTO DE IMPLANTE Y ELECCIÓN DEL DISPOSITIVOLos tipos de ACM de corta duración que se usan en nuestro medio y sus contraindicaciones se detallan en el . La actual falta de demostración en estudios aleatorizados del beneficio de los distintos sistemas de ACM hace que las recomendaciones de las sociedades científicas sobre sus indicaciones, el momento del implante y el tipo de dispositivo sean relativamente laxas22, lo que deja un margen considerable a la experiencia de cada equipo. Una de las decisiones más difíciles en el tratamiento del SC es el momento en que se debe implantar el ACM y cuál elegir. El concepto de tiempo «puerta-asistencia» ha ganado relevancia en los últimos años. Diversos registros han mostrado que, a mayor profundidad del SC en el momento del implante del dispositivo, menor probabilidad de supervivencia23. La evidencia actual indica que la precocidad en la instauración de ACM tiene gran efecto pronóstico11,24,25. El ACM está especialmente indicado, salvo inutilidad, en SC refractario (estadios D y E). En estadios B y C sin insuficiencia respiratoria/hipoxia, habría que hacer una evaluación ecocardiográfica y hemodinámica precisa para determinar la necesidad y el tipo de ACM según la situación de la función ventricular y el grado de congestión. En estadio C con hipoxemia y en estadios D se debe valorar un ACM con ECMO combinado con un balón de contrapulsación intraaórtico o Impella (Abiomed, Estados Unidos).
En el contexto del paciente en SC secundario a infarto agudo de miocardio, las recomendaciones actuales indican el implante de ACM antes de la revascularización11,24,25. Esta forma de proceder se asocia con una reducción del tamaño del infarto26. En el mismo sentido apuntan los resultados extraídos de la Detroit Cardiogenic Shock Initiative. Dicho estudio evaluó la supervivencia11. Recientemente, un metanálisis que incluyó a 6.700 pacientes confirmó que la asistencia mecánica con Impella previo a la angioplastia reducía de forma drástica la mortalidad a 30 días27. Esta estrategia se está validando por el DanGer shock trial, actualmente en fase de inclusión28. Sin embargo, no está tan claro el uso del ECMO en este escenario, ya que puede aumentar la poscarga del ventrículo izquierdo y el consumo de oxígeno. Desde el punto de vista fisiopatológico no es la asistencia ideal para el SC en su fase inicial, pero la evolución a una fase más profunda del SC convierte al mismo no solo en un fallo de bomba, sino en un fallo circulatorio y multiorgánico, en el cual los flujos altos que puede administrar el ECMO, unido a algún dispositivo de descarga del ventrículo izquierdo, puede tener un papel clave. También estamos a la espera de la publicación de los ensayos clínicos en marcha en estos momentos con ECMO en este contexto: ExtraCorporeal Life Support in patients with acute myocardial infarction complicated by cardiogenic shock (ECLS-shock)29, EURO-Shock30 y Assessment of ECMO in Acute Myocardial Infarction Cardiogenic Shock (ANCHOR-NCT04184635).
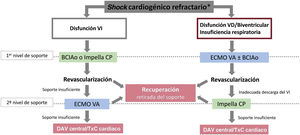
Más compleja resulta la elección del dispositivo en el SC no relacionado con el infarto agudo de miocardio. La etiología del cuadro y su gravedad son fundamentales en la toma de la decisión (clasificación SCAI, afección biventricular, situación respiratoria). La evaluación de la función del ventrículo derecho es de gran importancia31. En pacientes con función del ventrículo derecho conservada, el implante de un balón de contrapulsación o un Impella puede ser suficiente para proporcionar un soporte adecuado en algunos casos, mientras que el ECMO será el dispositivo de elección si hay disfunción biventricular o insuficiencia respiratoria asociada (figura 3)32. Los resultados del ECMO parecen mejorar cuando se le añade un dispositivo de descarga ventricular izquierda33, aunque la utilidad de la estrategia de ECMO junto con Impella está pendiente de confirmación en el ensayo clínico actualmente en marcha Randomized trial of Early LV VEnting using impella CP for Recovery in patients with cardiogenic Shock managed with VA ECMO (REVERSE)34. Para los pacientes con disfunción del ventrículo derecho aislada, hay sistemas percutáneos de flujo continuo dedicados a la descarga del ventrículo derecho. Un aspecto no resuelto es la elección entre el balón de contrapulsación y los otros dispositivos percutáneos de descarga del ventrículo izquierdo. Por un lado, estos últimos proporcionan un flujo muy superior al del balón de contrapulsación, pero por otro no han demostrado hasta ahora su superioridad clínica sobre aquel y algunos estudios han descrito una mayor incidencia de complicaciones con estos dispositivos, tanto solos35 como combinados con ECMO venoarterial33.
Selección del paciente y elección del dispositivo para pacientes con shock cardiogénico (SC). BCIAo: balón de contrapulsación intraaórtico; DAV: dispositivo de asistencia ventricular; PAS: presión arterial sistólica; TxC: trasplante cardiaco; VA: venoarterial; VD: ventrículo derecho; VI: ventrículo izquierdo.
*PAS <90mmHg más de 30min o inotrópicos para PAS> 90mmHg, signos de congestión pulmonar y mala perfusión y al menos una de las siguientes: alteración del estado mental, piel fría y sudorosa, oliguria <30ml/h o lactato arterial> 2,0 mmol/l. SC refractario es el SC pese a vasopresores/inotrópicos y una adecuada reposición de volumen.
Una situación especial es la parada cardiorrespiratoria, que obviamente conlleva un pronóstico y un protocolo de actuación diferentes; en este escenario emergente, es más común la ausencia de información suficiente y es razonable la aplicación de ACM como puente a decisión una vez que el equipo asistencial logre recoger toda la información necesaria.
PECULIARIDADES DEL CÓDIGO SHOCK CARDIOGÉNICO PEDIÁTRICOLas causas más frecuentes del SC pediátrico son la miocarditis aguda o fulminante, miocardiopatías o cardiopatías congénitas complejas descompensadas y fallo miocárdico tras la cirugía cardiaca, y la edad más frecuente de presentación es <1 año36. La incidencia de IC en menores de 18 años se estima en 1-7/100.000 y la incidencia anual de ingreso, en 14-18/100.00037. La mortalidad (7-26%) supera el 30% cuando se asocia con insuficiencia renal o hepática y llega al 50% si se precisa ECMO37. El SC se trata en unidades de cuidados intensivos pediátricos con cardiología pediátrica. Aunque en España existen 16 unidades de cirugía cardiaca pediátrica, no todas las comunidades autónomas disponen de ellas. Si se considera la escasa incidencia y la complejidad en el abordaje del SC, parece razonable establecer criterios comunes y mecanismos ágiles de derivación a estos centros de referencia. El tratamiento del SC pediátrico frecuentemente precisa ACM38. La ACM de corta duración habitual en pediatría es el ECMO y su utilidad, aunque inicialmente limitada a 2-3 semanas, se ha extendido recientemente con éxito hasta 3 meses39. Sin embargo, la mayoría de los hospitales pediátricos carecen de recursos humanos y técnicos para implantar el ECMO, por lo que se necesitan equipos multidisciplinarios compuestos por cirujanos, intensivistas y perfusionistas que puedan implantarlo in situ y trasladar al paciente a unidades especializadas40. La necesidad de ACM para pacientes con cardiopatías congénitas se centra en casos de SC tras circulación extracorpórea que precisan ECMO urgente como terapia puente a recuperación. También son tributarios de ACM pacientes con cardiopatías congénitas no intervenidas, especialmente univentriculares con descompensación grave como puente a cirugía o trasplante39. El 60% de los pacientes que requieren ACM presentan miocarditis o miocardiopatías refractarias a tratamiento. El ACM de corta duración es útil como puente a recuperación o como puente a un ACM de larga duración, pero limitada como puente al trasplante, ya que la mediana de espera de trasplante en código urgente es superior a 3 meses41. Por otro lado, en España se emplean dispositivos paracorpóreos tanto pulsátiles (Berlin Heart EXCOR, Berlin-Heart AG, Alemania) como continuos (Thoratec PediVAS/CentriMag, Thoratec, Estados Unidos; Maquet Rotaflow, Maquet, Alemania) en el tratamiento puente a trasplante cardiaco42 (tabla 7). La experiencia internacional ha crecido enormemente en los últimos años e incluye sistemas intracorpóreos de flujo continuo para pacientes de tamaño adecuado, en general mayores de 12 años y con peso> 40 kg (HeartMate 3, Abbott Labs, Estados Unidos; Heartware, HeartWare Inc., Estados Unidos, aunque este último actualmente no está disponible)43. Se han potenciado plataformas de apoyo que han contribuido a mejorar los resultados y disminuir las complicaciones trombóticas44. Actualmente un 40% de los menores de 18 años llegan al trasplante con un dispositivo de ACM41. La supervivencia es similar para pacientes en código electivo o urgente con asistencia ventricular de larga duración, mientras que está disminuida para pacientes en ECMO, menores de 1 año y pacientes con cardiopatías congénitas41. Las características especiales de los niños con SC obligan a un tratamiento en unidades específicamente pediátricas de IC y de trasplante.
Dispositivos de asistencia circulatoria mecánica en pediatría
| Dispositivo | ECMO venoarterial | Asistencia paracorpórea de flujo continuo | Asistencia paracorpórea de flujo pulsátil | Asistencia intracorpórea de flujo continuo | Corazón artificial total |
|---|---|---|---|---|---|
| Generalidades | |||||
| Experiencia | Mucha | Moderada | Abundante | Poca | Anecdótica |
| Duración de la asistencia | Corta (2-3 semanas) | Media (3-6 semanas) | Larga (meses) | Meses/Años | Meses/Años |
| Movilización del paciente | No | En ocasiones | Sí | Sí | Sí |
| Detalles técnicos | |||||
| Flujo sanguíneo | Continuo | Continuo | Pulsátil | Continuo | Pulsátil |
| Asistencia respiratoria | Sí | No (posible) | No | No | No |
| Asistencia circulatoria | Biventricular | Univentricular o biventricular | Univentricular o biventricular | Univentricular o biventricular | Biventricular |
| Canulación | Vascular | Cardiaca | Cardiaca | Intracardiaca | Sustitución cardiaca |
| Descarga ventricular | Incompleta | Casi completa | Completa | Completa | Completa |
| Anticoagulación | Sí | Sí | Sí | Sí | Sí |
| Antiagregación plaquetaria | No | Sí | Sí | Sí | Sí |
| Indicaciones | Puente a recuperaciónPuente a decisiónPuente a asistencia | Puente a trasplantePuente a recuperación (tardía) | Puente a trasplante | Puente a trasplantePuente a destino | Puente a destinoPuente a trasplante |
| Dispositivos | Varios | Thoratec PediVASThoratec CentriMag (Thoratec, Estados Unidos)Maquet Rotaflow (Maquet, Alemania) | Berlin Heart EXCOR (Berlin-Heart AG; Alemania) | HeartMate3 (Abbott Labs, Estados Unidos)Heartware (retirado) (HeartWare Inc., Estados Unidos) | SynCardia (Syncardia Systems, Estados Unidos) |
ECMO: oxigenador extracorpóreo de membrana.
El código SC es un reto organizativo tanto para hospitales como para los sistemas de transporte interhospitalario. Es inherente a la estructuración de un nuevo circuito asistencial que conlleve cambios en los flujos de pacientes, con previsión de aumento en la demanda en algunos centros y reducción en otros. En este sentido, uno de los principales obstáculos para la implementación real y exitosa del código SC son los intereses particulares de los diferentes actores y centros. La puesta en marcha de código SC se puede encontrar con varias barreras; entre ellas, la incomprensión de los hospitales no seleccionados para ubicar el equipo de coordinación multidisciplinario y la falta de recursos financieros para poner en marcha los equipos móviles. Por ello es absolutamente fundamental que todos los actores implicados hagan prevalecer el bien común y colaboren de forma activa en la realización de protocolo y el consenso de los criterios de traslado. La dotación de recursos materiales y personales es también imprescindible para el éxito de este tipo de iniciativas. Los centros en los cuales se prevea un aumento del flujo de pacientes deben tener la posibilidad de aumentar la disponibilidad de camas (especialmente en unidades de críticos dedicadas a estos pacientes) y la dotación de personal tanto facultativo como de enfermería especializada en función de la demanda. Además, se debe tener en cuenta el presupuesto derivado de dispositivos y procedimientos necesarios en este contexto clínico. Otro de los aspectos cruciales para el buen funcionamiento de este tipo de circuitos es disponer de un sólido sistema de transporte interhospitalario. En el caso del código SC es clave, ya que los tiempos de atención son cruciales y el personal encargado de hacer los traslados debe tener un alto grado de preparación y especialización. La contratación y la formación continuada del personal, con especial énfasis en la simulación clínica45, son factores imprescindibles para el éxito del programa, y mucho más aún si se prevé aspirar al implante a distancia de dispositivos de ACM por el personal de los sistemas de transporte interhospitalario. Otro potencial factor limitante es la saturación de las unidades de críticos en los centros de referencia. Los pacientes con SC que sobreviven a las primeras horas tienen largas estancias hospitalarias, con gran incidencia de complicaciones y necesidad de procedimientos invasivos46. De modo similar a lo ocurrido con el código infarto en algunas comunidades autónomas, se pueden implementar algunas medidas para evitar la saturación de los centros de referencia de alta complejidad, como el consenso de algunas condiciones de retorno a centros de menor complejidad de los pacientes que alcanzan un cierto grado de estabilidad, sobre todo cuando se decide que no son candidatos a tratamientos avanzados. Del mismo modo, las decisiones de adecuación de esfuerzo terapéutico se deben abordar en equipo multidisciplinario para evitar intervenciones inútiles y estancias innecesarias a los pacientes con múltiples complicaciones y mal pronóstico a corto plazo, situación frecuente en este contexto. Por último, en los casos en que la situación sea irreversible y las medidas de soporte resulten improductivas, se debe tener en cuenta la posibilidad de la donación de órganos y tejidos.
CONCLUSIONESA pesar de los avances en los dispositivos de ACM, el pronóstico del SC presenta un amplio margen de mejora. Ello se debe en gran parte a la fragmentación de la asistencia, la heterogeneidad de actuaciones y un abordaje no protocolizado. Numerosos registros observacionales respaldan el establecimiento de un código SC centralizado, multidisciplinario e integrador. El código SC es factible y puede mejorar la supervivencia de estos pacientes, lo que permite un diagnóstico precoz, el implante temprano de ACM y las estrategias y los tiempos de revascularización adecuados. El apoyo institucional es clave para el éxito de esta iniciativa.
FINANCIACIÓNEste documento no cuenta con financiación y los autores no han recibido contribución por su participación.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores han contribuido con importante contenido intelectual y han aprobado el texto final del documento principal y los anexos. J. Díaz y F. Fernández-Avilés han realizado una contribución similar en el artículo.
CONFLICTO DE INTERESESJ.M. de la Torre-Hernández: honorarios de consultoría de Medtronic, Boston Science, Abbott; pagos u honorarios por conferencias, presentaciones, oficinas de oradores, redacción de manuscritos o eventos educativos de Medtronic, Abbott, Boston Science; apoyo para asistir a reuniones y/o viajes de Biotronik, Abbott; participación en una junta de supervisión de la seguridad de los datos o en una junta consultiva de Medtronic y Philips. A. Sionis Green: honorarios de consultoría/conferencias/presentaciones de Amgen, Daiichi-Sankyo, Novartis, Sanofi y Servier. J.M. Barrio: honorarios de conferencias/presentaciones de Edwards Lifesciences. A. Uribarri: honorarios de consultoría/conferencias/presentaciones de Abbott. M. Monteagudo: honorarios como consultora para Abiomed. Los demás autores no presentan conflictos de intereses.