La endocarditis infecciosa (EI) es una grave enfermedad, descrita por William Osler en 18851, mayoritariamente causada en sus formas clásicas por Streptococcus viridans o Staphylococcus aureus2. Sin embargo, los cambios socioculturales y sanitarios acontecidos en las últimas décadas (envejecimiento de la población, cirugía cardiaca compleja, mayor uso de marcapasos y desfibriladores implantables, bacteriemias relacionadas con la atención sanitaria, etc.)3 han hecho que la EI haya modificado su perfil y su pronóstico4. Una de las posibles consecuencias de estos cambios es la modificación del perfil microbiológico causal, también propuesto por algunos estudios recientes4,5. Nuestro objetivo es analizar los microorganismos causales de EI y de sus distintos tipos (EI nativas y protésicas) en nuestro medio y los cambios producidos en los últimos 33 años. Se ha analizado una cohorte de pacientes diagnosticados de EI y seguidos prospectivamente en nuestro centro entre 1987 y 2019, que incluye todos los casos de EI producidos en ese tiempo, con la excepción de las EI en pacientes adictos a drogas por vía parenteral. Se ha estudiado dicha etiología en 3 periodos de tiempo (1987-1997, 1998-2008 y 2009-2019).
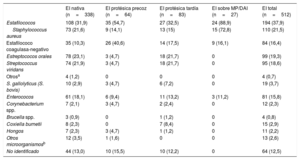
Nuestro centro es un hospital terciario, con servicio de cirugía cardiaca, y es centro de referencia para EI de 3 hospitales comarcales de nuestra provincia. En esos 33 años se han diagnosticado 512 casos de EI —nativas, el 66,1%; protésicas, el 28,7% (el 12,5% precoces y el 16,1% tardías), y sobre marcapasos u otros dispositivos eléctricos, el 5,2%—. La media de edad fue 55,3±17,9 años y el 66,2% eran varones. Se observó un aumento significativo de casos de EI en las épocas más recientes (138 en 1987-1997, 180 en 1998-2008 y 194 en 2009-2019; p <0,001). En la tabla 1 se muestran los microorganismos causales en todo el periodo de estudio, por tipo de EI. En la serie total, los microorganismos causales más frecuentes fueron los estafilococos (el 37,9%; el 21,5% S. aureus y el 15,8% estafilococo coagulasa-negativo), seguidos de los estreptococos (el 23%; el 19,3% orales y el 3,7% Streptococcus gallolyticus), los enterococos (16,2%) y otros (11,3%). No se identificó el microorganismo causal en el 12,5% de los casos. Por tipo de EI, los estafilococos fueron los microoganismos causales más frecuentes en todos ellos, sobre todo en las EI protésicas precoces (el 54,7%, con un 40,6% de estafilococos coagulasa-negativos) y sobre dispositivos eléctricos (el 88,9%, con un 72,8% de S. aureus) (tabla 1). De los 110 casos de S. aureus, 25 fueron resistentes a meticilina (22,7%). Esta elevada proporción de S. aureus tiene importancia, ya que estudios recientes confirman su papel de predictor independiente de mal pronóstico en pacientes con EI6. La etiología de las EI nativas y protésicas tardías fue similar (tabla 1). Destaca una relativamente elevada proporción de casos de EI nativa y protésica tardía causada por Coxiella burnetii (el 2,3 y el 8,4% respectivamente).
Microorganismos causales en la serie total y en los distintos tipos de endocarditis infecciosa (1987-2019)
| EI nativa (n=338) | EI protésica precoz (n=64) | EI protésica tardía (n=83) | EI sobre MP/DAI (n=27) | EI total (n=512) | |
|---|---|---|---|---|---|
| Estafilococos | 108 (31,9) | 35 (54,7) | 27 (32,5) | 24 (88,9) | 194 (37,9) |
| Staphylococcus aureus | 73 (21,6) | 9 (14,1) | 13 (15) | 15 (72,8) | 110 (21,5) |
| Estafilococo coagulasa-negativo | 35 (10,3) | 26 (40,6) | 14 (17,5) | 9 (16,1) | 84 (16,4) |
| Estreptococos orales | 78 (23,1) | 3 (4,7) | 18 (21,7) | 0 | 99 (19,3) |
| Streptococcus viridans | 74 (21,9) | 3 (4,7) | 18 (21,7) | 0 | 95 (18,6) |
| Otrosa | 4 (1,2) | 0 | 0 | 0 | 4 (0,7) |
| S. gallolyticus (S. bovis) | 10 (2,9) | 3 (4,7) | 6 (7,2) | 0 | 19 (3,7) |
| Enterococos | 61 (18,1) | 6 (9,4) | 11 (13,2) | 3 (11,2) | 81 (15,8) |
| Corynebacterium spp. | 7 (2,1) | 3 (4,7) | 2 (2,4) | 0 | 12 (2,3) |
| Brucella spp. | 3 (0,9) | 0 | 1 (1,2) | 0 | 4 (0,8) |
| Coxiella burnetii | 8 (2,3) | 0 | 7 (8,4) | 0 | 15 (2,9) |
| Hongos | 7 (2,3) | 3 (4,7) | 1 (1,2) | 0 | 11 (2,2) |
| Otros microorganismosb | 12 (3,5) | 1 (1,6) | 0 | 0 | 13 (2,6) |
| No identificado | 44 (13,0) | 10 (15,5) | 10 (12,2) | 0 | 64 (12,5) |
DAI: desfibrilador automático implantable; EI: endocarditis infecciosa; MP: marcapasos.
Los valores expresan n (%).
Cuando se analizaron los cambios por periodos de tiempo, en la serie total de EI se observó un aumento de los casos producidos por estafilococos, desde el 31,2% en 1987-1997 al 42,1% en 2009-2019, a expensas de un incremento de estafilococos coagulasa-negativos (del 7,3 al 22,1%; p=0,001) y de una tendencia al aumento de los enterococos (del 10,8 al 19,5%; p=0,089). No hubo cambios en la proporción de casos de EI producidos por S. aureus, estreptococos orales, Streptococcus gallolyticus o microorganismo causal no identificado (tabla 2). Y se observó una reducción de las EI causadas por microorganismos poco habituales (Brucella, Coxiella, Corynebacterium, hongos, otros), del 22,1 al 9,3% (p <0,001) (tabla 2). En las EI nativas se observó un aumento significativo de estafilococos coagulasa-negativos (del 4,3% en 1987-1997 al 14,3% en 2009-2019) y una disminución también significativa de S. aureus (del 29,8 al 19,8%) y de microorganismos poco habituales (del 17,0 al 10,2%), y sin modificaciones para el resto de microorganismos (tabla 2). En las EI protésicas precoces hubo un gran aumento de casos de estafilococos coagulasa-negativos, del 15 al 52,2%, y una disminución de casos producidos por Corynebacterium spp. (del 15 al 0%) y por microorganismos no identificados (del 20 al 8,7%), sin modificaciones para el resto de microorganismos (tabla 2). En las EI protésicas tardías se incrementaron los casos producidos por ambos tipos de estafilococos, S. aureus y coagulasa-negativo, y enterococos (del 0 al 21,9%), con una notable reducción de los estreptococos orales, del 36,4 al 12,5% (tabla 2).
Microorganismos causales de endocarditis infecciosa en la serie total y en los diferentes tipos de endocarditis por periodos de tiempo (1987-1997, 1998-2008 y 2009-2019)
| Total de EI | 1987-1997 (n=138) | 1998-2008 (n=180) | 2009-2019 (n=194) | pa |
|---|---|---|---|---|
| Estafilococos | 43 (31,2) | 71 (39,4) | 80 (42,1) | 0,152 |
| Staphylococcus aureus | 33 (23,9) | 39 (21,7) | 38 (20,0) | 0,637 |
| Estafilococo coagulasa-negativo | 10 (7,3) | 32 (17,7) | 42 (22,1) | 0,001d |
| Estreptococos orales | 29 (16,7) | 37 (20,5) | 33 (17,0) | 0,579 |
| Streptococcuos viridans | 29 (16,7) | 35 (19,4) | 31 (15,9) | 0,642 |
| Otrosb | 0 | 2 (1,1) | 2 (1,1) | 0,816 |
| S. gallolyticus (S. bovis) | 6 (4,3) | 6 (3,3) | 7 (3,6) | 0,748 |
| Enterococos | 15 (10,8) | 29 (16,1) | 37 (19,5) | 0,089 |
| Otros microorganismosc | 29 (22,1) | 10 (5,4) | 16 (9,3) | <0,001d |
| No identificado | 16 (11,6) | 27 (15,0) | 21 (11,1) | 0,486 |
| EI nativas | 1987-1997 (n=94) | 1998-2008 (n=118) | 2009-2019 (n=126) | pa |
|---|---|---|---|---|
| Estafilococos | 32 (34,1) | 33 (27,9) | 43 (34,1) | 0,364 |
| S. aureus | 28 (29,8) | 20 (16,9) | 25 (19,8) | 0,048d |
| Estafilococo coagulasa-negativo | 4 (4,3) | 13 (11,0) | 18 (14,3) | 0,049d |
| Estreptococos orales | 20 (21,3) | 31 (26,3) | 27 (21,4) | 0,486 |
| S. viridans | 20 (21,3) | 29 (24,6) | 25 (19,8) | 0,524 |
| Otros | 0 | 2 (1,7) | 2 (1,6) | 0,841 |
| S. gallolyticus (S. bovis) | 3 (3,2) | 2 (1,7) | 5 (3,9) | 0,712 |
| Enterococos | 12 (12,7) | 25 (21,2) | 24 (19,0) | 0,267 |
| Otros microorganismos | 16 (17,0) | 8 (6,7) | 13 (10,2) | 0,047d |
| No identificado | 11 (12,2) | 19 (16,1) | 14 (11,1) | 0,484 |
| EI protésicas precoces | 1987-1997 (n=20) | 1998-2008 (n=21) | 2009-2019 (n=23) | pa |
|---|---|---|---|---|
| Estafilococos | 5 (25,0) | 15 (68,2) | 15 (65,2) | 0,005d |
| S. aureus | 2 (10,0) | 4 (19,0) | 3 (13,0) | 0,474 |
| Estafilococo coagulasa-negativo | 3 (15,0) | 11 (49,2) | 12 (52,2) | 0,019d |
| Estreptococos orales | 1 (5,0) | 0 | 2 (8,7) | 0,746 |
| S. viridans | 1 (5,0) | 0 | 2 (8,7) | 0,746 |
| Otros | 0 | 0 | 0 | - |
| S. gallolyticus (S. bovis) | 2 (10,0) | 1 (4,7) | 0 | 0,641 |
| Enterococos | 3 (15,0) | 0 | 3 (13,0) | 0,676 |
| Otros microorganismos | 5 (20,0) | 1 (4,7) | 1 (4,3) | 0,095 |
| No identificado | 4 (20,0) | 4 (19,0) | 2 (8,7) | 0,520 |
| EI protésicas tardías | 1987-1997 (n=22) | 1998-2008 (n=29) | 2009-2019 (n=32) | pa |
|---|---|---|---|---|
| Estafilococos | 4 (18,2) | 11 (37,9) | 12 (37,5) | 0,083 |
| S. aureus | 1 (4,5) | 8 (27,6) | 4 (12,5) | 0,088 |
| Estafilococo coagulasa-negativo | 3 (13,7) | 3 (10,3) | 8 (25,0) | 0,436 |
| Estreptococos orales | 8 (36,4) | 6 (20,7) | 4 (12,5) | 0,110 |
| S. viridans | 8 (36,4) | 6 (20,7) | 4 (12,5) | 0,110 |
| Otros | 0 | 0 | 0 | — |
| S. gallolyticus (S. bovis) | 1 (4,5) | 3 (10,3) | 2 (6,2) | 0,369 |
| Enterococos | 0 | 4 (13,8) | 7 (21,9) | 0,048d |
| Otros microorganismos | 8 (34,1) | 1 (4,7) | 2 (6,2) | <0,001d |
| No identificado | 1 (4,5) | 4 (13,8) | 5 (15,6) | 0,485 |
EI: endocarditis infecciosa.
Los valores expresan n (%).
Para la comparación estadística se han utilizado la prueba de la χ2 o la de Fisher-Freeman-Halton (esta última en las categorías con algún valor <5).
Otros microorganismos: Corynebacterium spp. (12 casos), Coxiella burnetii (15 casos), Brucella spp. (4 casos), hongos (11 casos), Listeria monocytogenes (1 caso), Lactobacillus spp. (1 caso), Propionibacterium spp. (1 caso), enterobacterias (2 casos); grupo HACEK (5 casos), polimicrobianas (2 casos).
De los datos de esta amplia serie de EI que abarca 33 años de experiencia, se puede concluir que el espectro microbiológico causal de la EI ha cambiado de manera muy significativa en nuestro medio en este periodo tiempo, con un incremento notable de los casos producidos por estafilococos coagulasa-negativos y enterococos, el mantenimiento de los estreptococos orales y una reducción de los casos producidos por microorganismos poco habituales, como Brucella, Coxiella y Corynebacterium, que eran relativamente frecuentes en el siglo pasado. Con pequeñas diferencias, estos cambios se han producido en todos los tipos de EI. Estos resultados pueden tener implicaciones terapéuticas a la hora de seleccionar el tratamiento antibiótico empírico inicial y también para el pronóstico de la endocarditis.