Se han analizado las diferencias por sexo en múltiples enfermedades cardiovasculares. Sin embargo, el impacto en la miocardiopatía hipertrofia (MCH) no está claro. Nuestro objetivo es caracterizar las diferencias en mortalidad total y cardiovascular en función del sexo en un registro de MCH.
MétodosSe incluyó a 1.042 pacientes (el 41% mujeres, n=429) de un registro nacional de MCH. La media de edad al diagnóstico fue 53±16 años y el seguimiento medio, 65±75 meses. Al diagnóstico, las mujeres eran mayores (56±16 frente a 51±15 años; p <0,001), eran más las sintomáticas (el 56,4 frente al 51,7%; p <0,001) y con insuficiencia cardiaca (el 42,0 frente al 24,2%; p <0,001), disfunción diastólica (el 75,2 frente al 64,1%; p=0,001), insuficiencia mitral moderada/grave (el 33,4 frente al 21,7%; p=0,003), y tenían cifras más altas de BNP (920 [366-2.412] frente a 487 [170-1.087] mg/dl; p <0,001]. A las mujeres se les realizaron menos pruebas de estrés y resonancia magnética cardiaca. Las mortalidades total (el 8,4 frente al 5,0%; p=0,026) y cardiovascular (el 5,5 frente al 2,2%; p=0,004) fueron mayores entre las mujeres.
ResultadosLa regresión de riesgos proporcionales de Cox mostró que el sexo femenino era un predictor independiente de mortalidad total (HR=2,05; IC95%, 1,11-3,78; p=0,021) y mortalidad cardiovascular (HR=3,16; IC95%, 1,25-7,99; p=0,015). Las mujeres sufrieron más muertes por insuficiencia cardiaca (el 2,6 frente al 0,8%; p=0,024). A pesar de un riesgo similar de muerte súbita cardiaca (MSC), el número de implantes de desfibrilador automático implantable (DAI) fue menor en mujeres (el 10,9 frente al 15,6%; p=0,032) y, entre los pacientes sin DAI, la MSC fue mayor en las mujeres (el 1,8 frente al 0,4%; p=0,031).
ConclusionesEn este registro, el sexo femenino fue un predictor independiente de muerte total y cardiovascular, más frecuentemente relacionada con insuficiencia cardiaca. A pesar de un riesgo similar de MSC, las mujeres fueron infratratadas con DAI. Estos hallazgos resaltan la necesidad de una mejora en el enfoque clínico para las mujeres con MCH.
Palabras clave
La miocardiopatía hipertrófica (MCH) se define por un grosor aumentado de la pared del ventrículo izquierdo (VI) que no se explica por unas condiciones de carga anómalas1. Tiene una incidencia anual de 0,3-0,5/100.000 personas y se transmite mayormente como rasgo autosómico dominante, aunque se ha descrito un pequeño predominio en el sexo masculino2,3. La guía vigente indica que esto puede reflejar sesgo en las estrategias de cribado y en los modificadores genéticos y hormonales1.
Las diferencias sexuales tienen implicaciones claras en muchas enfermedades cardiacas4–6. No obstante, en la MCH estas diferencias no se han identificado claramente. Estudios previos mostraron que es posible que las mujeres no solo estén infrarrepresentadas en las cohortes de MCH, ya que al parecer también en una fase más tardía de la enfermedad presentan más obstrucción del tracto de salida del ventrículo izquierdo (TSVI) y más síntomas4. Recientemente, un estudio realizado con población estadounidense ha sido el primero en observar que las mujeres con MCH pueden tener un peor pronóstico7.
El objetivo del presente estudio es caracterizar las diferencias por sexo en la mortalidad total y cardiovascular (CV) en un gran registro nacional de MCH en la Unión Europea8.
MÉTODOSRegistro Portugués de Miocardiopatía HipertróficaEl Registro Portugués de Miocardiopatía Hipertrófica es un registro observacional, retrospectivo, multicéntrico y de ámbito nacional. Los criterios de inclusión fueron tener más de 18 años en el momento de la inclusión y MCH según la define la Sociedad Europea de Cardiología, es decir, hipertrofia del VI sin causa aparente con un grosor de la pared del VI ≥ 15 mm según técnicas de diagnóstico por imagen1. Los criterios de exclusión fueron hipertensión de grado ≥ 2, estenosis aórtica entre moderada y grave, diagnóstico previo de enfermedad sistémica o cardiaca y síndrome metabólico o multiorgánico relacionado con la hipertrofia del VI. Se pidió a los centros que incluyeran a todos los pacientes con un diagnóstico de MCH seguidos en el centro hasta abril de 2015, actualmente o en el pasado (sin límite de tiempo retrospectivo), incluidos los ya fallecidos en el momento de entrar a formar parte del estudio. El tiempo de seguimiento se definió como el tiempo transcurrido desde la evaluación inicial realizada en el centro hasta la última evaluación o la defunción. El Registro Portugués de Miocardiopatía Hipertrófica recogió datos sociodemográficos y clínicos relacionados con los antecedentes clínicos, el cuadro clínico, las pruebas diagnósticas, la exclusión por fenocopia, el tratamiento, el seguimiento y los eventos ocurridos durante el seguimiento. La obstrucción del TSVI se definió como la presencia de un gradiente de TSVI ≥ 30 mmHg. El consentimiento informado se obtuvo de pacientes vivos o de un representante de los pacientes fallecidos. Esta investigación se ajusta a los principios definidos en la Declaración de Helsinki y fue aprobada por el Centro nacional de protección de datos y los comités éticos locales. Sobre el Registro Portugués de Miocardiopatía Hipetrófica8,9 ya se han publicado más detalles.
Resultados en la miocardiopatía hipertróficaSe definieron 2 objetivos principales: a) mortalidad total, y b) mortalidad CV durante el seguimiento. La mortalidad CV se definió como la muerte súbita cardiaca (MSC) o la muerte relacionada con ictus, infarto de miocardio o insuficiencia cardiaca (IC). La guía sobre IC de la Sociedad Europea de Cardiología de 2016 definía la IC como el síndrome clínico causado por una anomalía estructural o funcional que origina un menor gasto cardiaco o la elevación de las presiones intracardiacas en reposo o durante el esfuerzo10. La MSC o el equivalente de MSC fue un objetivo secundario definido como cualquier MSC, reanimación satisfactoria de la MSC o tratamiento apropiado de desfibrilación mediante desfibrilador automático implantable (DAI). Teniendo en cuenta que antes de 2014 se trataba a los pacientes con MCH según las guías previas sobre implante de DAI en prevención primaria de la MSC, para calcular el riesgo de MSC de los pacientes con MCH se aplicaron los factores de riesgo de MSC clásicos11. Además, también se evaluó la puntuación de riesgo de MSC en la MCH y se clasificó a los pacientes según el riesgo de MSC a 5 años (< 4%, ≥ 4 y < 6% o ≥ 6%)1.
Análisis estadísticoLas variables categóricas expresan frecuencias y variables continuas como la media ± desviación estándar o la mediana [intervalo intercuartílico]. Las pruebas de la χ2 o de Fisher se utilizaron para comparar las variables categóricas, y para las continuas, la prueba de la t de Student, ANOVA o equivalentes no paramétricos. Los análisis de regresión de riesgos proporcionales de Cox evaluaron la relación entre el sexo y el momento de la muerte por cualquier causa o por causa CV. Para el análisis de la supervivencia, se creó un modelo multivariante con curvas de supervivencia según el método de Kaplan-Meier y se hicieron comparaciones mediante log-rank test. Todos los valores de p eran bilaterales y se consideraron significativos los < 0,05.
RESULTADOSEste estudio contó con 1.042 pacientes adultos con MCH de 29 centros participantes; 429 (41,2%) eran mujeres. La media de edad al diagnóstico fue 53±16 años. Se siguió a los pacientes entre 1975 y 2015, y la media de seguimiento fue 65±75 meses. El número de casos por centro y la distribución demográfica por centro se han publicado en un ensayo previo8.
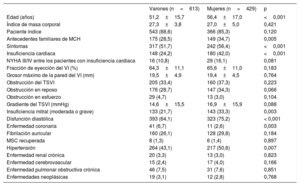
En la tabla 1 se describen todas las características basales relevantes en el diagnóstico, clasificadas por sexo. En el momento del diagnóstico las mujeres eran mayores (56±16 frente a 51±15 años; p<0,001) y había más sintomáticas (el 56,4 frente al 51,7%; p < 0,001), referían con mayor frecuencia que los varones disnea (el 47,7 frente al 28,6%; p < 0,001) y palpitaciones (el 26,0 frente al 17,6%; p=0,002), pero no síncope (el 10,3 frente al 10,8%; p=0,823). No se observaron diferencias relacionadas con la prevalencia de fibrilación auricular (el 11,2 frente al 12,1%; p=0,419). El diagnóstico de IC fue más frecuente entre las mujeres (el 42,0 frente al 24,2%; p < 0,001), igual que la insuficiencia mitral (moderada o grave en el 33,4 frente al 21,7%; p=0,003) y la disfunción diastólica (el 75,2 frente al 64,1%; p=0,001). En las mujeres fue mayor la concentración de péptido natriurético cerebral en el diagnóstico (mediana, 920 [366-2.412] frente a 487 [170-1.087] mg/dl; p < 0,001). La hipertensión también fue más prevalente entre las mujeres (el 50,6 frente al 43,1%; p=0,007), aunque la enfermedad coronaria fue más frecuente en los varones (el 2,6 frente al 6,7%; p=0,003).
Características basales de los pacientes con miocardiopatía hipertrófica
| Varones (n=613) | Mujeres (n=429) | p | |
|---|---|---|---|
| Edad (años) | 51,2±15,7 | 56,4±17,0 | <0,001 |
| Índice de masa corporal | 27,3±3,8 | 27,0±5,0 | 0,421 |
| Paciente índice | 543 (88,6) | 366 (85,3) | 0,120 |
| Antecedentes familiares de MCH | 175 (28,5) | 149 (34,7) | 0,005 |
| Síntomas | 317 (51,7) | 242 (56,4) | <0,001 |
| Insuficiencia cardiaca | 148 (24,2) | 180 (42,0) | <0,001 |
| NYHA III/IV entre los pacientes con insuficiencia cardiaca | 16 (10,8) | 29 (16,1) | 0,081 |
| Fracción de eyección del VI (%) | 64,3±11,1 | 65,6±11,0 | 0,183 |
| Grosor máximo de la pared del VI (mm) | 19,5±4,9 | 19,4±4,5 | 0,764 |
| Obstrucción del TSVI | 205 (33,4) | 160 (37,3) | 0,223 |
| Obstrucción en reposo | 176 (28,7) | 147 (34,3) | 0,066 |
| Obstrucción en esfuerzo | 29 (4,7) | 13 (3,0) | 0,104 |
| Gradiente del TSVI (mmHg) | 14,6±15,5 | 16,9±15,9 | 0,088 |
| Insuficiencia mitral (moderada o grave) | 133 (21,7) | 143 (33,3) | 0,003 |
| Disfunción diastólica | 393 (64,1) | 323 (75,2) | < 0,001 |
| Enfermedad coronaria | 41 (6,7) | 11 (2,6) | 0,003 |
| Fibrilación auricular | 160 (26,1) | 128 (29,8) | 0,184 |
| MSC recuperada | 8 (1,3) | 6 (1,4) | 0,897 |
| Hipertensión | 264 (43,1) | 217 (50,6) | 0,007 |
| Enfermedad renal crónica | 20 (3,3) | 13 (3,0) | 0,823 |
| Enfermedad cerebrovascular | 15 (2,4) | 17 (4,0) | 0,166 |
| Enfermedad pulmonar obstructiva crónica | 46 (7,5) | 31 (7,6) | 0,851 |
| Enfermedades neoplásicas | 19 (3,1) | 12 (2,8) | 0,768 |
MCH: miocardiopatía hipertrófica; MSC: muerte súbita cardiaca; NYHA: New York Heart Association; TSVI: tracto de salida del ventrículo izquierdo; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
Se realizó un electrocardiograma (ECG) a todos los pacientes y un ecocardiograma transtorácico al 99,7% (n=609) de los varones y el 99,3% (n=426) de las mujeres (p=0,654). No obstante, a las mujeres se les realizaron menos pruebas de esfuerzo (el 36,5 frente al 46,6%; p=0,001), ecocardiogramas de esfuerzo (el 13,7 frente al 19,4%; p=0,018) y resonancias magnéticas cardiacas (el 41,7 frente al 49,1%; p=0,020). Los datos del ECG, la ecocardiografía de esfuerzo y la resonancia magnética cardiaca se muestran en la tabla 1 del material adicional.
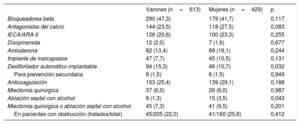
Se constató una tendencia a mayor frecuencia de obstrucción del TSVI en reposo entre las mujeres (el 36,3 frente al 30,7%; p=0,066). La frecuencia de obstrucción del TSVI en esfuerzo fue similar en ambos sexos, pero es posible que se infradiagnosticara a las mujeres, ya que estas se sometían a ecocardiografía de esfuerzo con menor frecuencia. A las mujeres se les realizaron más ablaciones septales con alcohol que a los varones (el 3,5 frente al 1,3%; p=0,018), pero la frecuencia de miectomías fue similar en ambos sexos (el 6,0 frente al 6,0%; p=0,987). Todas las medidas terapéuticas se resumen en la tabla 2. Todos los DAI se implantaron siguiendo las recomendaciones vigentes en el momento del implante.
Intervenciones terapéuticas en pacientes con miocardiopatía hipertrófica
| Varones (n=613) | Mujeres (n=429) | p | |
|---|---|---|---|
| Bloqueadores beta | 290 (47,3) | 179 (41,7) | 0,117 |
| Antagonistas del calcio | 144 (23,5) | 118 (27,5) | 0,083 |
| IECA/ARA-II | 126 (20,6) | 100 (23,3) | 0,255 |
| Disopiramida | 12 (2,0) | 7 (1,6) | 0,677 |
| Amiodarona | 82 (13,4) | 69 (16,1) | 0,244 |
| Implante de marcapasos | 47 (7,7) | 45 (10,5) | 0,131 |
| Desfibrilador automático implantable | 94 (15,3) | 46 (10,7) | 0,032 |
| Para prevención secundaria | 8 (1,5) | 6 (1,5) | 0,949 |
| Anticoagulación | 153 (25,4) | 139 (29,1) | 0,188 |
| Miectomía quirúrgica | 37 (6,0) | 26 (6,0) | 0,987 |
| Ablación septal con alcohol | 8 (1,3) | 15 (3,5) | 0,043 |
| Miectomía quirúrgica o ablación septal con alcohol | 45 (7,3) | 41 (9,5) | 0,201 |
| En pacientes con obstrucción (tratados/total) | 45/205 (22,0) | 41/160 (25,6) | 0,412 |
ARA-II: antagonistas del receptor de la angiotensina II; IECA: inhibidores de la enzima de conversión de la angiotensina.
Los valores expresan n (%).
Se realizaron pruebas genéticas al 51% de la población del estudio (n=528). El 59% eran varones y el 41%, mujeres; no hubo diferencias estadísticamente significativas en el número de pruebas genéticas realizadas a cada sexo (309/613 varones [50%] frente a 219/429 mujeres [51%]; p=0,96). Con respecto a los resultados de las pruebas, el 40% (n=210) de las pruebas identificaron una mutación patógena o presuntamente patógena9. El número de pruebas positivas tampoco difirió entre ambos sexos. Todos los datos genéticos del registro se han analizado en un ensayo de Lopes et al.9 publicado recientemente. La exclusión activa de fenocopias fue más frecuente en los centros de gran volumen, aunque de modo similar en ambos sexos, tal como se había publicado anteriormente8,9.
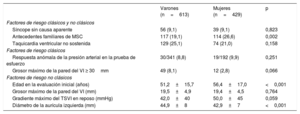
A las mujeres se les realizaron menos implantes de DAI (el 10,9 frente al 15,6%; p=0,032) (tabla 2) a pesar de un riesgo similar de MSC según los factores de riesgo de MSC clásicos y no clásicos (tabla 3). Con respecto a los factores de riesgo de MSC clásicos, eran iguales en varones y mujeres la prevalencia de síncope sin causa aparente (el 10,8 frente al 10,3%; p=0,823), la taquicardia ventricular no sostenida (el 23,0 frente al 19,5%; p=0,193), el grosor máximo de la pared del VI ≥ 30 mm (el 8,1 frente al 2,8%; p=0,066) y la respuesta anómala de la presión arterial al ejercicio (el 8,8 frente al 9,9%; p=0,668), aunque las mujeres presentaban más antecedentes familiares de MSC (el 28,6 frente al 20,1%; p=0,002). En general, el número medio de factores de riesgo de MSC clásicos fue similar en varones y mujeres (el 0,7 frente al 0,7%; p=0,575), así como la prevalencia de pacientes con por lo menos 1 factor de riesgo clásico (el 43,9 frente al 46,8%; p=0,352). Considerando a los pacientes con 1 o más factores de riesgo de MSC clásicos y en consecuencia potencialmente idóneos para DAI, se observó que el número total de implantes de DAI no era alto en ninguno de los sexos. No obstante, se identificó una tendencia estadísticamente significativa hacia un menor número de implantes en las mujeres (el 23,4% [46/197] frente al 31,8% [84/264]; p=0,045).
Factores de riesgo de muerte súbita cardiaca en los pacientes con miocardiopatía hipertrófica
| Varones (n=613) | Mujeres (n=429) | p | |
|---|---|---|---|
| Factores de riesgo clásicos y no clásicos | |||
| Síncope sin causa aparente | 56 (9,1) | 39 (9,1) | 0,823 |
| Antecedentes familiares de MSC | 117 (19,1) | 114 (26,6) | 0,002 |
| Taquicardia ventricular no sostenida | 129 (25,1) | 74 (21,0) | 0,158 |
| Factores de riesgo clásicos | |||
| Respuesta anómala de la presión arterial en la prueba de esfuerzo | 30/341 (8,8) | 19/192 (9,9) | 0,251 |
| Grosor máximo de la pared del VI ≥ 30mm | 49 (8,1) | 12 (2,8) | 0,066 |
| Factores de riesgo no clásicos | |||
| Edad en la evaluación inicial (años) | 51,2±15,7 | 56,4±17,0 | <0,001 |
| Grosor máximo de la pared del VI (mm) | 19,5±4,9 | 19,4±4,5 | 0,764 |
| Gradiente máximo del TSVI en reposo (mmHg) | 42,0±40 | 50,0±45 | 0,059 |
| Diámetro de la aurícula izquierda (mm) | 44,9±8 | 42,9±7 | <0,001 |
MSC: muerte súbita cardiaca; TSVI: tracto de salida del VI; VI: ventrículo izquierdo.
Los valores expresan n (%) o media ± desviación estándar.
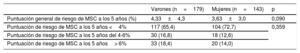
Con respecto a los factores de riesgo incluidos en la puntuación actualmente recomendada para la clasificación del riesgo de MSC (la escala de riesgo de MSC en la MCH) varones y mujeres presentaban similares gradientes máximos del TSVI en reposo (42,0±40 frente a 50,0 ± 45 mmHg; p=0,059), aunque en los varones era mayor el diámetro de la aurícula izquierda (42,9 ± 7 frente a 44,9 ± 8 mm; p < 0,001) y el grosor máximo de la pared del VI (17,7 ± 4 frente a 18,4 ± 5 mm; p = 0,041). Como ya se ha comentado, las mujeres eran mayores (56 ± 16 frente a 51 ± 15 años; p<0,001). No obstante, el riesgo de MSC a 5 años fue similar en varones y mujeres según la escala de riesgo de MSC en la MCH, sin diferencias en la puntuación media o las categorías de clasificación del riesgo entre sexos (tabla 4). En el grupo de pacientes potencialmente idóneos para DAI, es decir, aquellos con una puntuación de riesgo de MSC en la MCH ≥ 4%, las mujeres recibieron menos DAI que los varones, y esta diferencia también representó una tendencia estadísticamente significativa (12/38 mujeres [31,6%] frente a 29/63 varones [46,1%]; p=0,046).
Puntuación de riesgo de MSC en la miocardiopatía hipertrófica, estratificada por sexo
| Varones (n=179) | Mujeres (n=143) | p | |
|---|---|---|---|
| Puntuación general de riesgo de MSC a los 5 años (%) | 4,33±4,3 | 3,63±3,0 | 0,090 |
| Puntuación de riesgo de MSC a los 5 años <4% | 117 (65,4) | 104 (72,7) | 0,359 |
| Puntuación de riesgo de MSC a los 5 años del 4-6% | 30 (16,8) | 18 (12,6) | |
| Puntuación de riesgo de MSC a los 5 años> 6% | 33 (18,4) | 20 (14,0) |
MSC: muerte súbita cardiaca.
Los valores expresan n (%) o media ± desviación estándar.
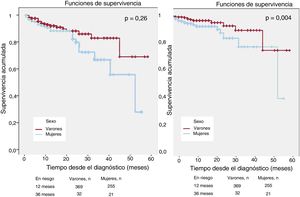
La mortalidad fue del 6,3% (n=65) y la mortalidad CV, del 3,7% (n=39). El análisis de Kaplan-Meier (figura 1) mostró una mayor mortalidad total (el 8,4 frente al 5,0%; p=0,026) y CV (el 5,5 frente al 2,2%; p=0,004) en las mujeres que en los varones. También se identificó mayor mortalidad total entre los pacientes que en el momento del diagnóstico tenían más de 60 años (el 6,1 frente al 3,53%; p=0,033), antecedentes familiares positivos de MSC (el 8,6 frente al 5,1%; p=0,016) y disfunción sistólica (el 9,8 frente al 4,7%; p=0,004). Tras realizar un modelo multivariante, que incluyó un ajuste por las variables asociadas con mortalidad y todas las variables con diferencias estadísticamente significativas entre sexos (tabla 1), el sexo femenino mantuvo la asociación independiente con la mortalidad total (hazard ratio [HR] = 2,05; intervalo de confianza del 95% [IC95%], 1,11-3,75; p=0,021) y la mortalidad CV (HR = 3,16; IC95%, 1,25-7,99; p=0,015).
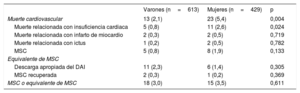
Las mayores mortalidad total y CV observadas entre las mujeres se deben principalmente a una mayor frecuencia de la mortalidad relacionada con IC (el 2,6 frente al 0,8%; p=0,024) (tabla 5). La MSC en mujeres fue numéricamente superior, aunque no estadísticamente significativa (el 1,9 frente al 0,8%; p=0,133). También se observó que no había diferencias significativas en los equivalentes a MSC (el 3,0 frente al 3,5%; p=0,611) (tabla 5).
Causas cardiovasculares de muerte y equivalentes de muerte súbita cardiaca en pacientes con miocardiopatía hipertrófica
| Varones (n=613) | Mujeres (n=429) | p | |
|---|---|---|---|
| Muerte cardiovascular | 13 (2,1) | 23 (5,4) | 0,004 |
| Muerte relacionada con insuficiencia cardiaca | 5 (0,8) | 11 (2,6) | 0,024 |
| Muerte relacionada con infarto de miocardio | 2 (0,3) | 2 (0,5) | 0,719 |
| Muerte relacionada con ictus | 1 (0,2) | 2 (0,5) | 0,782 |
| MSC | 5 (0,8) | 8 (1,9) | 0,133 |
| Equivalente de MSC | |||
| Descarga apropiada del DAI | 11 (2,3) | 6 (1,4) | 0,305 |
| MSC recuperada | 2 (0,3) | 1 (0,2) | 0,369 |
| MSC o equivalente de MSC | 18 (3,0) | 15 (3,5) | 0,611 |
DAI: desfibrilador automático implantable; MSC: muerte súbita cardiaca.
Los valores expresan n (%)
Dadas las diferencias entre ambos sexos en el número de implantes de DAI, la tabla 6 presenta datos relativos a las causas CV de la muerte de pacientes con y sin DAI. Entre los pacientes con DAI (94 varones y 46 mujeres), no se hallaron diferencias estadísticamente significativas. En la tabla 2 del material adicional se muestran las características basales de los pacientes sin DAI: a las mujeres se les diagnosticaba más a menudo IC (el 42,8 frente al 26,9%; p=0,002) e insuficiencia mitral entre moderada y grave (el 19,2 frente al 11,5%; p=0,044). No obstante, no se identificaron otras diferencias por edad (54±19 frente a 49±18 años; p=0,066) o por cualquier otra enfermedad concomitante que pudiera explicar un menor número de implantes de DAI.
Causas cardiovasculares de muerte y equivalentes de muerte súbita cardiaca en pacientes con miocardiopatía hipertrófica con y sin desfibrilador automático implantable
| Con DAI | Varones (n=94) | Mujeres (n=46) | p |
|---|---|---|---|
| Muerte cardiovascular | 4 (4,4) | 3 (6,6) | 0,523 |
| Muerte relacionada con insuficiencia cardiaca | 1 (1,1) | 2 (4,4) | 0,208 |
| Muerte relacionada con infarto de miocardio | 0 | 0 | — |
| Muerte relacionada con ictus | 0 | 0 | — |
| MSC | 3 (3,2) | 1 (2,2) | 0,734 |
| Equivalente de MSC | |||
| Descargas apropiadas del DAI | 11 (11,7) | 6 (13,0) | 0,719 |
| MSC recuperada | 2 (2,1) | 1 (2,2) | 0,986 |
| MSC o equivalente de MSC | 16 (17,0) | 8 (17,4) | 0,895 |
| Sin DAI | Varones (n=519) | Mujeres (n=383) | p |
|---|---|---|---|
| Muerte cardiovascular | 9 (1,7) | 20 (5,2) | 0,003 |
| Muerte relacionada con insuficiencia cardiaca | 4 (0,8) | 9 (2,3) | 0,046 |
| Muerte relacionada con infarto de miocardio | 2 (0.4) | 2 (0,5) | 0,760 |
| Muerte relacionada con ictus | 1 (0,2) | 2 (0,5) | 0,396 |
| MSC | 2 (0.4) | 7 (1,8) | 0,031 |
DAI: desfibrilador automático implantable; MSC: muerte súbita cardiaca.
Los valores expresan n (%).
Si se analiza la MSC clasificada mediante la escala de riesgo de MSC en la MCH, se constata que los pacientes de ambos sexos no sufrieron la MSC cuando se hallaban en la categoría de bajo riesgo. Se constató MSC en 1 mujer (1/18, 5,6%) y 1 varón (1/30, 3,0%) de la categoría de riesgo intermedio (p=0,71) y 3 mujeres (3/20, 15,0%) y 2 varones (2/33, 6,0%) de la categoría de alto riesgo (p=0,28).
DISCUSIÓNEn este registro multicéntrico de MCH, las mujeres tenían un peor pronóstico, con mayores mortalidades total y CV. En el análisis multivariante, el sexo femenino era un predictor independiente de mortalidad. En mujeres era mayor la frecuencia de muerte relacionada con IC. A pesar de tener un riesgo de MSC similar al de los varones, a las mujeres se les realizaron menos implantes de DAI.
En estudios sobre MCH, se incluye con mayor frecuencia a varones que a mujeres7,8,12, pero actualmente se desconoce si la MCH es un reflejo de modificadores genéticos y hormonales, que harían a los varones más vulnerables a la penetrancia de la enfermedad, o un sesgo en las estrategias de cribado/diagnóstico que llevarían a un infradiagnóstico o un diagnóstico tardío en las mujeres13. Perez-Sanchez et al.14 informaron de que el sexo masculino era un factor que llevaba a un diagnóstico precoz en pacientes con mutaciones en el sarcómero, pero no detectaron diferencias por sexo en el pronóstico. Más de la mitad de la población incluida en el registro se sometió a pruebas genéticas9, y los resultados de estas pruebas coincidían con los registros de MCH publicados anteriormente15. No había diferencias entre sexos con respecto al número de pruebas realizadas o los resultados de las pruebas9. Lo mismo sirve para la exclusión de fenocopias8,9. En 2005, Olivotto et al.12 mostraron un predominio de MCH en el sexo masculino sobre el femenino (3:2). A los varones se les diagnosticaba más a menudo de forma fortuita en la exploración clínica sistemática que a las mujeres (el 41 frente al 23%), en quienes el diagnóstico se establecía más tarde (38±18 frente a 47±23 años), principalmente tras el inicio de los peores síntomas (clase NYHA, 1,8±0,8 frente a 1,4±0,6). Estas observaciones fueron corroboradas por otros estudios14,16, y hace poco Geske et al.7 han obtenido las mismas conclusiones en una cohorte de 3.673 pacientes estadounidenses: solo el 45,2% eran mujeres y las diagnosticaron en una fase más sintomática y avanzada de la enfermedad. Según estos resultados, puede especularse que las mujeres estén infrarrepresentadas en las cohortes de MCH a causa de un menor conocimiento de la enfermedad CV en mujeres17,18, de la menor participación en los programas de cribado, realizados principalmente a varones atletas jóvenes19, de una demora en la búsqueda de ayuda médica ante la presencia de síntomas13 y de la menor disposición de los médicos a realizar procedimientos diagnósticos a mujeres, un fenómeno del que ya se ha hablado en otras enfermedades CV13. Además, la información constante sobre el predominio del sexo masculino en las cohortes de MCH y la atención social y de los medios de comunicación a la MCH como una de las principales causas no identificadas de MSC en varones atletas jóvenes18,20 pueden haber contribuido al mayor conocimiento de la MCH en los varones, pero no en las mujeres, y a la idea equivocada entre los médicos de una forma más grave de enfermedad en los varones.
Las mujeres presentan con mayor frecuencia IC, así como disfunción diastólica, insuficiencia mitral, peor concentración de péptido natriurético cerebral y tendencia a un mayor gradiente máximo en el TSVI. Geske et al.7 informaron de que las mujeres tienen una fisiología más obstructiva, lo cual coincide con las observaciones del presente estudio, y se ha visto que la IC en la MCH es más frecuente en los pacientes con enfermedad obstructiva21. La IC con disfunción diastólica es más prevalente en mujeres22 y también se relaciona con la hipertensión23, que también fue más habitual en mujeres en este registro. Esto puede explicar la peor función diastólica de las mujeres a pesar del mayor grosor máximo de la pared del VI observado en los varones. Por otro lado, puede que la prevalencia de obstrucción del TSVI en las mujeres se haya subestimado en este registro, ya que la ecocardiografía de esfuerzo se realizó con menor frecuencia, lo que es también signo de la existencia de un sesgo de sexo.
Este estudio halló mayores mortalidades total y CV en las mujeres, asociadas con una frecuencia significativamente mayor de mortalidad relacionada con IC. Aunque los artículos actuales indiquen una menor incidencia de mortalidad relacionada con la IC en pacientes con MCH, se identificó una mortalidad total relacionada con IC del 2,6% de las mujeres3. Según Melacini et al.24 los síntomas de IC en la MCH evolucionan en 3 vías principales: a) disfunción sistólica del VI; b) obstrucción del TSVI, y c) ausencia de obstrucción con función sistólica conservada. En este tercer subgrupo de pacientes, los síntomas de IC se debían principalmente a disfunción diastólica y se identificó una evolución más acelerada hacia la IC avanzada y el resultado adverso21. Curiosamente, los pacientes con IC progresiva solían ser mujeres. Así pues, la mayor prevalencia de IC y disfunción diastólica puede explicar la mayor mortalidad CV total y de un modo específico la mayor mortalidad relacionada con IC observada en las mujeres del registro de MCH. Las hormonas sexuales también pueden modular el fenotipo de la MCH, como en otras enfermedades CV13,25. Bhupathy et al.26 demostraron una mortalidad aumentada en ratones macho alimentados con fitoestrógenos en un modelo de MCH, lo que indica un posible efecto deletéreo de los estrógenos en la MCH. Olivotto et al.12 mostraron, en un ensayo longitudinal, que el sexo femenino se asociaba de manera independiente con la evolución a las clases funcionales III/IV de la NYHA o a la muerte por IC o ictus. Esto también se observó en los resultados del presente estudio con respecto a la población total. Recientemente, Geske et al.7 demostraron que la supervivencia de las mujeres estadounidenses con MCH es peor que la de los varones, una relación que se mantuvo significativa en los análisis multivariantes. Este estudio corrobora estos hallazgos, pero amplía el análisis que muestra que las mortalidades total y CV eran también mayores en las mujeres europeas con MCH y que el sexo femenino seguía siendo un predictor independiente de la mortalidad total y CV en la MCH tras el modelado multivariante. Pese a ser un registro nacional, los resultados tienen un impacto internacional, ya que varios países del mundo comparten condiciones similares en el tratamiento de esta enfermedad8.
La escala de riesgo de MSC en la MCH identificó a todos los pacientes con bajo riesgo independientemente del sexo. Aunque el riesgo total de MSC fuera el mismo según los factores de riesgo tanto clásicos como no clásicos y la actual puntuación de riesgo de MSC en la MCH1,27, había una diferencia estadísticamente significativa hacia el menor número de implantes de DAI en mujeres. Otros registros también demuestran que en los varones es mayor el número total de implantes de DAI28, lo que habitualmente se explica por la mayor incidencia de cardiopatía isquémica. No obstante, cuando se analizó a los pacientes con MCH e indicación clínica de DAI, tanto por la presencia de 1 o más factores de riesgo clásicos o por una puntuación de riesgo de MSC en la MCH ≥ 4%, parecía que a las mujeres se les realizaban menos implantes de DAI que a los varones (y este es, por lo que se sabe, el primer estudio que demuestra este factor). Aunque las mujeres fueran en general mayores, la frecuencia de enfermedades concomitantes no era significativamente distinta, lo que podría haber justificado el número de implantes distinto entre sexos (tabla 1 y tabla 1 del material adicional). Las mujeres eran mayores cuando sufrieron los síntomas, y la edad disminuye el impacto de algunos factores de riesgo, como la taquicardia ventricular (puesto que el riesgo conferido por estos factores es inversamente proporcional a la edad), pero la puntuación de riesgo de MSC en la MCH incluye esta variable y sigue sin justificar un menor número de implantes en mujeres.
Así pues, se especula que para las mujeres se recomiendan menos los implantes de DAI por las mismas razones ya conjeturadas de su infrarrepresentación en las cohortes de MCH, lo que lleva a los médicos a ser menos conscientes del riesgo de MSC y de la gravedad de la enfermedad en las mujeres. Debería realizarse un ensayo con mayor potencia estadística, diseñado específicamente para tratar esta cuestión y esclarecer si también se identifican diferencias en el número de implantes de DAI.
Los estudios sobre miocardiopatía dilatada también han mostrado que las mujeres se hallan infrarrepresentadas29 y es menos probable que reciban un DAI comparadas con los varones, aunque sean idóneas30. Sorprendentemente, el seguimiento de pacientes con MCH mostró que entre las mujeres sin DAI la mortalidad por MSC es mayor que en los varones sin DAI. Tomados en conjunto, el infratratamiento con DAI, aunque con un riesgo de MSC similar, y la mayor frecuencia de MSC en mujeres sin DAI indican que el infratratamiento con implante de DAI tiene un impacto pronóstico negativo en las mujeres. Estos resultados destacan que las mujeres deben ser candidatas a las mismas estrategias de prevención, en función del riesgo de MSC, que los varones. Aun no se ha determinado la prevalencia de MSC en las mujeres cuando la estrategia de prevención de MSC ofrecida a ambos sexos es la misma.
Limitaciones del estudioEste estudio tiene algunas limitaciones. El estudio puede proporcionar una perspectiva sesgada de la población con MCH porque, de los 29 centros que incluían a pacientes, había 3 con más de 100 pacientes cada uno. Las diferencias entre los pacientes incluidos por centro ya se han analizado en un ensayo publicado previamente: en los centros de gran volumen (> 100 pacientes, n=3), los pacientes eran más jóvenes, con más casos de MCH hereditaria y se realizaban más pruebas genéticas, cribado hereditario y exclusión de fenocopias que en los centros de poco volumen (< 15 pacientes, n=16). No obstante, no se observaban diferencias importantes en los resultados entre centros8.
Este estudio incluye a pacientes principalmente sintomáticos que recibieron atención médica. La frecuencia de MSC también puede haberse subestimado, ya que no se incluyó a los pacientes fallecidos antes de diagnosticarles la enfermedad. Estos factores pueden haber llevado a un sesgo en la supervivencia, ya que las formas de MCH cuya primera manifestación importante es la MSC no se incluyeron en el registro. Con respecto a los dispositivos implantados, no se registraron los motivos del implante de marcapasos, pero el número de marcapasos implantados fue similar en ambos sexos. Cuando no se implanta un DAI a un paciente, no se hace la obligada pregunta sobre si no se le propuso o el paciente lo rechazó. Los factores de riesgo no confieren un riesgo estático a lo largo del tiempo, y cuando se analizó el perfil de riesgo de MSC con factores de riesgo clásicos no se disponía de una revaluación a lo largo del tiempo para cada paciente del registro. En consecuencia, no se pudo incluir en el análisis el tiempo expuesto a cada factor de riesgo y la variabilidad del riesgo durante la vida del paciente, lo que puede alterar la percepción sobre la población realmente en riesgo en cada momento. Además, no pudo calcularse la puntuación de riesgo de MCH de toda la población incluida, porque no se dispuso simultáneamente de todas las variables de todos los pacientes.
No fue posible obtener un análisis prospectivo de los pacientes durante todos los años ni de la correspondiente clase de la NYHA máxima. Los pacientes de más edad no suelen estar en NYHA I sin hallarse necesariamente en un estado agravado de IC, lo que puede originar el sobrediagnóstico por IC.
CONCLUSIONESEn este registro nacional de MCH, las mujeres mostraron diferencias clínicas, terapéuticas y de pronóstico. Eran mayores y estaban más sintomáticas que los varones y su pronóstico era peor, con una mayor mortalidad CV y total, y con más defunciones relacionadas con IC. En el modelado multivariante, el sexo femenino mantuvo la asociación independiente con la mortalidad total y CV. A pesar de tener un riesgo de MSC similar al de los varones, a las mujeres se les realizaron menos implantes de DAI. Estos datos destacan la necesidad de un enfoque clínico mejorado para las mujeres con MSC, con un mayor conocimiento de la enfermedad, tratamiento específico de la IC y un número de implantes de DAI apropiado y oportuno según la clasificación del riesgo de MSC.
- –
La miocardiopatía hipertrófica es una enfermedad cardiaca hereditaria, con frecuencia transmitida como un rasgo autosómico dominante, pero con un ligero predominio masculino.
- –
En 2017 se informó de que, en una población estadounidense, al parecer las mujeres tenían un peor pronóstico, lo que posiblemente se relaciona con un sesgo por sexo.
- –
Este estudio demuestra que el sexo femenino de los pacientes con MCH se asocia de manera independiente con un peor pronóstico en cuanto a mortalidad total y cardiovascular.
- –
Las mujeres realizaron menos pruebas de esfuerzo y recibieron menos DAI pese a un riesgo de muerte súbita cardiaca similar al de los varones.
- –
Estos datos destacan la necesidad de cambiar el enfoque clínico actual para las mujeres con MCH, y centrar la atención en un mejor conocimiento de la enfermedad, el tratamiento específico de la IC y un número de implantes de DAI apropiado y oportuno según la clasificación del riesgo de MSC.
No hay conflictos de intereses que declarar.
Los autores desean agradecer a J. Nicolas Lopez-Canoa su contribución lingüística y la revisión del manuscrito.