La continua progresión tecnológica que experimenta la medicina se produce cada vez a mayor velocidad, lo que exige una actualización constante del profesional de la salud. La nueva ola de tecnologías que está abriéndose camino en la práctica clínica incluye: a) salud asistida por el móvil (mHealth) o dispositivos miniaturizados que permiten la detección constante de parámetros biológicos, a cualquier hora y en cualquier lugar, de cientos de miles de pacientes a la vez; b) inteligencia artificial impulsada por nuevas técnicas de aprendizaje profundo que están batiendo a médicos expertos en su propio campo (pruebas de imagen o electrocardiografía); c) impresión tridimensional que permite vislumbrar un mundo de prótesis cardiovasculares adaptadas a cada paciente; d) medicina de sistemas, que apoyándose en el big data abrirá las puertas a la medicina personalizada, aunando en modelos matemáticos de gran complejidad datos genéticos, epigenéticos, ambientales, clínicos y sociales para diseñar tratamientos de precisión. Esta revisión pretende resumir la evidencia sobre los últimos avances tecnológicos basados en tecnologías de la información y ciencias de la computación aplicados a la cardiología y esbozar un mapa que de un solo vistazo permita tener una impresión general del horizonte hacia el que va a progresar la cardiología en los próximos años.
Palabras clave
La irrupción de las tecnologías de la información, las comunicaciones y las ciencias de la computación en la segunda mitad del siglo xx ha supuesto una revolución que no ha dejado de surtir de avances tecnológicos a la sociedad en general y la cardiología en particular.
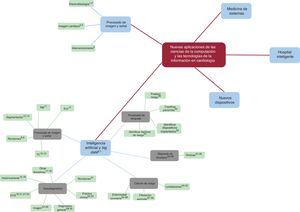
Esta revolución está lejos de detenerse, continúa de manera constante aportando innovaciones en las que es de vital importancia mantenerse actualizado debido al potencial disruptivo que muchas de ellas aportan. Por ese motivo, en este trabajo se pretende hacer una revisión del panorama actual en cuanto a los avances tecnológicos más recientes que afectan a la cardiología desde el mundo de las ciencias de la computación y las tecnologías de la información. Se ha pretendido no solo recopilar los ejemplos más recientes y significativos, sino además clasificarlos en un mapa conceptual en el que se ha optado por establecer 5 categorías principales (figura 1): a) procesado de imagen y señal; b) inteligencia artificial (IA) y los datos masivos (big data);c) nuevos dispositivos; d) hospital inteligente, y e) medicina de sistemas.
PROCESADO DE IMAGEN Y SEÑALEl avance de las ciencias de la computación resulta en constantes mejoras de los sensores y los instrumentos de imagen médica. Aunque representan la faceta más continuista y menos disruptiva de la tecnología, no por ello resultan menos útiles. Muchos de estos avances son incorporados por empresas en dispositivos protegidos por patentes; la literatura científica también está plagada de aplicaciones en varias áreas (figura 2):
- •
Electrofisiología: nuevos algoritmos para mejorar los dispositivos implantados, como la reducción de choques inapropiados1 o la eliminación de los artefactos producidos por los movimientos de reanimación cardiopulmonar en la señal del electrocardiograma (ECG) de los desfibriladores automáticos2.
- •
Imagen no invasiva: técnicas que permiten efectuar automática o semiautomáticamente mediciones que hasta ahora se habían realizado a mano, con lo que se reduce sensiblemente el tiempo empleado por un operador humano. Se puede, por ejemplo, identificar en una tomografía computarizada (TC) los parámetros necesarios para planificar el implante percutáneo de una prótesis3 o segmentar la orejuela izquierda4 hasta 100 veces más rápido.
- •
Intervencionismo: un ejemplo es el cálculo del QFR (quantitative flow ratio), una estimación funcional de lesiones coronarias que se basa en una reconstrucción tridimensional de la angiografía y no requiere procedimientos de medición adicionales5.
Mapa conceptual de avances en el procesado de imagen y señal e inteligencia artificial y big data. Las referencias bibliográficas correspondientes a cada concepto se muestran en la figura en formato superíndice. ECG: electrocardiograma; RM: resonancia magnética; TC: tomografía computarizada.
El concepto de IA es difuso, pero la definición de Kaplan6 es un buen punto de partida: «la capacidad de un sistema para interpretar datos externos, aprender de dichos datos y extraer conclusiones que le permitan alcanzar sus metas específicas a través de una adaptación de su comportamiento».
Existen, además, multitud de diferentes términos relacionados con la IA que muchas veces inducen a confusión, como «aprendizaje automático» (machine learning, la parte de la IA que permite analizar un conjunto de datos para extraer conclusiones), «big data» (que estrictamente se refiere tan solo a la gestión y la explotación de grandes volúmenes de datos, pero que resulta una tarea para la cual hoy en día suelen utilizarse técnicas de IA) o «aprendizaje profundo» (deep learning, un subconjunto de las técnicas de aprendizaje automático que se centra en el aprendizaje a partir de grandes volúmenes de datos).
Hablando en términos generales, la IA consume habitualmente más recursos informáticos que otras técnicas de computación. Sin embargo, está ofreciendo muy buenos resultados en muchos campos, y a día de hoy contamos con ordenadores muy potentes que pueden manejar la carga de computación adicional.
La aplicación de la IA a la cardiología, por lo tanto, es ya una realidad, como se demuestra en la revisión de Dorado-Díez et al.7, donde se clasifican diferentes aplicaciones por áreas de la cardiología. En este trabajo, hemos optado por agrupar estas aplicaciones según las funciones que la IA lleva a cabo, para ofrecer una visión general de lo que la IA puede aportar independientemente de la especialidad (figura 2).
Big data y técnicas de imagen en cardiologíaEl área de imagen cardiaca es particularmente adecuada para la aplicación de estas técnicas por el gran volumen de datos estructurados que se almacena en las imágenes. Existen multitud de ejemplos ilustrativos8,9, de los que se puede destacar: un algoritmo para la medición del tejido adiposo epicárdico en la TC10 que permite reducir el tiempo de análisis de 10 min a 26 s, con un coeficiente de correlación con el experto humano de R=0,92; un sistema para calcular el volumen de fibrosis miocárdica en la resonancia magnética (RM), con una correlación de R=0,88 con expertos humanos en 0,15 s por imagen11, o un algoritmo para calcular las puntuaciones de calcio en la TC aplicado a 7.240 estudios de naturaleza muy variada12.
El problema de la segmentación automática de las estructuras cardiacas ha atraído también un enorme interés. Algunos algoritmos en imagen de RM alcanzan correlaciones de hasta 0,98 con los expertos humanos para algunas tareas concretas13, y se vislumbra un futuro cercano en el que esta segmentación en la RM sea totalmente automática. En ecocardiografía, aun resultando un problema más complejo, también se están alcanzando resultados espectaculares, como el sistema de segmentación tridimensional del ventrículo izquierdo propuesto por Dong et al.14.
AutodiagnósticoLa aplicación de la IA que surge de manera más natural probablemente sea el autodiagnóstico: determinar qué enfermedad padece un paciente sin la supervisión de un médico humano. Las primeras incursiones en sistemas de autodiagnóstico hace algunas décadas solían ser sistemas deterministas que aplicaban conocimiento experto (reglas escritas directamente por los propios médicos), y hasta los años noventa la impresión general era que estos sistemas automáticos eran costosos y complejos, y en realidad no ofrecían buenos resultados15,16.
Los sistemas más modernos utilizan en cambio aprendizaje automático: se entrena al sistema presentándole una serie de casos cuyo diagnóstico ya es conocido, de manera que el algoritmo va aprendiendo las características que presentan los diferentes grupos sin que necesariamente un humano tenga que conocer dichas características. Una vez entrenado, el sistema puede buscar esos parámetros que ha aprendido en casos cuyo diagnóstico es desconocido. La gran ventaja es que la IA puede identificar relaciones matemáticas complejas entre los parámetros que a un humano resultarían muy difíciles de identificar a simple vista.
Los sistemas de autodiagnóstico actuales se encuentran ya en condiciones de competir con los médicos humanos. Se han alcanzado éxitos en variedad de áreas de la medicina, con sistemas que baten a dermatólogos expertos la hora de identificar tumores en fotografías de lesiones de piel17 o a oftalmólogos expertos en la detección de afecciones urgentes de retina18.
En cardiología, las señales eléctricas del ECG son muy convenientes para su procesado con técnicas de computación, y la llegada de la IA ha generado varios éxitos, como un espectacular sistema capaz de detectar a los pacientes que padecen fibrilación auricular (FA) analizando tan solo un ECG estándar de 10 s en ritmo sinusal19. Pero además, multitud de soluciones más convencionales20 mejoran las herramientas existentes hasta ahora, como por ejemplo la identificación de 12 tipos de arritmias en ECG ambulatorios de 1 derivación con una precisión un 6% mayor que un panel de 3 expertos21.
En el campo del procesado de imagen, se han desarrollado algoritmos capaces de alcanzar una precisión del 93% en el diagnóstico del infarto agudo de miocardio en la TC22, obtener resultados comparables a los de un experto y mejores que los de un residente en la detección de anomalías de la contractilidad regional en el ecocardiograma23, detectar en la RM infarto de miocardio crónico con sensibilidad y especificidad del 90 y el 99% respectivamente24 o el completísimo trabajo de Zhang et al.25, en el que se obtienen excelentes resultados en el autodiagnóstico de la miocardiopatía hipertrófica, la amiloidosis cardiaca y la hipertensión arterial pulmonar. Como resumen, Litjens et al.26 nos ofrecen una revisión exhaustiva de más de 80 técnicas diferentes para el análisis automático de imagen cardiaca.
La mayoría de las herramientas de autodiagnóstico presentan las siguientes características:
- •
La IA lleva a cabo tareas muy concretas con datos muy específicos, y no es habitual encontrar herramientas que integren varias fuentes de datos diferentes ni puedan llevar a cabo diagnósticos generales. De hecho, hay ejemplos18 de que la IA puede superar al experto interpretando una prueba concreta, pero la situación se revierte en cuanto se incluyen otros datos generales como la historia del paciente.
- •
Es obvio que la IA está lejos de poder reemplazar a los médicos humanos. Sin embargo, existe un espacio muy importante que puede ocupar en la práctica clínica actual:
- a.
Herramientas de asistencia a los profesionales, que permitan ahorrar tiempo a la hora de realizar ciertas tareas sencillas y repetitivas.
- b.
Herramientas de triaje, para una clasificación inicial en atención primaria que descargue a las especialidades.
- c.
Nuevas herramientas diagnósticas mejoradas, como por ejemplo, mejorar a la fracción aminoterminal del propéptido natriurético cerebral (NT-proBNP) como herramienta diagnóstica de la disfunción ventricular utilizando un algoritmo que procesa el ECG27.
Un ejemplo notable de las dudas que despierta la IA para el diagnóstico general es el sistema Watson (IBM, Estados Unidos), que se ha aplicado al diagnóstico y la recomendación de tratamientos contra el cáncer. Aunque hay estudios con resultados prometedores, con hasta un 93% de consenso con los expertos28, también ha recibido críticas importantes dentro29 y fuera30 de la comunidad científica que ponen en duda la relevancia de esas cifras, incluidos informes internos de IBM sobre casos en los que la IA recomendaba tratamientos erróneos o peligrosos.
- •
La IA es, en el mejor de los casos, tan buena como los datos de los que aprende. Lo que significa que cualquier sesgo introducido en la colección de casos de entrenamiento se reproducirá en el resultado final.
- •
Precisamente por este motivo, hay que ser muy cuidadosos a la hora de interpretar las precisiones comunicadas en la literatura y examinar con cuidado los datos de validación que se han utilizado. Precisiones muy altas pueden estar falseadas, por ejemplo, por sesgos de selección en los que los casos considerados en la validación tengan una dificultad baja.
El metanálisis de Liu et al.31 compara 82 trabajos diferentes publicados hasta 2019 en los que expertos humanos se enfrentan a sistemas de autodiagnóstico sobre imagen, y concluye que a día de hoy la precisión de los sistemas de autodiagnóstico puede ser equivalente a la de los médicos, pero es necesario ser cautelosos con los métodos de validación y los datos utilizados.
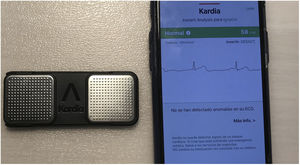
Por último, cabe señalar que estas aplicaciones no se encuentran solo en el terreno de la investigación, sino que están abriéndose paso en la práctica clínica habitual. Hasta 201932, la Food and Drug Administration tenía aprobadas más de 30 aplicaciones o sistemas basados en IA para su uso clínico. Uno de los más populares, sin duda, el dispositivo KardiaMobile (AliveCor, Estados Unidos) aprobado por la Food and Drug Administration para la detección de FA33 (figura 3).
Epidemiología y cálculo del riesgoEl cálculo de índices de riesgo es una práctica habitual que permite establecer un pronóstico para el paciente e identificar las posibles consecuencias de tomar una u otra opción en su tratamiento. Tradicionalmente, el cálculo de estos índices de riesgo se ha realizado con herramientas estadísticas. Aunque la aplicación de la IA en este campo sigue una metodología similar34 (se construye un modelo matemático que relaciona unas variables de entrada con otra de salida que se desea pronosticar), la IA presenta una ventaja fundamental: tiene capacidad para apreciar relaciones más complejas que esas herramientas estadísticas utilizadas habitualmente, lo que lleva a predicciones más precisas.
La literatura científica ya presenta evidencia sólida a favor de estos algoritmos de IA. Existen, por ejemplo, índices de riesgo en enfermedad coronaria que mejoran los métodos estadísticos en hasta un 25%35,36. En un campo tan importante como es la FA, donde no existe un índice concluyente basado en IA, se alzan voces que apuntan la necesidad de iniciar estudios en esta dirección37, como los ya realizados con éxito en pequeñas cohortes38,39.
A la luz de estos datos, se pueden resumir las siguientes conclusiones:
- •
El potencial de la IA en la predicción del riesgo es enorme y se ha demostrado que puede superar ampliamente a los métodos tradicionales.
- •
La gran desventaja es que los modelos generados por IA no son directamente interpretables como lo son las fórmulas matemáticas estadísticas.
- •
Igual que los modelos estadísticos, los modelos de IA serán tan buenos como los datos con que se construyan e integrarán cualquier sesgo que hubiera en ellos.
- •
La mayor complejidad de la IA supone que normalmente requiere mayor cantidad de datos para obtener buenos resultados. La IA puede identificar información que se escapa a otros métodos, pero no puede «hacer magia» y extraer información que simplemente no está en los datos40. Por ello, si los datos son demasiado sencillos, se puede obtener solo una mejora marginal respecto a la estadística41 o incluso peor precisión, como en la predicción de mortalidad tras el implante percutáneo de prótesis aórtica de Hernandez-Suarez et al.42.
Una de las más disruptivas aplicaciones de la IA es el mapeo de fenotipos. A la hora de estudiar una enfermedad, normalmente se analizan las características de los pacientes para clasificarlos en diferentes fenotipos correspondientes a subdivisiones o estadios, para después estudiar cada uno de esos fenotipos individualmente. La IA permite llevar a cabo este fenotipado de una manera mucho más exhaustiva y precisa, teniendo en cuenta parámetros que ningún investigador humano sería capaz de correlacionar, aunque al precio de tener que aceptar que una calculadora que efectúa operaciones de difícil comprensión será lo que determine la clasificación de cada paciente.
El principal ejemplo es el trabajo de Shah et al.43, en el que, mediante técnicas de IA, fueron capaces de encontrar 3 fenotipos claramente diferenciados en su pronóstico y su mortalidad sobre una entidad heterogénea y esquiva como la insuficiencia cardiaca con fracción de eyección conservada. Esto supone un paso de gigante hacia la estratificación de los pacientes y el establecimiento de tratamientos óptimos para cada grupo.
El área de la imagen de nuevo es especialmente propicia para esta aproximación. La cantidad de parámetros radiológicos imaginables es muy amplia. Varios algoritmos son capaces de extraer sus propios parámetros a partir del análisis de imagen para luego determinar grupos de pacientes con similitudes en esos parámetros, y predecir mejor su evolución, la hipertrofia ventricular a partir de la TC44, el riesgo cardiovascular a 5 años a partir de una TC coronaria45 o la hipertensión pulmonar en la RM46.
La importancia de estas técnicas de análisis es capital para que la cardiología pueda aprovechar toda la potencia de las ciencias «ómicas» (genómica, proteómica)47. Poder incorporar estos datos al proceso clínico cardiovascular representaría una nueva era, en términos de precisión diagnóstica y terapéutica, y para la identificación de circuitos metabólicos y causas fisiológicas48.
Procesado de lenguaje naturalA pesar de la tendencia general hacia la construcción de bases de datos más estructuradas, gran parte de la información relacionada con la práctica médica se encuentra en forma de texto libre en las históricas médicas. Por fortuna, existe una parte de la IA conocida como procesado de lenguaje natural, capaz de analizar esos textos libres y extraer de ellos información significativa.
Algunas aplicaciones permiten analizar las historias para predecir el riesgo49 o extraer y clasificar síntomas para categorizar a los pacientes50. Dos ejemplos interesantes en cardiología: un algoritmo capaz de superar el valor predictivo de las encuestas y los códigos de procedimiento en la identificación de factores de riesgo de muerte súbita en cardiopatía hipertrófica51, y otro que puede detectar la presencia de dispositivos implantados no compatibles con la RM con una precisión del 91%52.
Así como otros campos presentan variedad de aplicaciones clínicas reales y exitosas a día de hoy, el procesado de lenguaje natural se encuentra aún en una fase en la que tímidamente va saliendo del entorno de la investigación.
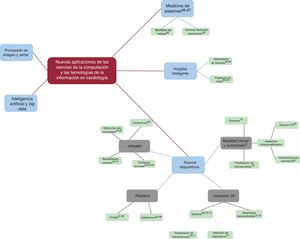
NUEVOS DISPOSITIVOSHasta este punto del trabajo se ha presentado principalmente la parte software de las últimas tendencias. En esta sección en cambio se considerarán los nuevos desarrollos producidos en el campo del hardware (figura 4).
Se entiende por mobile health o mHealth la utilización de dispositivos y sensores móviles para facilitar la atención sanitaria constante y ubicua: aparatos inteligentes que constituyen una primera línea de cuidados que está activa 24 h al día y viaja con el paciente donde quiera que vaya, capaz de realizar tareas de vigilancia de la salud sin intervención humana. Estos dispositivos inteligentes incluyen aparatos médicos específicos como desfibriladores implantables, pero también teléfonos, relojes, ropa y pequeños sensores inteligentes que pueden llevarse encima en todo momento, que se han hecho muy populares y pueden aprovecharse para:
- •
La monitorización y comunicación permanente con los pacientes.
- •
Facilitar la implicación del paciente en su propio tratamiento.
- •
Monitorizar grandes poblaciones.
En el tratamiento de la FA, por ejemplo, existen dispositivos inteligentes para detectar episodios en pacientes en riesgo con precisiones>90%33,53, y se ha estudiado cómo el seguimiento y la comunicación constante a través una plataforma móvil mejoran la adherencia y la satisfacción con los anticoagulantes y la calidad de vida en general54.
En rehabilitación cardiaca, hay prototipos con demostradas mejoras en la capacidad funcional, el consumo de oxígeno y los hábitos de ejercicio a largo plazo al utilizar plataformas online y teléfonos inteligentes55-57.
Además, esta tecnología es perfecta para seguimientos masivos de la población, ya sea para fomentar estilos de vida saludables58 o para detectar arritmias potencialmente peligrosas59, si bien estas aplicaciones a gran escala probablemente precisen ensayos de mayor envergadura.
Muchas soluciones de mHealth se encuentran actualmente en etapas tempranas de su desarrollo y, pese a su enorme potencial, sigue siendo necesario considerarlas con cautela. Existen ensayos que han sido incapaces de demostrar los potenciales beneficios de algunas plataformas60, aunque en estos casos suelen identificarse serias limitaciones metodológicas, como seguimientos cortos o poblaciones de avanzada edad.
RobóticaUna de las tendencias más disruptivas probablemente sea la robotización del intervencionismo cardiaco. En otras áreas de la cirugía, con el robot da Vinci (Abex, España) se han demostrado ventajas frente a la cirugía convencional61 e incluso en cirugía cardiaca, ya que permite cierres de comunicaciones interauriculares con resultados similares62.
A día de hoy, el cateterismo robotizado está empezando a ofrecer evidencia de no inferioridad en la angioplastia63, mientras que aporta algunas ventajas64, como menor incidencia de dilatación más allá de los bordes del stent65, la capacidad de llevar a cabo intervenciones de manera telemática66, y muy especialmente que el cardiólogo puede recibir hasta un 95% menos radiación67, lo que reduce también los problemas ergonómicos por el peso de los equipos de protección.
En el futuro, gracias a la integración con la IA, se espera que los robots puedan ofrecer asistencia avanzada durante el procedimiento, alertas tempranas ante posibles complicaciones o movimientos inteligentes automatizados68. Aun así, a día de hoy existen importantes limitaciones, como la incompatibilidad con los equipos de cateterismo, limitaciones para llevar a cabo intervenciones complejas, y la necesidad de ejecutar el acceso arterial manualmente64.
Impresión tridimensionalLa generación de modelos volumétricos impresos a partir de pruebas de imagen de pacientes reales permite a los médicos examinar con sus propias manos una representación de cada anatomía concreta (figura 5). Esto tiene múltiples aplicaciones69:
- •
Preparación y planificación de intervenciones70,71.
- •
Selección de dispositivos óptimos para anatomías concretas72.
- •
Docencia.
- •
Pruebas de nuevos dispositivos.
Aunque se han comunicado múltiples casos, la adopción de la impresión tridimensional (3D) como parte de la práctica clínica habitual requiere estudios con gran volumen de pacientes que determinen las ventajas de la técnica en términos cuantitativos73,74. A largo plazo, la impresión 3D en biomateriales podrá utilizarse para producir prótesis personalizadas, como stents coronarios75 o parches cardiacos vascularizados y perfundibles76.
Realidad virtual y aumentadaLa realidad virtual permite, a través de unas gafas que integran sensores de posición y movimiento, la inmersión del usuario en un mundo tridimensional generado por ordenador. La realidad aumentada, en cambio, consiste en utilizar unas gafas con una pantalla transparente en la que se proyecta información que enriquece la visión del mundo real con información adicional. La tecnología de realidad virtual se encuentra ya en una etapa madura, pero la realidad aumentada en cambio está en una fase más experimental, donde el dispositivo más popular, las gafas HoloLens (Microsoft, Estados Unidos) aún son una opción cara y no muy conocida (figura 6).
La aplicación de ambas a la cardiología se centra principalmente en 4 vertientes77:
- •
Docencia a través de la simulación78.
- •
Rehabilitación.
- •
Planificación previa al procedimiento79.
- •
Asistencia durante el procedimiento, integrando en la visión que tiene el intervencionista del paciente reconstrucciones 3D de estructuras anatómicas como guía de ablaciones80 o procedimientos estructurales81.
Pese a que aún se trata de casos anecdóticos, es de esperar que progresivamente los fabricantes vayan incluyendo este tipo de equipos en sus ofertas y que, por lo tanto, se vayan integrando en la práctica habitual. En 2019, por ejemplo, Philips presentó un sistema que integraba su sistema de angiografía Azurion con las gafas HoloLens.
EL HOSPITAL INTELIGENTELa gestión de todos los procesos que integran la atención sanitaria dentro de un hospital constituye un reto muy complejo. Las nuevas tecnologías (figura 4) también pueden ayudar en este campo aportando herramientas para optimizar automáticamente la forma de organizar trabajo, recursos, tiempo y personal y para facilitar el flujo de información entre todos los actores de la atención sanitaria, pacientes, personal del hospital, médicos, etc.
La implementación de estos medios electrónicos para la gestión de los centros es lo que se conoce como hospital inteligente (smart hospital), el modelo del hospital del futuro en el que todos los procesos estén monitorizados y optimizados electrónicamente. La literatura ofrece multitud de ejemplos, como algoritmos para organizar quirófanos, salas y consultas82,83, predecir la duración de las estancias de los pacientes84 o los ingresos diarios por problemas cardiorrespiratorios85.
MEDICINA DE SISTEMASLa medicina de sistemas (figura 4) es un intento de integrar modelos matemáticos genéticos, moleculares, celulares, de tejidos, de órganos y de sistemas en un único modelo humano fisiológico virtual personalizable. Utilizando este modelo sería posible pronosticar los efectos específicos de cada intervención en un paciente determinado, identificar las posibles interacciones cruzadas en cada parte del cuerpo y cada función del paciente. Esto representa la medicina personalizada definitiva y muchos lo consideran el próximo gran cambio de paradigma en medicina86,87.
Aunque la ciencia actual está aún muy lejos de alcanzar este objetivo, ya se están dando los primeros pasos en esta dirección, con modelos computacionales personalizados del corazón para estimar el pronóstico de pacientes que han sufrido un infarto88 o estudiando los factores genéticos, moleculares y ambientales que llevan a sufrir hipertensión a cada paciente individual89.
CONCLUSIONESA lo largo de este trabajo se ha repasado una serie de tecnologías con un enorme potencial disruptivo. En el momento actual, el principal punto que destacar es el aterrizaje de la IA y la mHealth: tras muchos años de promesas, la medicina de los datos es ya una realidad, y ya está cambiando el día a día del cardiólogo. No es previsible que súbitamente los cardiólogos sean sustituidos por la IA, pero es muy probable que a corto plazo aparezcan herramientas que vayan automatizando tareas sencillas. Al especialista se le relevará de un volumen de trabajo relacionado con consultas repetitivas y habituales, y podrá concentrarse en los casos más complejos.
Otras tecnologías, en relación con dispositivos, parecen estar también maduras, pero no terminan de encontrar una aplicación clínica generalizada. El uso masivo de la mHealth en la vigilancia de la población en general o la utilización de la realidad virtual son buenos ejemplos de la existencia de dispositivos perfeccionados y baratos, pero no terminan de adecuar un nicho de utilidad. Parte del problema es que faltan ensayos a gran escala que demuestren beneficios cuantitativos. La robotización y la impresión 3D parecen estancadas a medio camino, con nichos donde demuestran extraordinaria utilidad, pero sin llegar aún a un uso generalizado. Su extensión dependerá en gran medida de la aparición de aplicaciones y ventajas que les permitan hacerse imprescindibles.
La auténtica revolución vendrá probablemente con la medicina de sistemas. Sus modelos matemáticos integrados sustituirán la evidencia basada en la estadística por una medicina personalizada en la que se podrá identificar la causa de cada síntoma en cada paciente y predecir exactamente el efecto que tendrá cada tratamiento determinado. Sin embargo, esta tecnología aún está dando sus primeros pasos y pasará mucho tiempo hasta que pueda alcanzarse este horizonte.
CONFLICTO DE INTERESESNo se declara ninguno.
Al Dr. Alfredo Redondo, cardiólogo del Hospital Clínico de Valladolid y responsable del VAL 3D Lab por proveer parte de las imágenes que ilustran este artículo.