La actual guía de la Sociedad Europea de Cardiología para el tratamiento del shock cardiogénico (SC) posiciona la asistencia circulatoria mediante oxigenador extracorpóreo de membrana (ECMO) venoarterial (ECMO-VA) como último escalón terapéutico tras los fármacos inotrópicos y la ventilación mecánica invasiva y es una técnica factible en condiciones de emergencia1. En el ámbito de la patología respiratoria, el uso de asistencia con ECMO venovenoso implantado en pacientes conscientes y, por lo tanto, con respiración espontánea (el denominado «awake ECMO») está cada vez más extendido. Esta modalidad pretende evitar la intubación, la ventilación mecánica invasiva, la sedación y la inmovilidad concomitantes, y hay evidencia de mejores resultados posoperatorios en complicaciones y mortalidad2,3. En la literatura actual, la evidencia sobre esta estrategia con ECMO-VA en caso del SC es muy escasa, solo casos aislados y 3 series pequeñas (2 en adultos y 1 en niños) que muestran que su uso es viable y con buenos resultados como rescate del SC en afección aguda (23 pacientes; supervivencia a 6 meses, 70,8%)4 y en pacientes con insuficiencia cardiaca avanzada en clase INTERMACS 1 pendientes de asistencia como puente al implante del dispositivo (19 pacientes; supervivencia al año, 84,2%)5.
Se presenta la experiencia positiva en nuestro centro con un grupo de pacientes con SC tratados con la estrategia awake ECMO-VA. De los 73 ECMO-VA implantados entre 2010 y 2018 por SC, 10 (13,7%) se colocaron en ventilación espontánea. El 70% eran varones, con una mediana [rango intercuartílico] de edad de 50 [47-57] años. La mediana de puntuación APACHE-II fue 16 [9-19] y la de SAPS-II, 30 [25-32]. La etiología del SC más frecuente fue la descompensación de insuficiencia cardiaca avanzada en pacientes en espera de trasplante (7 casos; el 71% en INTERMACS 1 y el 29%, en INTERMACS 2) y las restantes, 1 infarto agudo de miocardio en clase Killip IV, 1 miocardiopatía séptica y 1 miocarditis aguda (los 3 en clase INTERMACS 1). El objetivo de la asistencia en los primeros 8 era como puente al trasplante (7) o a una decisión (1), de los que 6 (75%) llegaron a recibir el trasplante y 2 fallecieron durante la asistencia (1 por ictus maligno y 1 por fallo multiorgánico refractario), mientras que en la miocardiopatía séptica y la miocarditis aguda era como puente a la recuperación. En 8 de los pacientes se implantó balón de contrapulsación intraaórtico, 5 ya tenían un implante previo a la asistencia con ECMO (aquellos en INTERMACS 1), mientras que durante la asistencia fueron necesarios 3 para descarga del ventrículo izquierdo (tabla 1).
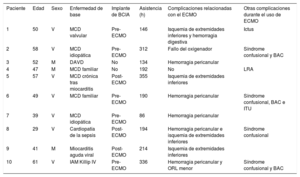
Resumen de pacientes y curso clínico
| Paciente | Edad | Sexo | Enfermedad de base | Implante de BCIA | Asistencia (h) | Complicaciones relacionadas con el ECMO | Otras complicaciones durante el uso de ECMO |
|---|---|---|---|---|---|---|---|
| 1 | 50 | V | MCD valvular | Pre-ECMO | 146 | Isquemia de extremidades inferiores y hemorragia digestiva | Ictus |
| 2 | 58 | V | MCD idiopática | Pre-ECMO | 312 | Fallo del oxigenador | Síndrome confusional y BAC |
| 3 | 52 | M | DAVD | No | 134 | Hemorragia pericanular | |
| 4 | 47 | M | MCD familiar | No | 192 | No | LRA |
| 5 | 57 | V | MCD crónica tras miocarditis | Post-ECMO | 355 | Isquemia de extremidades inferiores | |
| 6 | 49 | V | MCD familiar | Pre-ECMO | 190 | Hemorragia pericanular | Síndrome confusional, BAC e ITU |
| 7 | 39 | V | MCD idiopática | Pre-ECMO | 86 | Hemorragia pericanular | |
| 8 | 29 | V | Cardiopatía de la sepsis | Post-ECMO | 194 | Hemorragia pericanular e isquemia de extremidades inferiores | Síndrome confusional |
| 9 | 41 | M | Miocarditis aguda viral | Post-ECMO | 214 | Isquemia de extremidades inferiores | |
| 10 | 61 | V | IAM Killip IV | Pre-ECMO | 336 | Hemorragia pericanular y ORL menor | Síndrome confusional y BAC |
BAC: bacteriemia asociada con catéter intravascular; BCIA: balón de contrapulsación intraaórtico; DAVD: displasia arritmogénica del ventrículo derecho; ECMO: oxigenador extracorpóreo de membrana; IAM: infarto agudo de miocardio; ITU: infección del tracto urinario; LRA: lesión renal aguda; M: mujer; MCD: miocardiopatía dilatada; ORL: otorrinolaringológico; V: varón; VMI: ventilación mecánica invasiva.
Todos los ECMO se implantaron en la unidad de cuidados intensivos con configuración femoro-femoral, salvo 1 en quirófano con configuración femoroaxilar. La mediana de días de asistencia fue 8 [6,5-11,9]. Se pudo destetar del ECMO al 80% de los pacientes (todos salvo los 2 fallecidos), con una supervivencia general en la unidad de cuidados intensivos del 60 y el 50% al alta hospitalaria, similar a la de nuestra serie general de ECMO-VA6. Durante la asistencia, 3 pacientes precisaron intubación y ventilación mecánica invasiva por edema agudo de pulmón (2) o ictus (1) (tabla 2), con una mediana de ventilación mecánica invasiva de 84 [57-96] h, mientras que en nuestra serie general es de 312 [126-564] h. El tiempo de awake ECMO previo a la necesidad de intubación fue de 6, 60 y 64 h en dichos pacientes. La mediana de estancia en UCI fue de 16 [14-18] días y la de estancia hospitalaria, 37 [28-59] días.
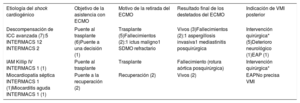
Resumen de las asistencias
| Etiología del shock cardiogénico | Objetivo de la asistencia con ECMO | Motivo de la retirada del ECMO | Resultado final de los destetados del ECMO | Indicación de VMI posterior |
|---|---|---|---|---|
| Descompensación de ICC avanzada (7):5 INTERMACS 12 INTERMACS 2 | Puente al trasplante (6)Puente a una decisión (1) | Trasplante (5)Fallecimientos (2):1 ictus maligno1 SDMO refractario | Vivos (3)Fallecimientos (2):1 aspergillosis invasiva1 mediastinitis posquirúrgica | Intervención quirúrgica* (5)Deterioro neurológico (1)EAP (1) |
| IAM Killip IV INTERMACS 1 (1) | Puente al trasplante | Trasplante | Fallecimiento (rotura aórtica posquirúrgica) | Intervención quirúrgica* |
| Miocardiopatía séptica INTERMACS 1 (1)Miocarditis aguda INTERMACS 1 (1) | Puente a la recuperación (2) | Recuperación (2) | Vivos (2) | EAPNo precisa VMI |
EAP: edema agudo de pulmón; ECMO: IAM: infarto agudo de miocardio; ICC: insuficiencia cardiaca crónica; SDMO: síndrome de disfunción multiorgánica; VMI: ventilación mecánica invasiva.
En cuanto a las complicaciones, 9 pacientes (90%) tuvieron al menos 1 complicación asociada con la asistencia o la situación clínica, con una distribución equiparable a lo publicado. La más frecuente fue la hemorragia pericanular (5), seguida de la isquemia de extremidades inferiores (4), otras hemorragias no intracraneales (2), ictus (1) y el fallo del oxigenador (1). Como otras complicaciones, el 60% presentó lesión renal aguda (5 antes de la asistencia y 1 tras iniciarla, que precisó terapia de depuración extrarrenal, con recuperación total en el 100%); el 40%, infecciosa (3 asociadas con catéter intravascular y 1 urinaria), 4 síndromes confusionales, e ictus (tabla 1). Sin embargo, cabe destacar en este apartado la ausencia de infecciones respiratorias y de debilidad del paciente crítico (en nuestra serie general de ECMO-VA, incidencias del 23 y el 20% respectivamente, similares a las de la bibliografía actual). La mortalidad de los pacientes destetados del ECMO tras llegar al trasplante cardiaco estuvo relacionada con el posoperatorio de este.
Se presenta la primera serie publicada en España de awake ECMO-VA en pacientes con SC, además con resultados prometedores. Como conclusiones y teniendo en cuenta las limitaciones de una serie de casos, nuestros resultados son coherentes con la escasa bibliografía internacional. Así, se demuestra que el implante de ECMO-VA, al menos en los centros donde se dispone de suficiente experiencia en el manejo de dichos tratamientos de asistencia extracorpórea en pacientes despiertos y en ventilación espontánea para asistencia circulatoria en el SC, es una opción terapéutica viable y con buenos resultados: menos complicaciones asociadas con la sedación y la ventilación mecánica invasiva con buenos resultados en cuanto a la morbimortalidad. No obstante, son necesarios más estudios para consolidar dicha práctica y optimizar una adecuada selección de los pacientes.