La amiloidosis cardiaca es una enfermedad producida por el depósito extracelular de fibrillas anormales insolubles en el corazón. Los 2 tipos principales son: amiloidosis primaria, por depósito de cadenas ligeras, y amiloidosis por transtiretina (ATTR) con sus 2 formas: hereditaria (ATTRh) (por mutaciones en el gen TTR) y la tipo silvestre (wild type) (ATTRwt). En la ATTRh se han descrito más de 120 mutaciones, como Val50Met (la más común, se asocia con polineuropatía amiloidótica familiar), y la Val142Ile (fenotipo predominantemente cardiológico)1. La identificación de pacientes cuya amiloidosis se debe a un defecto genético tiene gran importancia, ya que modifica el tratamiento y tiene gran trascendencia para los familiares2. La ATTRwt tiene una afección casi exclusivamente cardiaca y está muy infradiagnosticada. Se ha descrito su frecuente asociación con la estenosis de válvula aórtica (EAo), con prevalencias de entre el 5,3 y el 16% de ATTRwt en pacientes con EAo, a los que confiere un peor pronóstico3. Además también existen ya tratamientos para la ATTR que están cambiando su pronóstico.
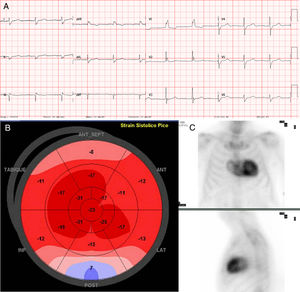
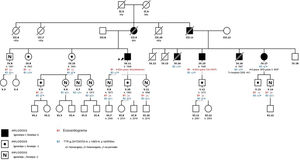
Se presenta el caso de una extensa familia originaria de Mallorca cuyo probando es un varón de 72 años en seguimiento en consultas por EAo. Tenía antecedentes de hipertensión de larga evolución, dislipemia, diabetes mellitus tipo 2, insuficiencia renal crónica por nefropatía intersticial de etiología no filiada desde 10 años antes y cirugía bilateral de tendones de la mano (dedos en gatillo) a los 60 años. Seguía tratamiento con torasemida 5mg/día, metformina, sitagliptina y atorvastatina. En el seguimiento se halló EAo sintomática por disnea de moderados esfuerzos. A la exploración física se observaron: presión arterial de 110/60mmHg, tonos rítmicos, soplo sistólico aórtico IV/VI y murmullo vesicular conservado, sin signos de insuficiencia cardiaca. El electrocardiograma (figura 1) mostró un ritmo sinusal, PR largo, bloqueo de rama derecha, Q inferior y bajos voltajes en las derivaciones de las extremidades. El ecocardiograma mostró hipertrofia ventricular izquierda concéntrica moderada (15 mm) con fracción de eyección conservada y parámetros de EAo grave (área, 0,8cm2; gradiente máximo/medio, 67/42mmHg). Se reemplazó la válvula aórtica por una bioprótesis, sin complicaciones. En el seguimiento se consideró la posibilidad de que concurrieran ATTR y EAo, debido a una serie de signos de sospecha: a) varón mayor de 65 años; b) electrocardiograma con patrón de seudoinfarto (Q inferior sin enfermedad coronaria), trastorno de la conducción (bloqueo de rama derecha y bloqueo auriculoventricular de primer grado) y bajos voltajes (discordancia con hipertrofia ventricular); c) antecedente de tenosinovitis estenosante de la mano (se asocia con túnel carpiano), y d) hipertensión de larga evolución «curada» (presión arterial de 110/60mmHg solo con torasemida 5 mg). Se realizó un nuevo ecocardiograma con strain longitudinal (figura 1), que mostró el típico patrón de amiloidosis con reducción del strain en los segmentos basales y conservación apical, y una gammagrafía miocárdica con 99mTc-ácido 3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) (figura 1), que mostró captación cardiaca de grado 3 y confirmó el diagnóstico de ATTR tras constatarse las cadenas ligeras y la inmunofijación en sangre y orina negativas. La secuenciación del gen TTR halló la mutación Val50Met en heterocigosis. Valorado por neurología y medicina interna, se observó una neuropatía de fibra fina y disautonomía (Sudoscan patológico y disfunción eréctil), y nefrología concluyó que se trataba de una enfermedad renal crónica en relación con afección glomerular e intersticial por depósitos de transtiretina. Finalmente se realizó estudio familiar (figura 2), que mostró a 1 primo también con EAo tratada mediante implante percutáneo de válvula aórtica e implante de marcapasos por bloqueo auriculoventricular completo, que tras la evaluación presentaba también ATTRh (hipertrofia moderada con DPD de grado 3), 1 prima con ATTRh y marcapasos (en ambos primos se descartó amiloidosis primaria), y otros 2 primos y 1 tío del probando fallecidos como consecuencia de polineuropatía amiloidótica familiar. La madre del probando, fallecida por cardiopatía, se consideró portadora obligada. Se estudió clínica y genéticamente a otros 13 familiares, y se halló a 6 portadores asintomáticos (en seguimiento) y otros 6 no portadores.
La asociación entre EAo y ATTR se ha descrito en diferentes estudios, pero casi siempre en relación con la del tipo silvestre1,3 (1 único caso con Val142Ile4). Esta es la primera familia con la mutación Val50Met en que se describe esta concomitancia. Se trata de una extensa familia, con 2 afectados por EAo grave y ATTRh, y con diversos afectados con fenotipo cardiaco predominante, neurológico o mixto. Si bien la fisiopatología de la asociación entre EAo y ATTR no está clara, se ha postulado que el depósito de amiloide en la válvula aórtica podría desencadenar o contribuir al desarrollo de EAo, si bien no se puede descartar que ambas afecciones sean independientes y su comorbilidad se deba a su alta prevalencia en mayores de 65 años. Asimismo es posible la coexistencia de 2 tipos de amiloide en el corazón (hereditario y silvestre). Es importante recalcar que la presencia de EAo debe alertar al clínico en la búsqueda de signos de alerta de ATTR (clínica, antecedentes, electrocardiograma, ecocardiograma, etc.)5, por diversas razones: a) modifica el tratamiento, ya que se debe evitar ciertos fármacos (antagonistas del calcio, digoxina, bloqueadores beta, inhibidores de la enzima de conversión de la angiotensina); b) la ATTR puede actuar como un modificador de la EAo y producir un fenotipo más grave (más insuficiencia cardiaca y arritmias), y la posibilidad de afección de otros órganos por el depósito, incluso algunos autores prefieren el implante percutáneo de la válvula aórtica para estos pacientes, dado su mayor riesgo quirúrgico1; c) los pacientes se pueden beneficiar de fármacos específicos para ATTR ya aprobados que modifican el curso de la enfermedad; d) porque el diagnóstico es sencillo realizando gammagrafía cardiaca, y e) porque si es una ATTRh, puede haber un 50% de familiares en riesgo, a los que se puede identificar precozmente.
FINANCIACIÓNInstituto de Investigación Sanitaria de Palma (IdISBa), Palma de Mallorca, Islas Baleares, España.