El diagnóstico de los síndromes coronarios agudos sin elevación del segmento ST (SCASEST) se basa en 3 pilares fundamentales: la presentación clínica, el electrocardiograma de 12 derivaciones y la medición de la troponina cardiaca. Los avances en el desarrollo de ensayos de troponina cardiaca de alta sensibilidad (hs-cTn) han permitido mejorar sustancialmente la capacidad de detectar daño miocárdico en un periodo de tiempo más breve, por lo que la hs-cTn se ha establecido como el biomarcador de referencia en la evaluación de pacientes con sospecha de SCASEST. Su implementación en la práctica clínica permite una confirmación del diagnóstico más rápida, especialmente entre los pacientes de bajo riesgo, así como un descarte del mismo más seguro y rápido, con sus consecuencias terapéuticas. Las guías actuales para el diagnóstico del SCASEST recomiendan el uso de la hs-cTn aplicada en algoritmos de diagnóstico rápido basados en la toma de muestras seriadas de hs-cTn en las primeras horas. El presente trabajo ofrece una visión general sobre el uso de la hs-cTn para la detección precoz del SCASEST.
Palabras clave
Cada año en todo el mundo más de 15 millones de pacientes acuden a los servicios de urgencias (SU) con síntomas compatibles con un infarto de miocardio (IM)1. Un diagnóstico temprano del IM es crucial para iniciar inmediatamente un tratamiento basado en la evidencia y sumamente eficaz.
El término SCASEST incluye el infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) y la angina inestable. A los pacientes con síntomas que indican un síndrome coronario agudo (SCA), se les debe hacer un electrocardiograma en los primeros 10min. Tras haber descartado la presencia de signos electrocardiográficos de obstrucción aguda de un vaso (IM con elevación del segmento ST), la troponina cardiaca (cTn) permitirá diferenciar el IAMSEST de la angina inestable2,3.
En consecuencia, la evaluación de los pacientes con dolor torácico agudo se basa en estos 3 pilares: cuadro clínico, antecedentes y exploración física, electrocardiograma de 12 derivaciones y cTn T e I2,4.
En el IM, el miocardio necrótico libera las cTn T e I en forma de proteínas inalteradas y de productos de degradación, por lo que pueden detectarse en la sangre5. Las cTn T e I son marcadores de la lesión de los miocardiocitos más sensibles y específicos que otros marcadores como la creatincinasa, su isoenzima de banda miocárdica y la mioglobina6. Los avances técnicos en el análisis de las cTn han llevado al perfeccionamiento de la capacidad clínica de detección y cuantificación de la lesión miocárdica. Estos nuevos métodos de análisis, denominados pruebas de cTn de alta sensibilidad (hs-cTn), son capaces de detectar con exactitud las cTn en concentraciones inferiores que los análisis de generaciones anteriores, lo cual les proporciona una mayor sensibilidad en la detección de un IM de menor tamaño y la capacidad de identificar antes el IM, con lo que el tiempo transcurrido hasta la segunda determinación de la hs-cTn puede reducirse significativamente, con la consiguiente reducción del tiempo transcurrido hasta el diagnóstico y la mejora de la eficiencia en el SU. Por tal motivo, en las guías de práctica clínica vigentes, las determinaciones seriadas de las hs-cTn se han convertido en el biomarcador de elección para la evaluación de los pacientes con dolor torácico agudo2,7.
ALGORITMOS QUE USAN LA TROPONINA CARDIACA DE ALTA SENSIBILIDADLa ventaja clínica más importante de los nuevos métodos de análisis más sensibles de la cTn es su capacidad de reducir sustancialmente el intervalo inicial «ciego a la troponina» en las primeras horas siguientes al inicio del IM. Esto ha permitido crear y validar ampliamente algoritmos diagnósticos basados en la determinación temprana de la hs-cTn que utilizan análisis seriados de la hs-cTn. Algunos de estos algoritmos son la recomendación actual que se incluye en la guía de la Sociedad Europea de Cardiología (ESC) para la evaluación de los pacientes con sospecha de SCA, por lo que está justificado su examen en profundidad.
Algoritmos de hs-cTn de 0h/3h de la ESCLa ESC introdujo por primera vez el algoritmo de 0h/3h de la ESC en 20118. Con esta estrategia, se puede descartar el IM con un valor predictivo negativo > 98% si las concentraciones de hs-cTn se mantienen dentro del intervalo de valores normal (por debajo del correspondiente centil 99) en las muestras de sangre extraídas en el momento de la presentación clínica inicial y al cabo de 3h y si el paciente cumple otros 2 requisitos adicionales: ausencia de dolor y riesgo bajo de mortalidad hospitalaria cuantificado mediante una puntuación del Global Registry of Acute Coronary Events (escala GRACE) < 1402,7. La guía actual de la ESC recomienda esta estrategia tan solo como alternativa a los algoritmos de hs-cTn de 0h/1h y de 0h/2h de la ESC, por lo que se le asigna una recomendación de clase IIa2.
Algoritmos de hs-cTn de 0h/1h de la ESCEl concepto de estas estrategias se basa en la determinación seriada de la hs-cTn en el momento de la presentación clínica inicial (0h) y al cabo de 1h. La elaboración de estos algoritmos tenía como objetivo alcanzar una seguridad muy alta predefinida (cuantificada por el valor predictivo negativo y la sensibilidad para el IAMSEST) y una eficacia muy alta (porcentaje de pacientes seleccionados precozmente) para descartar el IAMSEST, así como mejorar el valor predictivo positivo y la especificidad respecto al IAMSEST1,2.
La estrategia de 0h/1h utiliza exclusivamente los datos de hs-cTn para el triaje de los pacientes sin el empleo de una puntuación de riesgo clínico concreta, y alcanza con ello un valor predictivo negativo y una sensibilidad comparables para descartar el diagnóstico al tener en cuenta también los cambios absolutos de la concentración en el plazo de 1 h. La ausencia de un cambio absoluto relevante entre el momento de la presentación clínica inicial y 1 h después, junto con el hecho de que ambas concentraciones deban ser normales, evita la necesidad de usar una puntuación predefinida para descartar sin riesgo el IM.
En consecuencia, el uso de estas estrategias es sumamente eficaz y permite un triaje temprano y exacto en aproximadamente el 75% de los pacientes: en un 60% para descartar el IM y en un 15% para establecerlo1.
Algoritmo de hs-cTn de 0h/2h de la ESCEl concepto del algoritmo de 0h/2h de la ESC es idéntico al de 0h/1h, pero en este caso la segunda extracción de sangre se hace al cabo de 2h (en vez de 1 h) y los valores de corte aplicados son diferentes. Este algoritmo se recomienda como estrategia alternativa a la del algoritmo de 0h/1h de la ESC y se le asigna también una recomendación de clase I2.
Algoritmo de hs-cTn de 0h/1h de la ESC para la sospecha de infarto de miocardioInicialmente, 4 estudios mostraron que la seguridad y la cronología utilizada en el algoritmo de 0h/3h de la ESC podían mejorarse con un algoritmo de hs-cTn de 0h/1h9,10. La seguridad y la eficacia de estos nuevos algoritmos de hs-cTn de 0h/1h se verificaron en otros 3 estudios de implementación (uno de ellos aleatorizado)4,10,11. En consecuencia, el algoritmo de hs-cTn de 0h/1h de la ESC es la estrategia preferida y recomendada en la guía de la ESC (recomendación de clase I, nivel de evidencia A)2.
El concepto del algoritmo de 0h/1h de la ESC se basa en 2 puntos:
- •
Las hs-cTn son liberadas por el miocardio necrótico a causa de la interrupción en el aporte de oxígeno. Así pues, cuanto mayores sean las concentraciones de hs-cTn en la sangre, mayor es la probabilidad de un IM.
- •
El cambio absoluto de las concentraciones de hs-cTn en el plazo de 1 h puede servir como indicador indirecto del cambio absoluto que se produzca a las 3 y las 6h12–14. Por ejemplo, un cambio absoluto de 6 ng/l en un plazo de 3h indica un cambio de 4 ng/l tras 2h o 2 ng/l tras 1 h. Cuanto mayor sea el cambio dinámico al cabo de 1 h (aumento o disminución de las concentraciones), mayor es la probabilidad de un IM.
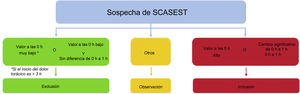
En función de la concentración de hs-cTn en el momento de la presentación clínica inicial y de su modificación en 1 h, se puede clasificar a los pacientes en 3 grupos diferentes: exclusión, inclusión y zona de observación (figura 1). Los valores de corte propuestos (figura 1 y tabla 1) son específicos de cada análisis y se obtuvieron y validaron en estudios grandes12,13,15–36.
Figura central. Algoritmo de 0h/1h para la exclusión o inclusión mediante análisis de hs-cTn en pacientes hemodinámicamente estables que acuden al SU por un síndrome coronario agudo sin elevación del segmento ST (SCASEST). El infarto agudo de miocardio sin elevación del segmento ST (IAMSEST) puede descartarse en la presentación inicial si la concentración de troponina cardiaca de alta sensibilidad (hs-cTn) es muy baja. El IAMSEST puede descartarse también mediante la combinación de unos valores iniciales bajos y la ausencia de un aumento relevante en el plazo de 1 h. Los pacientes tienen una alta probabilidad de IAMSEST si la concentración de hs-cTn en el momento de la presentación inicial está al menos moderadamente elevada o las concentraciones de hs-cTn muestran un claro aumento en la primera hora. Los valores de corte son específicos de cada método de análisis (véase la tabla 1) y se han derivado de manera que cumplan unos criterios predefinidos de sensibilidad y especificidad para el IAMSEST. Adaptado con permiso de Collet et al.2.
Valores de corte (ng/l) de la concentración específicos para cada método de análisis en los algoritmos de 0h/1h y 0h/2h
| Algoritmo 0 h/1 h | Muy baja | Baja | Sin cambio 1 h | Alta | Muy alta |
|---|---|---|---|---|---|
| hs-cTn T (Elecsys; Roche)13 | <5 | <12 | <3 | ≥ 52 | ≥ 5 |
| hs-cTn I (Architect; Abbott)12 | <4 | <5 | <2 | ≥ 64 | ≥ 6 |
| hs-cTn I (Centaur; Siemens)18 | <3 | <6 | <3 | ≥ 120 | ≥ 12 |
| hs-cTn I (Access; Beckman Coulter)15 | <4 | <5 | <4 | ≥ 50 | ≥ 15 |
| hs-cTn I (Clarity; Singulex)19 | <1 | <2 | <1 | ≥ 30 | ≥ 6 |
| hs-cTn I (Vitros; Clinical Diagnostic)29 | <1 | <2 | <1 | ≥ 40 | ≥ 4 |
| hs-cTn I (Pathfast; LSI Medicine)34 | <3 | <4 | <3 | ≥ 90 | ≥ 20 |
| hs-cTn I (Triage True; Quidel)36 | <4 | <5 | <3 | ≥ 60 | ≥ 8 |
| Algoritmo 0 h/2 h | Muy baja | Baja | Sin cambio 2 h | Alta | Muy alta |
| hs-cTn T (Elecsys; Roche)35 | <5 | <14 | <4 | ≥ 52 | ≥ 10 |
| hs-cTn I (Architect; Abbott)17 | <4 | <6 | <2 | ≥ 64 | ≥ 15 |
| hs-cTn I (Centaur; Siemens)18 | <3 | <8 | <7 | ≥ 120 | ≥ 20 |
| hs-cTn I (Access; Beckman Coulter)30 | <4 | <5 | <5 | ≥ 50 | ≥ 20 |
| hs-cTn I (Clarity; Singulex)19 | <1 | PDD | PDD | ≥ 30 | PDD |
| hs-cTn I (Vitros; Clinical Diagnostic)29 | <1 | PDD | PDD | ≥ 40 | PDD |
| hs-cTn I (Pathfast; LSI Medicine)34 | <3 | PDD | PDD | ≥ 90 | PDD |
| hs-cTn I (Triage True; Quidel)36 | <4 | PDD | PDD | ≥ 60 | PDD |
hs-cTn: troponina cardiaca de alta sensibilidad; PDD: pendiente de determinar.
La ventaja de estos algoritmos radica en la posibilidad de descartar un IM en unas pocas horas siguientes al inicio de los síntomas con una seguridad muy alta.
Zona de exclusiónSi el inicio del dolor torácico se ha producido en un plazo > 3h tras la presentación inicial en el SU y los valores de hs-cTn en el momento de la presentación son muy bajos (indetectable), puede descartarse ya un diagnóstico de IM con una sola muestra de sangre. De modo análogo, también se puede descartar el IM si las concentraciones de hs-cTn en el momento de la presentación inicial son bajas y no hay cambios relevantes durante la primera hora (figura 1). El valor predictivo negativo de esta vía fue > 99% en varios estudios de validación4,10,11, sin tener en cuenta el juicio clínico ni los cambios en el electrocardiograma.
En la zona de exclusión, tras haber descartado otros diagnósticos con peligro para la vida (como neumotórax, angina inestable o disección aórtica), el paciente puede ser candidato a un alta temprana para tratamiento ambulatorio. Incluso después de descartar el IM, pueden ser necesarias otras exploraciones complementarias (tomografía computarizada coronaria o prueba de estrés no invasiva para los pacientes con riesgo bajo a intermedio y coronariografía invasiva para los pacientes con una probabilidad clínica muy alta de angina inestable). Todas estas evaluaciones pueden ser ambulatorias, en función del juicio clínico y el perfil de riesgo del paciente2.
Zona de inclusiónEn cambio, los pacientes con unas concentraciones de hs-cTn muy altas en el momento de la presentación clínica inicial o con modificaciones relevantes en la primera hora pueden clasificarse en la zona de inclusión.
El valor predictivo positivo para esta zona fue de entre el 70 y el 75% en los distintos estudios. Sin embargo, la mayoría de los pacientes que en el triaje fueron clasificados en el grupo de inclusión pero no tenían un IM sí presentaron otros trastornos con peligro para la vida, como síndrome de tako-tsubo y miocarditis, por lo que eran candidatos a una coronariografía invasiva temprana e ingreso en una unidad de cuidados intensivos2.
Zona de observaciónA los pacientes que no cumplen los criterios de inclusión y exclusión se les asigna la zona de observación. Este es un grupo ampliamente heterogéneo de pacientes en el que se ha observado gran mortalidad (comparable a la de los pacientes de la zona de inclusión). Es de capital importancia la evaluación individualizada con base en el perfil de riesgo específico del paciente (por ejemplo, con puntuaciones de riesgo). Además, generalmente se necesita una tercera determinación de las cTn a las 3h y una ecocardiografía como pasos siguientes37,38.
Recientemente se han obtenido y validado valores de corte, específicos para los pacientes asignados a la zona de observación, para el análisis de hs-cTn T (una combinación de concentración de hs-cTn T a las 3 h < 15 ng/l y un cambio absoluto de 0h/3h < 4 ng/l), que tienen una seguridad y una eficacia aceptables para la ulterior toma de decisiones38. En la actualidad no se dispone de valores de corte específicos para otros análisis de hs-cTn I en la zona de observación.
Debe considerarse la posible conveniencia de una coronariografía invasiva para los pacientes con alto grado de sospecha clínica de SCASEST (aumento relevante de la troponina cardiaca entre la presentación clínica inicial y las 3 h), mientras que para los pacientes con una probabilidad baja o intermedia de este trastorno según el criterio clínico deben considerarse las técnicas de imagen no invasivas con angiografía por tomografía computarizada coronaria o, cuando no pueda disponerse de ella con facilidad, pruebas de estrés tras el alta del SU para su traslado a planta. No está indicada ninguna prueba diagnóstica adicional cuando se han identificado otros trastornos alternativos, como una respuesta de frecuencia ventricular rápida a la fibrilación auricular, una anemia intensa o una emergencia hipertensiva2.
USO CLÍNICO DEL ALGORITMO DE HS-CTN DE 0H/1H DE LA ESCAunque estas estrategias simplifican considerablemente el triaje de los pacientes en el SU, para su aplicación exitosa en la práctica clínica es de capital importancia una formación adecuada de los clínicos y las enfermeras. Hay varios factores que deben resaltarse cuando se emplea uno de estos algoritmos de diagnóstico rápido para el IAMSEST:
Algoritmos con métodos de análisis específicosLos puntos de decisión derivados y luego validados son específicos para el método de análisis utilizado (figura 1 y tabla 1). Solamente pueden usarse para los métodos propuestos con que se ha validado el algoritmo. Así pues, el primer paso al utilizar estas estrategias es determinar qué método de análisis se está usando en el centro1. Generalmente, los colegas del laboratorio de análisis pueden ayudar con esa información. Si no se dispone de ninguno de esos análisis, se debe considerar una estrategia alternativa.
Tener presente el tiempo de obtención de los resultados del análisisEl tiempo transcurrido hasta la decisión se debe al que se tarda en obtener la muestra de sangre y el necesario para el resultado del análisis. El uso de los algoritmos de 0h/1h de la ESC es independiente del tiempo de obtención de los resultados (tiempo transcurrido entre la extracción de la muestra de sangre y la obtención de los resultados del análisis). Los tiempos de 0h y 1h hacen referencia al momento en que se obtiene la muestra de sangre. A veces la segunda muestra de sangre tiene que obtenerse incluso antes de disponer de los resultados del análisis de la primera (los resultados suelen estar disponibles en unos 60min tras la obtención de la muestra), pero esto no afecta a la interpretación de los algoritmos. En muchos centros, el tiempo de obtención de los resultados es con frecuencia > 1 h. La aplicación del algoritmo de 0h/1h de la ESC también es posible en esos centros, ya que el plazo de 1 h se refiere únicamente al momento de la segunda muestra de sangre. Para optimizar la eficacia, se debe instruir al equipo de enfermería para la extracción de sangre tras 1 h a todos los pacientes con independencia de cuándo se obtenga el resultado correspondiente a las 0 horas.
El hecho de documentar el tiempo al que corresponde la extracción de sangre a las 0 horas permite la determinación exacta de la ventana temporal (±10 min) para la extracción correspondiente a 1 h. Si por cualquier motivo la extracción de sangre a la hora 1 (±10 min) no ha sido posible, deberá extraerse la muestra a las 2h y se aplicará el algoritmo de 0h/2h de la ESC (si se ha validado para el método de análisis utilizado).
Algoritmos de triajeEstos son algoritmos de triaje y no de alta/ingreso. Aun en el caso de que se haya descartado el IM, sigue siendo necesario esclarecer el diagnóstico. Además, en los pacientes con un patrón claro de angina en aumento o inestable, deben hacerse otras exploraciones diagnósticas adicionales.
Por otra parte, hay que emplear los algoritmos solo en conjunto con una evaluación clínica completa, que incluirá una evaluación detallada de las características del dolor torácico y el electrocardiograma y deberá aplicarse solamente tras haber descartado un IM con elevación del segmento ST u otros trastornos con peligro para la vida (p. ej., disección de aorta).
De igual modo, los algoritmos rápidos basados en la hs-cTn solo deben aplicarse a pacientes que acuden al SU con sospecha de infarto agudo de miocardio y no se deben aplicar a una población no seleccionada atendida en el SU (pacientes con ictus o sepsis)2,3,39.
FINANCIACIÓNNo se dispuso de ninguna financiación para el presente trabajo.
CONTRIBUCIÓN DE LOS AUTORESTodos los autores redactaron la versión inicial y revisaron el manuscrito.
CONFLICTO DE INTERESESM. Rubini Gimenez declara haber recibido subvenciones para investigación de la Swiss Heart Foundation y la Swiss National Foundation (P400PM_180828) y honorarios por conferencias de Roche, Ortho Clinical Diagnostics, Quidel y Siemens. J. Boeddinghaus ha recibido subvenciones de investigación de la Universidad de Basilea y la División de Medicina Interna, Swiss Academy of Medical Sciences, la Gottfried and Julia Bangerter-Rhyner-Foundation, y honorarios por conferencias de Siemens, Roche Diagnostics y Ortho Clinical Diagnostics, sin relación con el trabajo presentado. T. Nestelberger ha recibido ayuda para investigación de la Swiss National Science Foundation (P400PM_191037/1), la Swiss Heart Foundation (FF20079), la Prof. Dr. Max Cloëtta Foundation, la Margarete und Walter Lichtenstein-Stiftung (3MS1038), la Universidad de Basilea y el Hospital Universitario de Basilea, así como honorarios por conferencias/honorarios por consultoría de Siemens, Beckman Coulter, Bayer, Ortho Clinical Diagnostics y Orion Pharma, todas ellas sin relación con el trabajo presentado. l. Koechlin ha recibido una subvención de investigación de la Swiss Heart Foundation, la Universidad de Basilea, la Swiss Academy of Medical Sciences y la Gottfried and Julia Bangerter-Rhyner Foundation, así como la Freiwillige Akademische Gesellschaft Basel y honorarios por conferencias de Roche Diagnostics, Siemens y Abbott sin relación con el trabajo presentado. P. López-Ayala ha recibido subvenciones de investigación de la Swiss Heart Foundation (FF20079 y FF21103) y honorarios por conferencias de Quidel, pagados al centro, sin relación con el trabajo presentado. C. Mueller ha recibido ayuda para investigación de la Swiss National Science Foundation, la Swiss Heart Foundation, la KTI, la Unión Europea, la Universidad de Basilea, Hospital Universitario de Basilea, Abbott, Beckman Coulter, Biomerieux, Idorsia, Ortho Clinical Diagnostics, Quidel, Roche, Siemens, Singulex y Sphingotec, así como honorarios por conferencias/honorarios por consultoría de Acon, Amgen, AstraZeneca, Boehringer Ingelheim, Bayer, BMS, Idorsia, Novartis, Osler, Roche y Sanofi, sin relación con el trabajo presentado.