La amiloidosis hereditaria por transtirretina (ATTRv) es una enfermedad multisistémica con herencia autosómica dominante y penetrancia variable, causada por mutaciones en el gen TTR. Se han descrito más de 120 variantes genéticas asociadas con la enfermedad, algunas de ellas consideradas endémicas de ciertas zonas geográficas y con una fuerte correlación genotipo-fenotipo1,2. Los órganos más frecuentemente afectados en la ATTRv son el corazón y el sistema nervioso. En el corazón, la ATTRv se manifiesta habitualmente en forma de insuficiencia cardiaca, trastornos de la conducción o fibrilación auricular. La afección neurológica se manifiesta como polineuropatía sensitiva-motora distal y simétrica, a menudo junto con síntomas disautonómicos1,2. Hasta hace poco, la única opción terapéutica era el trasplante hepático; sin embargo, hoy se cuenta con fármacos específicos con los que se ha demostrado un aumento de la supervivencia de estos pacientes3.
La variante p.Ser43Asn del gen TTR es una variante causal de ATTRv muy infrecuente que hasta la fecha se ha descrito solo en 7 casos4–6. Al ser una variante muy inhabitual, no existe suficiente información que permita conocer el curso clínico esperable de la enfermedad y cuál es el seguimiento que se debe dar a los sujetos portadores de la variante.
Tras identificar a 3 familias independientes afectadas por ATTRv causada por la variante p.Ser43Asn, se propuso estudiar las características clínicas y la evolución de la ATTRv por p.Ser43Asn y dilucidar posibles áreas geográficas donde la variante pudiera ser endémica.
Se realizó un estudio observacional retrospectivo de todos los sujetos portadores de la variante p.Ser43Asn seguidos en nuestro centro. El estudio fue aprobado por el Comité de Ética del Hospital Puerta de Hierro, que no consideró necesario obtener el consentimiento de los participantes. En los casos índice la variante se detectó mediante la secuenciación de los 4 exones del gen TTR y en los familiares, mediante secuenciación del exón afecto. La afección cardiaca se definió por un grosor del ventrículo izquierdo ≥ 12mm o una gammagrafía cardiaca positiva con captación de 99mTc-DPD grado 2 o 3 de Perugini, tras la exclusión de discrasia de células sanguíneas3. La afección neurológica se determinó por la presencia de síntomas neurológicos compatibles con la enfermedad junto con tests neurológicos alterados1. Las variables recogidas incluían características clínicas y resultados de pruebas complementarias en la primera evaluación, así como de la evolución y de los eventos clínicos acontecidos durante el seguimiento. Las variables cuantitativas se presentaron como mediana [intervalo intercuartílico] y las categóricas, como número y porcentaje.
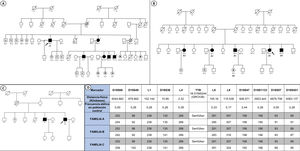
Se identificó a 8 individuos (3 probandos y 5 familiares; 4 varones; edad, 29-60 años) portadores de la variante p.Ser43Asn procedentes de 3 familias independientes (figura 1A-C). La tabla 1 muestra sus características. Las 3 familias no estaban relacionadas, pero todas eran originarias del sur de Ecuador y más concretamente de la región de Loja. Todos los probandos presentaron afección cardiaca y neurológica en la primera evaluación, mientras que entre los familiares solo 1 mostró fenotipo mixto, 2 tenían neuropatía aislada, 1 miocardiopatía exclusiva y 1 era un portador asintomático. Encontramos antecedentes de síndrome del túnel carpiano en 4 pacientes en el momento de la primera evaluación. La mediana de edad al inicio de la enfermedad era 49,8 [44,0-58,8] años. La miocardiopatía se caracterizó por síntomas avanzados (New York Heart Association II-III) en todos los probandos. Ningún paciente tenía fibrilación auricular o marcapasos antes de la primera evaluación. Todos los pacientes con afección neurológica presentaron síntomas sensitivos aislados (Polyneuropathy Disability score [PND] I) con una mediana en la Neuropathy Impairment Score (NIS) de 3 [2-11]. Cinco pacientes recibieron tafamidis y 1 inició patisirán como tratamiento de primera línea al ser diagnosticado en una fase avanzada de la enfermedad. Tras una mediana de seguimiento de 13,2 [6,2-17,9] meses, 4 pacientes precisaron ingreso por insuficiencia cardiaca, 2 desarrollaron fibrilación auricular de novo y 2 requirieron implante de marcapasos por bloqueo auriculoventricular completo. Una de las pacientes evolucionó a shock cardiogénico refractario y requirió asistencia circulatoria mecánica biventricular como puente a trasplante cardiaco emergente. La paciente tuvo una evolución tórpida postrasplante y falleció por complicaciones infecciosas en el posoperatorio. Ningún paciente empeoró en la escala PND de neuropatía durante el seguimiento. Por último, se realizó un estudio de haplotipos con muestras de ADN de las 3 familias que mostró concordancia en los 11 marcadores genéticos alrededor de la variante p.Ser43Asn, lo que indica que las tres familias probablemente provienen de un ancestro común reciente (12,4 generaciones; intervalo de confianza del 95% [IC95%], 5,4-28,9) (figura 1D).
Árboles genealógicos de las familias estudiadas (A-C) y estudio de haplotipos (D). Los cuadrados indican varones y los círculos, mujeres. Los símbolos blancos representan a individuos sanos; los negros, a individuos con diagnóstico de ATTRv, y los grises, a individuos con sospecha de ATTRv. Los símbolos blancos con un punto central son portadores asintomáticos. Los símbolos blancos con una N representan a individuos con un test genético negativo para Ser43Asn. Los individuos A1, B1 y C1 son los probandos de cada familia. La línea diagonal indica a los fallecidos. ATTRv: amiloidosis hereditaria por transtirretina.
Características de los pacientes afectos de ATTRv por la variante Ser43Asn incluidos en el estudio
| Paciente | A1 | B1 | B2 | B3 | B4 | B5 | B6 | C1 |
|---|---|---|---|---|---|---|---|---|
| Sexo | Varón | Mujer | Mujer | Mujer | Varón | Varón | Mujer | Varón |
| Edad al diagnóstico (años) | 50 | 47 | 60 | 58 | 51 | 47 | 29 | 41 |
| País de origen | Ecuador | Ecuador | Ecuador | Ecuador | Ecuador | Ecuador | Ecuador | Ecuador |
| Edad a las manifestaciones iniciales (años) | 50 | 47 | 61 | 59 | 52 | — | — | 40 |
| Afectación cardiológica | Sí 99mTc-DPD (+) | Sí 99mTc-DPD (+) | No 99mTc-DPD (–) | No 99mTc-DPD (–) | Sí 99mTc-DPD (+) | Sí 99mTc-DPD (+) | No | Sí 99mTc-DPD (+) |
| Clase funcional | NYHA II | NYHA II | — | — | NYHA I | NYHA I | — | NYHA III |
| Afectación neurológica | PND I, NIS 11 | PND I, NIS 2 | PND I, NIS 4 | PND I, NIS 11 | PND I, NIS 0 | No | No | PND I, NIS 2 |
| Otras manifestaciones | STC unilateral | — | STC bilateral | — | STC bilateral | — | — | STC unilateral |
| Tratamiento | Tafamidis | Tafamidis | Tafamidis | Tafamidis | Tafamidis | — | — | Patisirán |
| Seguimiento (meses) | 36,1 | 17,0 | 15,6 | 8,1 | 18,9 | 3,3 | 4,4 | 10,8 |
| Eventos | Ingresos por IC, FA de novo y BAV completo | Ingresos por IC, FA de novo, Shock/IC | — | — | Ingreso IC | — | — | Ingreso por IC, BAV completo |
BAV: bloqueo auriculoventricular; FA: fibrilación auricular; IC: insuficiencia cardiaca; NIS: Neuropathy Impairment Score; NYHA: New York Heart Association; OFT: afección oftalmológica; PND: Polyneuropathy Disability score; STC: síndrome del túnel carpiano; TC: trasplante cardiaco; 99mTc-DPD: gammagrafía con tecnecio-99m y ácido 3,3-difosfono-1,2-propanodicarboxílico.
Pese a las limitaciones de un estudio observacional, con una muestra de pacientes pequeña y seguimiento corto, los resultados obtenidos indican que la ATTRv por la variante p.Ser43Asn presenta un fenotipo mixto cardiológico y neurológico de aparición a partir de los 40 años. Dichos resultados contrastan con los casos descritos previamente, en los que la afección neurológica era poco prevalente4-6, y resaltan la importancia de realizar una evaluación neurológica en profundidad que permita iniciar pronto los tratamientos modificadores de la enfermedad. Al igual que en las descripciones previas, la afección cardiológica condiciona el pronóstico con un curso agresivo hacia insuficiencia cardiaca avanzada, mientras que la afección neurológica es leve. Dadas la agresividad del curso clínico y la edad de presentación documentada, se recomienda el seguimiento estrecho de portadores de la variante a partir de los 30-35 años.
Desde el punto de vista epidemiológico, la variante se identificó en 3 familias independientes originarias de la provincia de Loja, Ecuador, con un estudio de haplotipos concordante, lo cual indica un foco endémico para la variante asociado con un efecto fundador. Algunos de los casos previos reportados4,5 proceden también de América Latina (Ecuador y Perú) en línea con nuestros hallazgos. Creemos que la detección de los casos descritos en esta cohorte fuera del país de origen puede guardar relación con el escaso acceso al diagnóstico clínico de ATTRv en Ecuador, así como con la menor disponibilidad de tests genéticos. Aunque son necesarios más estudios para conocer la prevalencia de ATTRv por p.Ser43Asn en Ecuador, creemos que nuestros hallazgos deben conducir a aumentar la sospecha de esta entidad en sujetos con síntomas y signos compatibles con ATTRv que procedan de la región de Loja o de Ecuador.
FINANCIACIÓNEl presente trabajo ha sido financiado por el Instituto de Salud Carlos III (ISCIII) a través del proyecto «PI18/0765 & PI20/01379» (cofinanciado por el Fondo Europeo de Desarrollo Regional/Fondo Social Europeo «Una manera de hacer Europa»/«El FSE invierte en tu futuro»). El Centro Nacional de Investigaciones Cardiovasculares (CNIC) depende del Instituto de Salud Carlos III, del Ministerio de Ciencia e Innovación (MCIN), de la fundación Pro-CNIC y está acreditado como Centro de Excelencia Severo Ochoa (CEX2020-001041-S).
CONTRIBUCIÓN DE LOS AUTORESE. Porres-López y F. de Frutos son primeros autores.
E. Porres-López y F. de Frutos recogieron datos, los analizaron y redactaron el primer borrador. L. Silva-Hernandez, L. Galán y E. González-Lopez recogieron datos y revisaron el trabajo realizando aportaciones intelectuales relevantes. Pablo Garcia-Pavía supervisó, obtuvo financiación y participó en la redacción del trabajo.
CONFLICTO DE INTERESESP. García-Pavía es editor asociado de Revista Española de Cardiología; se ha seguido el procedimiento editorial establecido en la Revista para garantizar la gestión imparcial del manuscrito.
AGRADECIMIENTOSA Elvira Ramil, de la unidad de Biología Molecular y secuenciación de ADN del Instituto de Investigación Puerta de Hierro-Segovia de Arana (Madrid, España), así como a Juan Pablo Ochoa y Enrique Lara Pezzi, del CNIC (Madrid, España), por su colaboración en el estudio de haplotipos.